
- •Государственная фармакопея республики беларусь первое издание
- •Республики Беларусь
- •1. Общие сведения
- •1.1. Общие положения
- •1.2. Другие положения, распространяющиеся на общие и частные фармакопейные статьи
- •Условия хранения лекарственного средства
- •Пределы, указываемые на упаковке
- •1.5. Сокращения и обозначения
- •1.6. Единицы международной системы (си), используемые в фармакопейных статьях, и их соответствие другим единицам
- •2. Методы анализа
- •2.1. Оборудование
- •2.1.1. Каплемер
- •2.1.2. Сравнительная таблица пористости стеклянных фильтров
- •Пористость фильтра (ф.Евр.) (1)
- •Максимальный диаметр пор в микрометрах
- •2.1.3. Лампы с ультрафиолетовым излучением для аналитических целей
- •2.1.4. Сита
- •2.2. Физические и физико-химические методы
- •2.2.1. Определение прозрачности и степени мутности жидкостей
- •2.2.2. Определение степени окрашивания жидкостей
- •2.2.3. Потенциометрическое определение рН
- •2.2.4. Зависимость между реакцией раствора, приблизительным значением рН и цветом индикаторов
- •Изменение цвета
- •2.2.5. Относительная плотность
- •2.2.6. Показатель преломления (индекс рефракции)
- •2.2.7. Оптическое вращение
- •2.2.8. Вязкость
- •1/Прив 1
- •2.2.9. Метод капиллярной вискозиметрии
- •2.2.10. Метод ротационной вискозиметрии
- •2.2.11. Температурные пределы перегонки
- •2.2.14. Температура плавления - капиллярный метод
- •2.2.17. Температура каплепадения
- •2.2.18. Температура затвердевания
- •2.2.21. Флуориметрия
- •2.2.22. Атомно-эмиссионная спектрометрия
- •2.2.23. Атомно-абсорбционная спектрометрия
- •2.2.24. Абсорбционная спектрофотометрия в инфракрасной
- •2.2.25. Абсорбционная спектрофотометрия в ультрафиолетовой видимой областях
- •2. Многокомпонентный спектрофотометрический анализ.
- •2.2.26. Бумажная хроматография
- •2.2.27. Тонкослойная хроматография
- •2.2.28. Газовая хроматография
- •2.2.29. Жидкостная хроматография
- •2.2.30. Эксклюзионная хроматография
- •2.2.31. Электрофорез
- •2.2.32. Потеря в массе при высушивании
- •2.2.33. Спектрометрия ядерного магнитного резонанса
- •2.2.34. Термогравиметрия
- •2.2.35. Осмоляльность
- •2.2.36. Потенциометрическое определение концентрации ионов с использованием ионселективных электродов
- •2.2.37. Рентгенофлуоресцентная спектрометрия
- •2.2.38. Удельная электропроводность
- •2.2.39. Молекулярно-массовое распределение декстранов
- •2.2.40. Спектрофотометрия ближнего ик-диапазона
- •2.2.41. Круговой дихроизм
- •2.2.42. Плотность твердых тел
- •2.2.43. Масс-спектрометрия
- •2.2.44. Определение содержания общего органического углерода в воде для фармацевтического применения
- •2.2.45. Сверхкритическая флюидная хроматография
- •2.2.46. Хроматографические методы разделения
- •2.2.47. Капиллярный электрофорез
- •2.2.48. Рамановская спектрометрия (# спектрометрия комбинационного рассеяния)
- •2.2.54. Изоэлектрическое фокусирование
- •2.3.1. Реакции подлинности (идентификации) на ионы и функциональные группы
- •2.3.2. Идентификация жирных масел методом тонкослойной хроматографии
- •2.3.3. Идентификация фенотиазинов методом тонкослойной хроматографии
- •2.3.4. Определение запаха
- •2.4. Испытания на предельное содержание примесей
- •2.4.1. Аммония соли
- •2.4.2. Мышьяк
- •2.4.3. Кальций
- •2.4.6. Магний
- •2.4.7. Магний и щелочноземельные металлы
- •2.4.8. Тяжелые металлы
- •2.4.15. Никель в полиолах
- •2.4.1.6. Общая зола
- •2.4.21. Посторонние масла в жирных маслах методом тонкослойной хроматографии
- •2.4.22. Посторонние жирные кислоты в маслах методом газовой хроматографии
- •2.4.23. Стерины в жирных маслах
- •2.4.24. Идентификация остаточных растворителей и их количественное определение
- •2.4.25. Остаточные количества этиленоксида и диоксана
- •2.4.27. Никель в гидрогенизированных растительных маслах
- •2.5. Методы количественного определения 2.5.1. Кислотное число
- •2.5.3. Гидроксильное число
- •2.5.4. Йодное число
- •2.5.5. Перекисное (пероксидное) число
- •2.5.6. Число омыления
- •2.5.7. Неомыляемые вещества
- •2.5.8. Определение аминного азота в соединениях, которые содержат первичную ароматическую аминогруппу
- •2.5.9. Определение азота после минерализации серной кислотой
- •2.5.10. Метод сжигания в колбе с кислородом
- •2.5.11. Комплексометрическое титрование
- •2.5.12. Вода: полумикрометод (#Метод к.Фишера)
- •2.5.13. Алюминий в адсорбированных вакцинах
- •2.5.14. Кальций в адсорбированных вакцинах
- •2.5.20. Гексозамины в полисахаридных вакцинах
- •2.5.21. Метилпентозы в полисахаридных вакцинах
- •2.5.24. Диоксид углерода в газах
- •2.5.25. Оксид углерода в газах
- •2.5.26. Оксид азота и диоксид азота в газах
- •2.5.27. Кислород в газах
- •2.5.30. Окисляющие вещества
- •2.5.33. Общий белок
- •2.5.34. Уксусная кислота в синтетических пептидах
- •2.6. Биологические испытания
- •2.6.1. Стерильность
- •2.6.2. Микобактерии
- •2.6.3. Испытания на посторонние вирусы с использованием куриных эмбрионов
- •2.6.4. Испытание на вирусы лейкоза
- •2.6.5. Испытание на посторонние вирусы с использованием клеточных культур
- •2.6.6. Испытание на посторонние агенты с использованием цыплят.
- •2.6.7. Микоплазмы
- •2.6.8 Пирогенность
- •2.6.9. Аномальная токсичность
- •2.6.10. Гистамин
- •2.6.11. Депрессорные вещества
- •2.6.12. Микробиологические испытания нестерильной продукции (суммарное количество жизнеспособных аэробов)
- •2.6.13. Микробилогические испытания нестерильной продукции (испытания на наличие специфических микроорганизмов)
- •0,9 % Раствор натрия хлорида
- •1 % Раствор фенолового красного
- •0,5 % Раствор малахитового зеленого
- •2.6.14. Бактериальные эндотоксины
- •1. Предварительные испытания
- •2. Предельное испытание (метод а) (I) Методика
- •2. Полуколичественное испытание (метод в)
- •1. Турбидиметрический принцип (методы с и f)
- •2.6.15. Активатор прекалликреина
- •2.6.16. Испытания на посторонние агенты в вирусных вакцинах для медицинского применения
- •2.6.17. Испытание на антикомплементарную активность иммуноглобулина
- •2.6.18. Испытание живых вирусных вакцин на нейровирулентность
- •2.6.19. Испытание пероральной вакцины полиомиелита на нейровирулентность
- •5.1. Предотвращение загрязнения
- •5.4 Детектирование
- •7.1 Валидация системы для количественного определения методом
- •7.2. Контроль качества реагентов.
- •7.3. Контроль хода испытания.
- •7.4. Внешняя оценка качества
- •2.6.22. Активированные факторы свертывания крови
- •2.7 Биологические методы количественного определения
- •2.7.1. Иммунохимические методы
- •2.7.2. Количественное определение антибиотиков микробиологическим методом
- •2.7.3. Количественное определение кортикотропина
- •2.7.4. Количественное определение фактора свертывания крови VIII
- •2.7.5. Количественное определение гепарина
- •2.7.6. Количественное определение вакцины дифтерии (адсорбированной)
- •2.7.7. Количественное определение вакцины коклюша
- •2.7.8. Количественное определение вакцины столбняка (адсорбированной)
- •2.7.9. Определение функционального состояния Fc-фрагмента иммуноглобулина
- •2.7.10. Количественное определение фактора свертывания крови человека VII
- •2.7.11. Количественное определение фактора свертывания крови человека IX
- •2.7.12. Количественное определение гепарина в концентратах
- •2.7.13. Количественное определение человеческого анти-d-иммуноглобулина
- •2.7.14. Количественное определение антигенной (иммуногенной) активности вакцины гепатита а
- •2.7.15. Количественное определение вакцины гепатита в (rdna)
- •2.7.16. Количественное определение вакцины коклюша (бесклеточной)
- •2.7.17. Количественное определение антитромбина III человека
- •2.7.18. Количественное определение фактора свертывания крови II
- •2.7.19. Количественное определение фактора свертывания крови х
- •2.7.20. Количественное определение инактивированной вакцины полиомиелита in vivo
- •2.7.22. Количественное определение фактора свертывания крови человека XI
- •2.8. Методы анализа лекарственного растительного сырья и лекарственных средств из него
- •2.8.1. Зола, нерастворимая в хлористоводородной кислоте
- •2.8.4. Коэффициент набухания
- •2.8.5. Определение воды в эфирных маслах
- •2.8.10. Растворимость эфирных масел в спирте
- •2.8.11. Определение 1,8-цинеола в эфирных маслах
- •2.8.12. Определение эфирного масла
- •2.8.13. Остаточное количество пестицидов
- •1. Экстракция
- •2. Очистка
- •3. Количественный анализ
- •Относительные времена удерживания инсектицидов
- •2.8.15. Определение показателя горечи
- •2.8.16. Сухой остаток экстрактов
- •2.8.17. Потеря в массе при высушивании экстракта
- •2.9. Фармацевтико-технологические испытания
- •2.9.1. Распадаемость таблеток и капсул
- •2.9.2. Распадаемость суппозиториев и пессариев
- •2.9.3. Тест «растворение» для твердых дозированных форм
- •2.9.4. Тест «растворение» для трансдермальных пластырей
- •2.9.5. Однородность массы для единицы дозированного лекарственного средства
- •2.9.6. Однородность содержания действующего вещества в
- •2.9.7. Прочность таблеток без оболочки на истирание
- •2.9.8. Прочность таблеток на сжатие
- •2.9.9. Измерение консистенции методом пенетрометрии
- •2.9.10 Содержание этанола
- •2.9.11. Испытание на содержание метанола и 2-пропанола
- •2.9.12. Ситовой анализ
- •2.9.15. Насыпной объем
- •2.9.16. Сыпучесть
- •2.9.17. Определение извлекаемого объема парентеральных лекарственных средств
- •Масса действующего вещества высвобожденного при опорожнении
- •Фракция действующего вещества (%)
- •2.9.19. Загрязнение механическими включениями: невидимые частицы.
- •2.9.20. Загрязнение механическими включениями: видимые частицы
- •2.9.21. Загрязнение механическими включениями: метод микроскопии
- •2.9.22. Опредление времени деформации липофильных суппозиториев
- •2.9.23. Определение плотности твердых частиц при помощи пикнометра
- •2.9.24. Устойчивость суппозиториев и пессариев к разрушению
- •2.9.26. Опредедение удельной площади поверхности методом газовой адсорбции
- •III.1.3. Количество образца
- •III.2.1. Метод 1: метод динамического потока
- •III.2.2. Метод 2: метод объёмного анализа
- •2.9.27. Однородность массы одной дозы высвобожденной из многодозового контейнера
- •2.9.28. Определение массы или объема содержимого контейнера для жидких и мягких лекарственных средств
- •3.1. Материалы, используемые для производства контейнеров
- •3.1.1. Материалы, используемые для производства контейнеров для человеческой крови и компонентов
- •3.1.1.1. Материалы на основе пластифицированного поливинилхлорида, используемые для производства
- •3.1.1.2. Материалы на основе пластифицированного поливинилхлорида для трубок, используемых в комплектах для переливания крови и компонентов крови
- •3.1.3. Полиолефины
- •3.1.4. Полиэтилен без добавок для контейнеров для парентеральных и офтальмологических лекарственных средств
- •3.1.5. Полиэтилен с добавками для контейнеров для
- •3.1.6. Полипропилен для контейнеров и укупорочных материалов для парентеральных и офтальмологических лекарственных средств
- •3.1.7. Полиэтиленвинилацетат для контейнеров и трубок для лекарственных средств для парентерального питания
- •3.1.8. Силиконовое масло, используемое в качестве смазывающей добавки
- •3.1.9. Силиконовые эластомеры для укупорочных
- •3.1.10. Материалы на основе непластифицированного поливинилхлорида для контейнеров для неинъекционных водных растворов
- •3.1.11. Материалы на основе непластифицированного поливинилхлорида для контейнеров для твердых лекарственных форм для перорального применения
- •3.1.13. Добавки к пластмассе
- •3.1.14. Материалы на основе пластифицированного поливинилхлорида для контейнеров для водных растворов для внутривенного применения
- •3.1.15. Полиэтилентерефталат для контейнеров для лекарственных средств для непарентерального применения
- •3.2. Контейнеры
- •3.2.1. Стеклянные контейнеры для фармацевтического использования
- •3.2.2. Пластмассовые контейнеры и укупорочные средства для фармацевтического использования
- •3.2.2.1. Пластмассовые контейнеры для водных растворов для парентерального применения
- •3.2.3. Стерильные пластмассовые контейнеры для человеческой крови и ее компонентов
- •3.2.4. Пустые стерильные контейнеры из пластифицированного поливинилхлорида для человеческой крови и ее компонентов
- •3.2.5. Стерильные контейнеры из пластифицированного поливинилхлорида для человеческой крови, содержащие раствор антикоагулянта
- •3.2.6. Комплекты для переливания крови и компонентов крови
- •3.2.8. Стерильные одноразовые пластмассовые шприцы
- •3.2.9. Резиновые укупорочные средства для контейнеров, предназначенных для водных лекарственных средств для парентерального применения, порошков и лиофилизированных порошков
- •4. Реактивы
- •4.1. Реактивы, эталонные растворы, буферные растворы
- •4.1.1. Реактивы
- •4.1.2. Эталонные растворы для испытаний на предельное содержание примесей
- •0,1 М фосфатный буферный раствор рН 8,0. 4008400.
- •4.2. Реактивы, титрованные растворы для объемного нализа
- •1 М щелочной раствор меди-этилендиамина. 3008700
- •5.1 Общие тексты по стерилизации
- •5.1.1. Методы приготовления стерильных продуктов
- •5.1.2. Биологические индикаторы стерилизации
- •5.1.3. Эффективность антимикробных консервантов
- •24 Часа
- •5.1.4. Микробиологическая чистота лекарственных средств
- •5.1.5 .Применение f0 концепции при стерилизации паром водных растворов.
- •5.2. Общая информация о вакцинах
- •5.2.1. Общепринятая терминология
- •5.2.2. Стаи кур, не имеющих конкретных патогенов и используемые для производства вакцин и контроля их качества
- •5.2.3. Субстраты клеток для производства вакцин, используемых людьми
- •5.2.6. Оценка безопасности вакцин
- •5.2.7. Оценка эффективности вакцин
- •5.2.8. Снижение риска передачи возбудителей губчатой энцефалопатии через лекарственные средства
- •1. Общие замечания
- •2. Область применения общей главы
- •3.1. Животные как источник материала
- •3.2. Части тел животных, жидкости и выделения в качестве исходных материалов
- •3.3. Проверка процесса
- •5.3. Статистические методы обработки результатов анализа
- •5.3.1. Статистический анализ результатов биологических исследований и количественных определений
- •1.1. Общие положения и точность
- •2. Рандомизация и независимость конкретных исследований
- •3. Количественные определения, основанные на количественных эффектах
- •3.1. Статистические модели
- •3.2. Модель параллельных линий
- •3.2.2.1 Схема полной рандомизации
- •3.2.2.2 Схема рандомизированных блоков
- •3.3. Модель угловых коэффициентов
- •3.3.5.2 (/7С/)-схема
- •4. Тесты с альтернативным типом эффекта 4.1. Введение
- •4.2. Метод пробит-анализа
- •5.1. Модель параллельных линий.
- •5.2. Модель угловых коэффициентов
- •5.3. Альтернативные эффекты
- •6 Объединение результатов количественного определения 6.1. Введение
- •6.2. Взвешенное объединение результатов количественного определения
- •6.3. Невзвешенное объединение результатов количественного опре- деления
- •6.4. Пример определения взешенной средней активности с доверительн1м интервалом
- •7. Дополнение
- •7.1. Общие линейные модели
- •7.4. Ошибки корреляции
- •8. Таблицы и процедуры генерирования
- •8.5. Случайные размещения
- •8.6. Латинские квадраты
- •9. Принятые обозначения
- •1. Выборка
- •1.1. Среднее зна чение и дисперсия
- •1.3. Доверительные интервалы и оценка их величины.
- •1.4. Односторонние и двусторонние доверительные интервалы.
- •2. Метрологические характеристики методики анализа
- •2.1.1. Объединенная дисперсия и объединенное среднее
- •2.1.2. Критерий Бартлетта.
- •2.1.3. Критерий Кохрейна.
- •2.2. Проверка наличия значимой систематической погрешности.
- •3. Сравнение двух методик анализа по воспроизводимости
- •4. Метрологическая характеристика среднего результата.
- •5. Сравнение средних результатов двух выборок
- •5.3. Известно точное значение величины а.
- •6. Интерпретация результатов анализа, полученных с помощью метрологически аттестованной методики.
- •6.1. Оценка сходимости результатов параллельных определений.
- •6.2. Определение необходимого числа параллельных определений.
- •6.3. Гарантия качества продукции.
- •7. Расчет и статистическая оценка параметров линейной зависимости
- •8. Последовательная схема статистического анализа результатов химических измерений
- •9. Примеры
- •9.1 Вычисление среднего значения и дисперсии.
- •9.2 Проверка однородности выборки малого объема
- •9.3. Вычисление доверительных интервалов и неопределенностей измерений.
- •9.4. Проверка гипотезы равенства дисперсий.
- •9.4.1. Объединение результатов выборок разного объема.
- •9.4.2. Объединение результатов выборок одинакового объема.
- •9.5. Сравнение двух методик анализа по воспроизводимости.
- •9.6. Сравнение средних результатов двух выборок.
- •9.7. Оценка качества продукции.
- •9.8. Контроль содержания салициловой кислоты в салициловом спирте посредством секвенционального анализа.
- •10. Расчет неопределенности функции нескольких случайных переменных
- •10.1. Линейная модель
- •10.1.1. Взвешенное среднее
- •10.2. Подход Уэлча-Сатертуэйта
- •10.3. Примеры расчетов неопределенности функции нескольких переменных
- •10.3.1. Расчет неопределенности вэжх-анализа готового лекарственного средства
- •10.3.1.1. Конечная аналитическая операция
- •10.3.1.2. Суммарная неопределенность пробоподготовки asp,r.
- •10.3.1.3. Расчет суммарной неопределенности анализа aAs,r
- •10.3.2. Прогноз неопределенности спектрофотометрического анализа готового лекарственного средства
- •10.3.3. Расчет среднего значения нескольких неравноточных выборок
- •1. Введение
- •2. Аналитические испытания и методики, подлежащие валидации
- •3. Валидационные характеристики и требования
- •4. Словарь
- •2. Специфичность
- •5. Правильность
- •5.1. Количественное определение
- •5.2. Примеси (количественное содержание).
- •7. Предел обнаружения
- •8. Предел количественного определения
- •8.3. Использование калибровочной прямой и стандартного отклонения сигнала
- •9. Робастность
- •10. Проверка пригодности хроматографической системы
- •3. Неинструментальные испытания на чистоту и предельное содержание примесей
- •5. Разделительные методы
- •6.1. Метод добавок
- •6.2. Сравнение с арбитражным методом
- •5.4. Остаточные количества органических растворителей
- •5.4.1. Введение
- •5.4.2. Область применения
- •5.4.3. Общие положения
- •5.4.4. Предельные содержания остаточных растворителей
- •5.5. Алкоголеметрические таблицы
- •5.6. Отчет об исследовании интерферонов
- •3.3. Процедура исследования
- •3.3.1. Определение уровня доза-ответ
- •5.7. Таблица физических упоминаемых в фармакопеи
- •Вероятность эмиссии
- •Энергия (мЭв)
- •Энергия (мЭв)
- •Вероят ность эмиссии (на
- •Энергия (мЭв)
- •Вероятность эмиссии
- •5.8. Биодоступность и биоэквивалентность генерических лекарственных средств
- •3. Регистрационная оценка взаимозаменяемых лекарственных
- •4. Исследования эквивалентности, необходимые для
- •4.2.1. Исследования биоэквивалентности/биодоступности (исследования на человеке)
- •4.2.2. Общие методические подходы к выполнению исследований биоэк- вивалентности/биодоступности
- •4.2.3. Исследования сравнительной кинетики растворения (исследования вне живого организма)
- •4.3. Отсутствие необходимости в исследованиях биоэквивалентности или биодоступности
- •5. Дизайн и проведение исследований биологической эквивалентности и биодоступности на людях 5.1. Общие требования.
- •5.2. Испытуемые
- •6. Регламент фармакокинетического исследования
- •7. Аналитический метод
- •8. Анализ фармакокинетических данных
- •8.1. Параметры, подлежащие оценке
- •8.1.1. Однократное введение лекарственного средства
- •8.1.2. Многократное введение лекарственного средства
- •9. Исключение резко выделяющихся наблюдений
- •12. Фармакодинамические исследования
- •13. Клинические испытания
- •14. Тест сравнительной кинетики растворения in vitro
- •15. Клинически значимые колебания биодоступности, обуславливающие отказ в регистрации лекарственного средства
- •Лабораторных животных
- •Участие в испытаниях биоэквивалентности/биодоступности
- •Номограмма для определения достаточного числа добровольцев по результатам проведенного исследования.
- •Хорошо растворимые лекарственные средства
- •Средства с высокой степенью абсорбции
- •Перечень терапевтических (лечебных) доз средств на основе лекарственного растительного сырья
- •Основная литература
- •6. Общие статьи на лекарственные формы и субстанции
2.6.18. Испытание живых вирусных вакцин на нейровирулентность
В каждом испытании используют не менее десяти серонегативных по отношению к испытуемому вирусу обезьян. Каждой из обезьян в таламический отдел каждого полушария вводят не менее 0,5 мл испытуемого материала, если иное не предписано в частной статье. Общее количество привитого каждой обезьяне вируса не должно быть менее количества, содержащегося в рекомендованной единичной человеческой дозе вакцины. Для проверки наличия диких нейровирулент-ных вирусов контрольную группу, состоящую не менее чем из четырех обезьян, содержат в тех же клетках, что и группу привитых обезьян, или в непосредственной близости от них. Привитых обезьян наблюдают в течение 17-21 дней, отмечая возникновение паралича и других неврологических симптомов; обезьян из контрольной группы наблюдают в течение того же периода и дополнительно 10 дней. Животные, погибшие в течение первых 48 часов после инъекции, считаются погибшими по причинам неспецифического характера и могут быть заменены другими. Результаты испытания признают недостоверными, если: более 20% привитых обезьян погибают по неспецифическим причинам; образцы сыворотки, отобранные у обезьян контрольной группы, в момент прививки испытуемых животных и через 10 дней после умерщвления последних, имеют признаки инфекции, вызванной диким вирусом испытуемого типа или вирусом кори. По окончании периода наблюдения выполняют вскрытие и гистопатологическое изучение соответствующих отделов мозга на предмет наличия воздействия на центральную нервную систему. Материал выдерживает испытание, если не обнаруживается неожиданных клинических и гистопатологических признаков воздействия на центральную нервную систему, которые могут быть вызваны введенным вирусом.
2.6.19. Испытание пероральной вакцины полиомиелита на нейровирулентность
Обезьяны, используемые в испытании на нейровирулентность, должны соответствовать требованиям, приведенным в частной статье «Вакцина полиомиелита, пероральная (0215)» и иметь массу тела не менее 1,5 кг. Патогенность для обезьян семейств Macaca или Cercopithecus испытывается в сравнении с патоген-ностью стандартного вирусного препарата для испытания на нейровирулентность путем введения в поясничный отдел центральной нервной системы после седа-ции с использование подходящего агента, например, гидрохлорида кетамина. Для образца сыворотки, отобранного до инъекции, должно быть показано отсутствие нейтрализующих антител в разведении 1:4 при испытании против не более, чем 1000 CCID50 каждого из трех типов полиовируса.
Количество обезьян. Вакцину и подходящий гомотипический вирус сравнения испытывают одновременно в одной и той же группе обезьян. Вакцину и препарат сравнения вводят равному количеству животных. Животных с различающимися типами введенного препарата размещают случайным образом по клеткам, а их принадлежность кодируется таким образом, чтобы тип полученной ими прививки был скрыт от наблюдателей. Количество привитых обезьян должно быть таково, чтобы при оценке как вакцины, так и препарата сравнения было включено не менее одиннадцати обезьян, положительных по отношению к вирусу типов 1 и 2, и не менее восемнадцати обезьян, положительных по отношению к вирусу типа 3 (положительными считают обезьян, имеющих специфические нейронные повреждения, вызванные полиовирусом в центральной нервной системе). С одним и тем же гомотипическим стандартом могут испытываться несколько партий вакцины. По возможности, используют обезьян из одной и той же карантинной группы. В других случаях используют обезьян из двух групп, причем вакцина и препарат сравнения прививаются равному количеству обезьян из каждой группы. Если испытание проводится в течение двух рабочих дней, в каждый из дней вакциной и гомотипическим препаратом сравнения прививают равное количество обезьян.
Содержание вируса. Содержание вируса в вакцине и гомотипическом препарате сравнения регулируют таким образом, чтобы они были насколько возможно близки и находились в пределах от 1055 до 1065 CCID50 в 0,1 миллилитре.
Наблюдение. Всех обезьян наблюдают в течение 17-22 дней, отмечая признаки полиомиелита или других вирусных инфекций. Обезьян, выживших в течение первых 24 часов, но погибших до 11-го дня после прививки, подвергают вскрытию для определения того, являлся ли причиной гибели полиомиелит. Животные, погибшие по причинам, не связанным с полиомиелитом, не учитываются при оценке результатов. Умирающих и в тяжелой степени парализованных животных умерщвляют и вскрывают. Также вскрывают всех животных, выживших в течение периода наблюдения. Результаты испытания считают недостоверными, если более, чем у 20% животных в течение периода наблюдения была обнаружена интеркуррентная инфекция.
Количество срезов, подлежащих испытанию. Гистологическому исследованию подлежат, как минимум, поясничный и шейный отделы, верхний и нижний продолговатый мозг, средний мозг, зрительный бугор и двигательная область коры головного мозга каждой обезьяны. Отбирают препараты толщиной 15 мкм и окрашивают их галлоцианином. Минимальные количества подлежащих испытанию срезов составляют:
12 срезов, репрезентативных для поясничного утолщения,
10 срезов, репрезентативных для шейного утолщения,
2 среза продолговатого мозга,
1 срез моста и мозжечка,
1 срез среднего мозга,
1 срез с левой и правой части зрительного бугра,
1 срез с левой и правой части двигательной области коры головного мозга.
Подсчет вирусной активности. Для оценки вирусной активности в полусекциях поясничного корда и ствола мозга используют систему подсчета тяжести повреждений, по которой следующим образом дифференцируют клеточную инфильтрацию и разрушение нейронов:
Наличие лишь клеточной инфильтрации (обезьяна не считается положительной),
Клеточная инфильтрация с минимальным повреждением нейронов,
Клеточная инфильтрация со значительным повреждением нейронов,
Массовое повреждение нейронов в сочетании или без клеточной инфильтрации.
Полученные значения записывают на стандартном бланке (пример подходящей формы имеется в разделе «Требования к вакцине полиомиелита (перо-ральной)» в Требованиях к биологическим субстанциям №7 Всемирной организации здравоохранения). Обезьяна, на срезах тканей которой имеются поврежденные нейроны, но не имеется игольчатых трактов, считается положительной. Обезьяна, на срезах тканей которой имеются игольчатые тракты, но не имеется поврежденных нейронов, не считается положительной. Срезы, на которых имеются повреждения травматического происхождения, но не имеется специфических вирусных повреждений, при подсчете не учитываются.
Уровни тяжести повреждений основаны на данных, полученных при изучении полусекций поясничных (L), шейных (C) и мозговых (B) гистологических срезов. Для каждой положительной обезьяны рассчитывают уровень повреждений (LS) по формуле
LS
Суммарное число L Число полусекций
+
Суммарное число С Число полусекций
+
Суммарное число С Число полусекций
3:
Для каждой группы положительных обезьян рассчитывают среднее значение уровня повреждений.
Оценка. Сравнение вирусной активности в вакцине и в препарате сравнения основано на активности в поясничном расширении корда и степени распространения активности из этого региона в шейное расширение и головной мозг. Положительное или отрицательное решение основано на общем уровне для всех животных, подвергнутых испытанию. Необычно высокая активность как в поясничном отделе, так и в результате распространения из этого региона, обнаруженная у отдельных животных, также должна приниматься во внимание при вынесении окончательного решения. Моновалентный материал выдерживает испытание, если имеется требуемое количество положительных животных и если ни в одном из клинических и гистопатологических исследований не выявлено существенных различий в патогенности между вирусом вакцины и препаратом сравнения. Критерии положительного решения приведены ниже.
Критерии. Для каждой из вакцин сравнения (типов 1, 2 и 3) проводят подходящее количество (например, четыре) квалификационных испытаний на вирулентность с целью получения данных об активности этих вакцин как основы критериев для оценки испытуемых вакцин. Для повторных испытаний каждого из стандартных вирусов вычисляют общий средний уровень повреждений (М), а также суммарную оценку дисперсии (s2) и отклонения (s) результатов испытания.
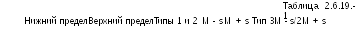 Критерии
достоверности результатов испытания
препарата сравнения устанавливаются
на основе данных, накопленных в
квалификационных испытаниях. Общепринятых
критериев не имеется; для лабораторий
с ограниченным опытом работы может
быть полезен следующий эмпирический
метод установления допустимых
пределов среднего уровня повреждений
для препарата сравнения
(Xref):
Критерии
достоверности результатов испытания
препарата сравнения устанавливаются
на основе данных, накопленных в
квалификационных испытаниях. Общепринятых
критериев не имеется; для лабораторий
с ограниченным опытом работы может
быть полезен следующий эмпирический
метод установления допустимых
пределов среднего уровня повреждений
для препарата сравнения
(Xref):
Если средний уровень повреждений испытуемой вакцины равен Xtest, а C1, C2 и C3 - константы, определенные ниже, то:
Вакцина не выдерживает испытание при:
Вакцина может быть однократно подвергнута повторному испытанию при:
Если вакцина испытывается повторно, средние значения уровней повреждений для испытуемой вакциной и препаратом сравнения рассчитываются заново. Вакцина не выдерживает испытание при:
X - X
л (testl+test2) л (ref 1+ref 2) > ^
2 > 3
Константы C1, C2 и C3 вычисляют по формулам:
2s^
C 2 = 2,6^
2s^
где :
N -
N2 -
2,3 -
2.6 - 1.6
C
2s^
N
2
количество положительных обезьян при испытании вакцины, количество положительных обезьян в двух испытаниях, нормальное отклонение для 1% уровня, нормальное отклонение для 0,5% уровня, нормальное отклонение для 5% уровня.
Испытание на нейровирулентность, в котором получен средний уровень повреждений препарата сравнения (X-ef), несовместимый с предшествующим опытом, не используется для оценки испытуемой вакцины. Если результаты испытания достоверны, вычисляют средний уровень повреждений для испытуемой вакцины (Xtest) и сравнивают его с соответствующим значением для гомотипической стандартной вакцины.
АНТИ-А И АНТИ-В ГЕМАГГЛЮТИНИНЫ (НЕПРЯМОЙ МЕТОД)
Готовят два серийных разведения испытуемого препарата в растворе натрия хлорида R концентрацией 9 г/л. К каждому разведению одного ряда добавляют равный объем суспензии эритроцитов группы А1 концентрацией 5 объемных процентов, предварительно трижды промытых раствором натрия хлорида. К каждому разведению другого ряда добавляют равный объем суспензии эритроцитов группы В концентрацией 5 объемных процентов, предварительно трижды промытых раствором натрия хлорида. Суспензии инкубируют при температуре 370С в течение 30 минут, затем клетки трижды промывают раствором натрия хлорида. Клетки оставляют в контакте с поливалентным антиреагентом человеческого иммуноглобулина в течение 30 минут. Каждую из суспензий, не подвергая центрифу-гировангию, исследуют под микроскопом на агглютинацию.
МЕТОДЫ АМПЛИФИКАЦИИ НУКЛЕИНОВЫХ КИСЛОТ
1. ВВЕДЕНИЕ
Методы амплификации нуклеиновых кислот основаны на двух различных подходах:
Амплификация последовательности-мишени нуклеиновой кислоты с использованием, например, полимеразной цепной реакции (ПЦР), лигазной цепной реакции (ЛЦР) или изотермической амплификации рибонуклеиновой кислоты
(РНК).
Амплификация сигнала гибридизации с использованием, например, для дезоксирибонуклеиновой кислоты (ДНК) метода разветвленной ДНК (bDNA). В этом случае амплификация сигнала достигается без подвергания нуклеиновой кислоты повторяющимся циклам амплификации.
В данном общем разделе в качестве стандартного метода описывается метод ПЦР. Могут применяться и альтернативные методы, если они выдерживают требования к качеству, перечисленные ниже.
ОБЛАСТЬ ПРИМЕНЕНИЯ
В данном разделе устанавливаются требования к подготовке образца, к амплификации in vitro последовательностей ДНК и к детектированию специфического продукта ПЦР. С помощью ПЦР могут быть детектированы определенные последовательности ДНК. Последовательности РНК могут также быть детектированы путем обратной транскрипции РНК на комплементарную ДНК (cDNA) с последующей амплификацией.
ПРИНЦИП МЕТОДА
ПЦР представляет собой процедуру, позволяющую производить в условиях in vitro амплификацию сегментов ДНК или РНК (после обратной транскрипции на
cDNA).
После денатурации двунитевой ДНК в однонитевую два синтетических оли-гонуклеотидных праймера противоположной полярности спариваются с их соответствующими комплементарными последовательностями в подлежащей амплификации ДНК. Короткие двунитевые участки, формирующиеся в результате специфического спаривания оснований праймеров и комплементарной ДНК-последовательности, образуют границы амплифицируемого сегмента ДНК и служат начальными точками для синтеза ДНК in vitro с участием термостабильной ДНК-полимеразы.
Процесс амплификация ДНК состоит из циклов, включающих:
тепловую денатурацию нуклеиновой кислоты (последовательности-мишени) на две отдельные нити;
специфический отжиг последовательности-мишени с праймерами в подходящих реакционных условиях;
наращивание праймеров, присоединенных к обеим отдельным нитям, под воздействием ДНК-полимеразы при подходящей температуре (синтез ДНК).
Повторяющиеся циклы тепловой денатцурации, отжига с праймерами и синтеза ДНК приводят к экспоненциальной амплификации сегмента ДНК, ограниченного праймерами.
Специфический продукт ПЦР, называемый ампликоном, может быть определен разнообразными методами соответствующей специфичности и чувствительности.
ИСПЫТУЕМЫЙ МАТЕРИАЛ
В связи с высокой чувствительностью ПЦР, образцы должны быть оптимальным образом защищены от попадания извне последовательностей-мишеней. Отбор проб, хранение и транспортировку испытуемого материала производят в условиях, минимизирующих деградацию последовательности-мишени. В случае проведения испытания на РНК-последовательности, необходимо принять особые меры предосторожности ввиду высокой чувствительности РНК к деструктивному воздействию рибонуклеаз. Следует учитывать, что некоторые добавляемые реагенты, например, антикоагулянты или консерванты, могут оказывать влияние на ход определения.
МЕТОДИКА ОПРЕДЕЛЕНИЯ
