
- •Государственная фармакопея республики беларусь первое издание
- •Республики Беларусь
- •1. Общие сведения
- •1.1. Общие положения
- •1.2. Другие положения, распространяющиеся на общие и частные фармакопейные статьи
- •Условия хранения лекарственного средства
- •Пределы, указываемые на упаковке
- •1.5. Сокращения и обозначения
- •1.6. Единицы международной системы (си), используемые в фармакопейных статьях, и их соответствие другим единицам
- •2. Методы анализа
- •2.1. Оборудование
- •2.1.1. Каплемер
- •2.1.2. Сравнительная таблица пористости стеклянных фильтров
- •Пористость фильтра (ф.Евр.) (1)
- •Максимальный диаметр пор в микрометрах
- •2.1.3. Лампы с ультрафиолетовым излучением для аналитических целей
- •2.1.4. Сита
- •2.2. Физические и физико-химические методы
- •2.2.1. Определение прозрачности и степени мутности жидкостей
- •2.2.2. Определение степени окрашивания жидкостей
- •2.2.3. Потенциометрическое определение рН
- •2.2.4. Зависимость между реакцией раствора, приблизительным значением рН и цветом индикаторов
- •Изменение цвета
- •2.2.5. Относительная плотность
- •2.2.6. Показатель преломления (индекс рефракции)
- •2.2.7. Оптическое вращение
- •2.2.8. Вязкость
- •1/Прив 1
- •2.2.9. Метод капиллярной вискозиметрии
- •2.2.10. Метод ротационной вискозиметрии
- •2.2.11. Температурные пределы перегонки
- •2.2.14. Температура плавления - капиллярный метод
- •2.2.17. Температура каплепадения
- •2.2.18. Температура затвердевания
- •2.2.21. Флуориметрия
- •2.2.22. Атомно-эмиссионная спектрометрия
- •2.2.23. Атомно-абсорбционная спектрометрия
- •2.2.24. Абсорбционная спектрофотометрия в инфракрасной
- •2.2.25. Абсорбционная спектрофотометрия в ультрафиолетовой видимой областях
- •2. Многокомпонентный спектрофотометрический анализ.
- •2.2.26. Бумажная хроматография
- •2.2.27. Тонкослойная хроматография
- •2.2.28. Газовая хроматография
- •2.2.29. Жидкостная хроматография
- •2.2.30. Эксклюзионная хроматография
- •2.2.31. Электрофорез
- •2.2.32. Потеря в массе при высушивании
- •2.2.33. Спектрометрия ядерного магнитного резонанса
- •2.2.34. Термогравиметрия
- •2.2.35. Осмоляльность
- •2.2.36. Потенциометрическое определение концентрации ионов с использованием ионселективных электродов
- •2.2.37. Рентгенофлуоресцентная спектрометрия
- •2.2.38. Удельная электропроводность
- •2.2.39. Молекулярно-массовое распределение декстранов
- •2.2.40. Спектрофотометрия ближнего ик-диапазона
- •2.2.41. Круговой дихроизм
- •2.2.42. Плотность твердых тел
- •2.2.43. Масс-спектрометрия
- •2.2.44. Определение содержания общего органического углерода в воде для фармацевтического применения
- •2.2.45. Сверхкритическая флюидная хроматография
- •2.2.46. Хроматографические методы разделения
- •2.2.47. Капиллярный электрофорез
- •2.2.48. Рамановская спектрометрия (# спектрометрия комбинационного рассеяния)
- •2.2.54. Изоэлектрическое фокусирование
- •2.3.1. Реакции подлинности (идентификации) на ионы и функциональные группы
- •2.3.2. Идентификация жирных масел методом тонкослойной хроматографии
- •2.3.3. Идентификация фенотиазинов методом тонкослойной хроматографии
- •2.3.4. Определение запаха
- •2.4. Испытания на предельное содержание примесей
- •2.4.1. Аммония соли
- •2.4.2. Мышьяк
- •2.4.3. Кальций
- •2.4.6. Магний
- •2.4.7. Магний и щелочноземельные металлы
- •2.4.8. Тяжелые металлы
- •2.4.15. Никель в полиолах
- •2.4.1.6. Общая зола
- •2.4.21. Посторонние масла в жирных маслах методом тонкослойной хроматографии
- •2.4.22. Посторонние жирные кислоты в маслах методом газовой хроматографии
- •2.4.23. Стерины в жирных маслах
- •2.4.24. Идентификация остаточных растворителей и их количественное определение
- •2.4.25. Остаточные количества этиленоксида и диоксана
- •2.4.27. Никель в гидрогенизированных растительных маслах
- •2.5. Методы количественного определения 2.5.1. Кислотное число
- •2.5.3. Гидроксильное число
- •2.5.4. Йодное число
- •2.5.5. Перекисное (пероксидное) число
- •2.5.6. Число омыления
- •2.5.7. Неомыляемые вещества
- •2.5.8. Определение аминного азота в соединениях, которые содержат первичную ароматическую аминогруппу
- •2.5.9. Определение азота после минерализации серной кислотой
- •2.5.10. Метод сжигания в колбе с кислородом
- •2.5.11. Комплексометрическое титрование
- •2.5.12. Вода: полумикрометод (#Метод к.Фишера)
- •2.5.13. Алюминий в адсорбированных вакцинах
- •2.5.14. Кальций в адсорбированных вакцинах
- •2.5.20. Гексозамины в полисахаридных вакцинах
- •2.5.21. Метилпентозы в полисахаридных вакцинах
- •2.5.24. Диоксид углерода в газах
- •2.5.25. Оксид углерода в газах
- •2.5.26. Оксид азота и диоксид азота в газах
- •2.5.27. Кислород в газах
- •2.5.30. Окисляющие вещества
- •2.5.33. Общий белок
- •2.5.34. Уксусная кислота в синтетических пептидах
- •2.6. Биологические испытания
- •2.6.1. Стерильность
- •2.6.2. Микобактерии
- •2.6.3. Испытания на посторонние вирусы с использованием куриных эмбрионов
- •2.6.4. Испытание на вирусы лейкоза
- •2.6.5. Испытание на посторонние вирусы с использованием клеточных культур
- •2.6.6. Испытание на посторонние агенты с использованием цыплят.
- •2.6.7. Микоплазмы
- •2.6.8 Пирогенность
- •2.6.9. Аномальная токсичность
- •2.6.10. Гистамин
- •2.6.11. Депрессорные вещества
- •2.6.12. Микробиологические испытания нестерильной продукции (суммарное количество жизнеспособных аэробов)
- •2.6.13. Микробилогические испытания нестерильной продукции (испытания на наличие специфических микроорганизмов)
- •0,9 % Раствор натрия хлорида
- •1 % Раствор фенолового красного
- •0,5 % Раствор малахитового зеленого
- •2.6.14. Бактериальные эндотоксины
- •1. Предварительные испытания
- •2. Предельное испытание (метод а) (I) Методика
- •2. Полуколичественное испытание (метод в)
- •1. Турбидиметрический принцип (методы с и f)
- •2.6.15. Активатор прекалликреина
- •2.6.16. Испытания на посторонние агенты в вирусных вакцинах для медицинского применения
- •2.6.17. Испытание на антикомплементарную активность иммуноглобулина
- •2.6.18. Испытание живых вирусных вакцин на нейровирулентность
- •2.6.19. Испытание пероральной вакцины полиомиелита на нейровирулентность
- •5.1. Предотвращение загрязнения
- •5.4 Детектирование
- •7.1 Валидация системы для количественного определения методом
- •7.2. Контроль качества реагентов.
- •7.3. Контроль хода испытания.
- •7.4. Внешняя оценка качества
- •2.6.22. Активированные факторы свертывания крови
- •2.7 Биологические методы количественного определения
- •2.7.1. Иммунохимические методы
- •2.7.2. Количественное определение антибиотиков микробиологическим методом
- •2.7.3. Количественное определение кортикотропина
- •2.7.4. Количественное определение фактора свертывания крови VIII
- •2.7.5. Количественное определение гепарина
- •2.7.6. Количественное определение вакцины дифтерии (адсорбированной)
- •2.7.7. Количественное определение вакцины коклюша
- •2.7.8. Количественное определение вакцины столбняка (адсорбированной)
- •2.7.9. Определение функционального состояния Fc-фрагмента иммуноглобулина
- •2.7.10. Количественное определение фактора свертывания крови человека VII
- •2.7.11. Количественное определение фактора свертывания крови человека IX
- •2.7.12. Количественное определение гепарина в концентратах
- •2.7.13. Количественное определение человеческого анти-d-иммуноглобулина
- •2.7.14. Количественное определение антигенной (иммуногенной) активности вакцины гепатита а
- •2.7.15. Количественное определение вакцины гепатита в (rdna)
- •2.7.16. Количественное определение вакцины коклюша (бесклеточной)
- •2.7.17. Количественное определение антитромбина III человека
- •2.7.18. Количественное определение фактора свертывания крови II
- •2.7.19. Количественное определение фактора свертывания крови х
- •2.7.20. Количественное определение инактивированной вакцины полиомиелита in vivo
- •2.7.22. Количественное определение фактора свертывания крови человека XI
- •2.8. Методы анализа лекарственного растительного сырья и лекарственных средств из него
- •2.8.1. Зола, нерастворимая в хлористоводородной кислоте
- •2.8.4. Коэффициент набухания
- •2.8.5. Определение воды в эфирных маслах
- •2.8.10. Растворимость эфирных масел в спирте
- •2.8.11. Определение 1,8-цинеола в эфирных маслах
- •2.8.12. Определение эфирного масла
- •2.8.13. Остаточное количество пестицидов
- •1. Экстракция
- •2. Очистка
- •3. Количественный анализ
- •Относительные времена удерживания инсектицидов
- •2.8.15. Определение показателя горечи
- •2.8.16. Сухой остаток экстрактов
- •2.8.17. Потеря в массе при высушивании экстракта
- •2.9. Фармацевтико-технологические испытания
- •2.9.1. Распадаемость таблеток и капсул
- •2.9.2. Распадаемость суппозиториев и пессариев
- •2.9.3. Тест «растворение» для твердых дозированных форм
- •2.9.4. Тест «растворение» для трансдермальных пластырей
- •2.9.5. Однородность массы для единицы дозированного лекарственного средства
- •2.9.6. Однородность содержания действующего вещества в
- •2.9.7. Прочность таблеток без оболочки на истирание
- •2.9.8. Прочность таблеток на сжатие
- •2.9.9. Измерение консистенции методом пенетрометрии
- •2.9.10 Содержание этанола
- •2.9.11. Испытание на содержание метанола и 2-пропанола
- •2.9.12. Ситовой анализ
- •2.9.15. Насыпной объем
- •2.9.16. Сыпучесть
- •2.9.17. Определение извлекаемого объема парентеральных лекарственных средств
- •Масса действующего вещества высвобожденного при опорожнении
- •Фракция действующего вещества (%)
- •2.9.19. Загрязнение механическими включениями: невидимые частицы.
- •2.9.20. Загрязнение механическими включениями: видимые частицы
- •2.9.21. Загрязнение механическими включениями: метод микроскопии
- •2.9.22. Опредление времени деформации липофильных суппозиториев
- •2.9.23. Определение плотности твердых частиц при помощи пикнометра
- •2.9.24. Устойчивость суппозиториев и пессариев к разрушению
- •2.9.26. Опредедение удельной площади поверхности методом газовой адсорбции
- •III.1.3. Количество образца
- •III.2.1. Метод 1: метод динамического потока
- •III.2.2. Метод 2: метод объёмного анализа
- •2.9.27. Однородность массы одной дозы высвобожденной из многодозового контейнера
- •2.9.28. Определение массы или объема содержимого контейнера для жидких и мягких лекарственных средств
- •3.1. Материалы, используемые для производства контейнеров
- •3.1.1. Материалы, используемые для производства контейнеров для человеческой крови и компонентов
- •3.1.1.1. Материалы на основе пластифицированного поливинилхлорида, используемые для производства
- •3.1.1.2. Материалы на основе пластифицированного поливинилхлорида для трубок, используемых в комплектах для переливания крови и компонентов крови
- •3.1.3. Полиолефины
- •3.1.4. Полиэтилен без добавок для контейнеров для парентеральных и офтальмологических лекарственных средств
- •3.1.5. Полиэтилен с добавками для контейнеров для
- •3.1.6. Полипропилен для контейнеров и укупорочных материалов для парентеральных и офтальмологических лекарственных средств
- •3.1.7. Полиэтиленвинилацетат для контейнеров и трубок для лекарственных средств для парентерального питания
- •3.1.8. Силиконовое масло, используемое в качестве смазывающей добавки
- •3.1.9. Силиконовые эластомеры для укупорочных
- •3.1.10. Материалы на основе непластифицированного поливинилхлорида для контейнеров для неинъекционных водных растворов
- •3.1.11. Материалы на основе непластифицированного поливинилхлорида для контейнеров для твердых лекарственных форм для перорального применения
- •3.1.13. Добавки к пластмассе
- •3.1.14. Материалы на основе пластифицированного поливинилхлорида для контейнеров для водных растворов для внутривенного применения
- •3.1.15. Полиэтилентерефталат для контейнеров для лекарственных средств для непарентерального применения
- •3.2. Контейнеры
- •3.2.1. Стеклянные контейнеры для фармацевтического использования
- •3.2.2. Пластмассовые контейнеры и укупорочные средства для фармацевтического использования
- •3.2.2.1. Пластмассовые контейнеры для водных растворов для парентерального применения
- •3.2.3. Стерильные пластмассовые контейнеры для человеческой крови и ее компонентов
- •3.2.4. Пустые стерильные контейнеры из пластифицированного поливинилхлорида для человеческой крови и ее компонентов
- •3.2.5. Стерильные контейнеры из пластифицированного поливинилхлорида для человеческой крови, содержащие раствор антикоагулянта
- •3.2.6. Комплекты для переливания крови и компонентов крови
- •3.2.8. Стерильные одноразовые пластмассовые шприцы
- •3.2.9. Резиновые укупорочные средства для контейнеров, предназначенных для водных лекарственных средств для парентерального применения, порошков и лиофилизированных порошков
- •4. Реактивы
- •4.1. Реактивы, эталонные растворы, буферные растворы
- •4.1.1. Реактивы
- •4.1.2. Эталонные растворы для испытаний на предельное содержание примесей
- •0,1 М фосфатный буферный раствор рН 8,0. 4008400.
- •4.2. Реактивы, титрованные растворы для объемного нализа
- •1 М щелочной раствор меди-этилендиамина. 3008700
- •5.1 Общие тексты по стерилизации
- •5.1.1. Методы приготовления стерильных продуктов
- •5.1.2. Биологические индикаторы стерилизации
- •5.1.3. Эффективность антимикробных консервантов
- •24 Часа
- •5.1.4. Микробиологическая чистота лекарственных средств
- •5.1.5 .Применение f0 концепции при стерилизации паром водных растворов.
- •5.2. Общая информация о вакцинах
- •5.2.1. Общепринятая терминология
- •5.2.2. Стаи кур, не имеющих конкретных патогенов и используемые для производства вакцин и контроля их качества
- •5.2.3. Субстраты клеток для производства вакцин, используемых людьми
- •5.2.6. Оценка безопасности вакцин
- •5.2.7. Оценка эффективности вакцин
- •5.2.8. Снижение риска передачи возбудителей губчатой энцефалопатии через лекарственные средства
- •1. Общие замечания
- •2. Область применения общей главы
- •3.1. Животные как источник материала
- •3.2. Части тел животных, жидкости и выделения в качестве исходных материалов
- •3.3. Проверка процесса
- •5.3. Статистические методы обработки результатов анализа
- •5.3.1. Статистический анализ результатов биологических исследований и количественных определений
- •1.1. Общие положения и точность
- •2. Рандомизация и независимость конкретных исследований
- •3. Количественные определения, основанные на количественных эффектах
- •3.1. Статистические модели
- •3.2. Модель параллельных линий
- •3.2.2.1 Схема полной рандомизации
- •3.2.2.2 Схема рандомизированных блоков
- •3.3. Модель угловых коэффициентов
- •3.3.5.2 (/7С/)-схема
- •4. Тесты с альтернативным типом эффекта 4.1. Введение
- •4.2. Метод пробит-анализа
- •5.1. Модель параллельных линий.
- •5.2. Модель угловых коэффициентов
- •5.3. Альтернативные эффекты
- •6 Объединение результатов количественного определения 6.1. Введение
- •6.2. Взвешенное объединение результатов количественного определения
- •6.3. Невзвешенное объединение результатов количественного опре- деления
- •6.4. Пример определения взешенной средней активности с доверительн1м интервалом
- •7. Дополнение
- •7.1. Общие линейные модели
- •7.4. Ошибки корреляции
- •8. Таблицы и процедуры генерирования
- •8.5. Случайные размещения
- •8.6. Латинские квадраты
- •9. Принятые обозначения
- •1. Выборка
- •1.1. Среднее зна чение и дисперсия
- •1.3. Доверительные интервалы и оценка их величины.
- •1.4. Односторонние и двусторонние доверительные интервалы.
- •2. Метрологические характеристики методики анализа
- •2.1.1. Объединенная дисперсия и объединенное среднее
- •2.1.2. Критерий Бартлетта.
- •2.1.3. Критерий Кохрейна.
- •2.2. Проверка наличия значимой систематической погрешности.
- •3. Сравнение двух методик анализа по воспроизводимости
- •4. Метрологическая характеристика среднего результата.
- •5. Сравнение средних результатов двух выборок
- •5.3. Известно точное значение величины а.
- •6. Интерпретация результатов анализа, полученных с помощью метрологически аттестованной методики.
- •6.1. Оценка сходимости результатов параллельных определений.
- •6.2. Определение необходимого числа параллельных определений.
- •6.3. Гарантия качества продукции.
- •7. Расчет и статистическая оценка параметров линейной зависимости
- •8. Последовательная схема статистического анализа результатов химических измерений
- •9. Примеры
- •9.1 Вычисление среднего значения и дисперсии.
- •9.2 Проверка однородности выборки малого объема
- •9.3. Вычисление доверительных интервалов и неопределенностей измерений.
- •9.4. Проверка гипотезы равенства дисперсий.
- •9.4.1. Объединение результатов выборок разного объема.
- •9.4.2. Объединение результатов выборок одинакового объема.
- •9.5. Сравнение двух методик анализа по воспроизводимости.
- •9.6. Сравнение средних результатов двух выборок.
- •9.7. Оценка качества продукции.
- •9.8. Контроль содержания салициловой кислоты в салициловом спирте посредством секвенционального анализа.
- •10. Расчет неопределенности функции нескольких случайных переменных
- •10.1. Линейная модель
- •10.1.1. Взвешенное среднее
- •10.2. Подход Уэлча-Сатертуэйта
- •10.3. Примеры расчетов неопределенности функции нескольких переменных
- •10.3.1. Расчет неопределенности вэжх-анализа готового лекарственного средства
- •10.3.1.1. Конечная аналитическая операция
- •10.3.1.2. Суммарная неопределенность пробоподготовки asp,r.
- •10.3.1.3. Расчет суммарной неопределенности анализа aAs,r
- •10.3.2. Прогноз неопределенности спектрофотометрического анализа готового лекарственного средства
- •10.3.3. Расчет среднего значения нескольких неравноточных выборок
- •1. Введение
- •2. Аналитические испытания и методики, подлежащие валидации
- •3. Валидационные характеристики и требования
- •4. Словарь
- •2. Специфичность
- •5. Правильность
- •5.1. Количественное определение
- •5.2. Примеси (количественное содержание).
- •7. Предел обнаружения
- •8. Предел количественного определения
- •8.3. Использование калибровочной прямой и стандартного отклонения сигнала
- •9. Робастность
- •10. Проверка пригодности хроматографической системы
- •3. Неинструментальные испытания на чистоту и предельное содержание примесей
- •5. Разделительные методы
- •6.1. Метод добавок
- •6.2. Сравнение с арбитражным методом
- •5.4. Остаточные количества органических растворителей
- •5.4.1. Введение
- •5.4.2. Область применения
- •5.4.3. Общие положения
- •5.4.4. Предельные содержания остаточных растворителей
- •5.5. Алкоголеметрические таблицы
- •5.6. Отчет об исследовании интерферонов
- •3.3. Процедура исследования
- •3.3.1. Определение уровня доза-ответ
- •5.7. Таблица физических упоминаемых в фармакопеи
- •Вероятность эмиссии
- •Энергия (мЭв)
- •Энергия (мЭв)
- •Вероят ность эмиссии (на
- •Энергия (мЭв)
- •Вероятность эмиссии
- •5.8. Биодоступность и биоэквивалентность генерических лекарственных средств
- •3. Регистрационная оценка взаимозаменяемых лекарственных
- •4. Исследования эквивалентности, необходимые для
- •4.2.1. Исследования биоэквивалентности/биодоступности (исследования на человеке)
- •4.2.2. Общие методические подходы к выполнению исследований биоэк- вивалентности/биодоступности
- •4.2.3. Исследования сравнительной кинетики растворения (исследования вне живого организма)
- •4.3. Отсутствие необходимости в исследованиях биоэквивалентности или биодоступности
- •5. Дизайн и проведение исследований биологической эквивалентности и биодоступности на людях 5.1. Общие требования.
- •5.2. Испытуемые
- •6. Регламент фармакокинетического исследования
- •7. Аналитический метод
- •8. Анализ фармакокинетических данных
- •8.1. Параметры, подлежащие оценке
- •8.1.1. Однократное введение лекарственного средства
- •8.1.2. Многократное введение лекарственного средства
- •9. Исключение резко выделяющихся наблюдений
- •12. Фармакодинамические исследования
- •13. Клинические испытания
- •14. Тест сравнительной кинетики растворения in vitro
- •15. Клинически значимые колебания биодоступности, обуславливающие отказ в регистрации лекарственного средства
- •Лабораторных животных
- •Участие в испытаниях биоэквивалентности/биодоступности
- •Номограмма для определения достаточного числа добровольцев по результатам проведенного исследования.
- •Хорошо растворимые лекарственные средства
- •Средства с высокой степенью абсорбции
- •Перечень терапевтических (лечебных) доз средств на основе лекарственного растительного сырья
- •Основная литература
- •6. Общие статьи на лекарственные формы и субстанции
2.2.31. Электрофорез
ОБЩИЙ ПРИНЦИП
Под действием электрического поля заряженные частички, растворенные или диспергированные в растворе электролита, передвигаются в направление к электроду противоположной полярности, # а молекулы с положительными и отрицательными зарядами передвигаются в направлении их суммарного заряда. # Скорость передвижения прямо пропорциональна суммарному заряду частицы и обратно пропорциональна ее размеру, либо молекулярной массе.
# Электрофоретическая подвижность является величиной, характерной для данного вещества. Различают абсолютную и относительную электрофоретическую подвижность. Абсолютная электрофоретическая подвижность под влиянием градиента потенциала 1 В на 1 см измеряется в сантиметрах в секунду. Относительная электрофоретическая подвижность есть отношение подвижности исследуемого вещества к подвижности другого вещества, принятого за стандарт.
В гель-электрофорезе движение частиц замедляется взаимодействием с окружающей матрицей геля, что действует как молекулярное сито. Встречные взаимодействия электрической силы и молекулярного сита приводят к диференциации скорости передвижения частиц в зависимости от их размеров, форм и зарядов. В ходе электрофореза из-за различия физико-химических свойств, разные макромолекулярные смеси передвигаются с разной скоростью и, таким образом, разделяются на дискретные фракции. Электрофоретическое разделение может быть проведено в системах без неподвижных фаз (например, свободное разделение раствора в капилярном электрофорезе) и в стабилизированных средах, таких как тонкослойные пластинки, пленки или гели.
# Существует два различных метода электрофореза: фронтальный и зональный. Фронтальный электрофорез проводят в свободной незакрепленной среде, и он является единственным способом определения абсолютной электрофоретической подвижности. Зональный электрофорез проводят в закрепленной среде, роль которой состоит в стабилизации электрофоретических зон.
ЭЛЕКТРОФОРЕЗ СО СВОБОДНОЙ ИЛИ ПОДВИЖНОЙ ГРАНИЦЕЙ
Этот метод обычно используется для определения электрофоретической подвижности, экспериментальной характеристики веществ, непосредственно измеренной и воспроизведенной. Этот метод обычно применяется для веществ с высокой молекулярной массой, которые имеют малую диффузию. Границы первоначально определяются физическими методами, например, рефрактометрией или кондуктометрией. Под действием определенного электрического поля в течение точно измеряемого времени определяют новые границы и их относительное положение. Условия испытания подбирают так, чтобы можно было определять столько границ, сколько веществ присутствует в испытуемом образце.
ЗОНАЛЬНЫЙ ЭЛЕКТРОФОРЕЗ С ИСПОЛЬЗОВАНИЕМ ФАЗЫ НОСИТЕЛЯ
Этот метод обычно используется лишь для небольших образцов испытуемых веществ.
Природа носителя, например, бумага, гель агара, ацетат целлюлозы, крахмал, агароза, полиакриламид, смешанный гель, служит причиной ряда дополнительных факторов, влияющих на подвижность:
- а) вследствие наличия каналов в фазе носителя, среднее растояние, которое проходит вещество, становится меньше реально пройденного расстояния;
б) некоторые фазы носителя электрически не нейтральны. Поскольку носители являются неподвижной фазой, это иногда может приводить к значительно большему электроэндоосмотическому потоку;
в) какое-нибудь нагревание в результате эффекта Джоуля может вызвать некоторое испарение жидкости с фазы носителя, что, в следствие капиллярности, приводит к движению раствора в направлении от краев к центру. Ионная сила в этом случае возрастает.
Следовательно, скорость передвижения зависит от таких главных факторов: подвижности заряженной частицы, потока скорости электроэндоосмоса и испарения жидкости с фазы носителя, а также силы (напряжения поля). Поэтому необходимо проводить испытание в строго определенных экспериментальных условиях и, по возможности, использовать стандартные вещества.
Прибор для электрофореза состоит из:
- источника постоянного тока, напряжение которого можно контролировать и, желательно, стабилизировать;
- электрофоретической камеры. Обычно это камера из стекла или твердой пластмассы, которая состоит из двух отдельных резервуаров - анодного и катодного, содержащих раствор электролита. В каждый резервуар камеры погружается электорд, напрмер, платиновый или графитовый. Они присоединяются изолированной схемой к соответствующему выходу источника питания и образуют анод и катод. Уровень жидкости в обоих резервуарах камеры поддерживается одинаковым для избежания переливания через сифон.
Электрофоретическая камера снабжена воздухонепроницаемой крышкой, которая поддерживает атмосферу насыщенной влажности на протяжении испытания и уменьшает испарение растворителя. При снятии крышки ток отключается предохранителем. Если электродвижущая сила измерена в интервале, превышающим 10 В, желательно охладить носитель;
- приспособления установки носителя:
Электрофорез на полосках. Полоски с носителем, поочередно смоченные электродным раствором, погружают в электродный резервуар, закрепляют и фиксируют соответствующим держателем для предупреждения диффузии электролита. Такими держателями можут быть горизонтальная рамка, направленный V-образный штатив или однородная поверхность с точками контакта через определенные интервалы.
Гель-электрофорез. Приспособление в основном состоит из стеклянной пластинки, на поверхность которой нанесен слой хорошо закрепленного геля одинаковой толщины. Соединение геля с электродным раствором осуществляется разными способами в зависимости от типа используемого прибора. Необходимо принять меры для предупреждения конденсации воды или высушивания твердого слоя;
- измерительного устройства или детектора.
Методика. Раствор электролита помещают в электродный резервуар. Соответствующим образом импрегнированный носитель с электролитным раствором помещают в камеру с обозначенными для используемого прибора условиями. Устанавливают линию старта и наносят образец. Подают электрический ток в течение определенного времени. После отключения тока носитель вынимают из камеры, высушивают и проявляют.
ЭЛЕКТРОФОРЕЗ НА КОЛОНКАХ С ПОЛИАКРИЛАМИДНЫМ ГЕЛЕМ
При электрофорезе на колонках с полиакриламидным гелем стационарной фазой является гель, приготовленный из смеси акриламида и N,N'-метиленбисакриламида. Колонку с гелем готовят с использованием трубок длиной 7,5 см и внутренним диаметром 0,5 см.
Прибор. Состоит из двух вставленных вертикально один над одним резервуаров для буферного раствора, приготовленных из подходящего материала, например, поли(метил метакрилата). Каждый резервуар снабжен платиновым электродом. Электроды присоединены к источнику тока, что позволяет проводить испытание или при постоянном токе, или при постоянном напряжении. В основании верхнего резервуара имеется ряд держателей, равноудаленных от электрода.
Методика. Обычно растворы дегазируют до начала полимеризации и гели используют сразу после приготовления. Готовят предписанную смесь компонентов, заливают в соответствующие закрытые снизу стеклянные колонки до одинакового уровня около 1 см от верхнего края, избегая попадания пузырьков воздуха в колонки. На смесь геля наслаивают слой воды Р, чтобы исключить попадания воздуха, и оставляют для полимеризации. Гелеобразование обычно занимает около 30 минут и завершается, когда образуется четкое разделение поверхности геля и водного слоя. Водный слой удаляют. Нижний резервуар наполняют указанным буферным раствором. Колонки открывают и вставляют в держатели верхнего резервуара так, чтобы дно колонок было погружено в буферный раствор нижнего резервуара. Колонки осторожно наполняют указанным буферным раствором. Готовят испытуемые образцы и образцы сравнения, содержащие индикаторный краситель, и уплотняют путем растворения в них, например, сахарозы Р. Приготовленные образцы наслаивают на поверхность геля, используя для каждого образца отдельную колонку. Верхний резервуар наполняют тем же буферным раствором. Электроды подключают к источнику тока и проводят процесс электрофореза при указанных условиях: темературе, постоянном напряжении или токе. Источник тока отключают, когда индикаторный краситель почти переходит в нижний резервуар. Каждую колонку сразу вынимают из прибора и извлекают гель. Локализуют положение полос на электрофореграмме.
ЭЛЕКТРОФОРЕЗ С НАТРИЕМ ДОДЕЦИЛСУЛЬФАТОМ В ПОЛИАКРИЛАМИДНОМ
ГЕЛЕ (ДСН-ПАГ)
Отрасль применения. Электрофорез в полиакриламидном геле применяется для качественной идентификации белков в биологических препаратах, контроля их чистоты и количественных определений.
Цель. Аналитический гель-электрофорез - метод, позволяющий идентифицировать и оценить гомогенность белков в лекарственных средствах. Метод обычно используется для определения молекулярных масс белковых субъединиц и субъединичного состава очищенных белков.
На рынке имеется разнообразный ассортимент готовых к использованию гелей и реактивов, которые могут быть использованы вместо описанных в общей статье, если получаются эквивалентные результаты и выполняются условия раздела "Валидация испытания", приведенного ниже.
СВОЙСТВА ПОЛИАКРИЛАМИДНЫХ ГЕЛЕЙ
Ситовые свойства полиакриламидных гелей обусловлены тримерной сеткой геля, образующегося бифункциональным бисакриламидом, поперечно связанным (сшитым) с соседними акриламидными цепями. Процесс полимеризации катализируется свободно-радикалгенерирующей системой, образующейся с аммонием персульфатом и тетраметилэтилендиамином.
При увеличении концентрации акриламида в геле уменьшается эффективный размер пор. Эффективный размер пор геля оперативно определяется ситовыми свойствами, то есть, сопротивлением миграции макромолекул. Акриламид может использоваться только в определенных концентрациях. При высоких концентрациях акриламида гели чаще ломаются и являются сложными в обработке. Поскольку размер пор геля уменьшается, уменьшается скорость миграции белка через гель. Регулируя размер пор геля, изменяя концентрацию акриламида, можно оптимизировать условия разделения испытуемого белкового продукта. Следовательно, данный гель характеризуется содержанием и массовым соотношением акриламида и бисакриламида.
Кроме состава геля важным компонентом электрофоретической подвижности является структура белка. В случае определения белков, электрофоретическая подвижность зависит от значения рК заряженных групп и размера молекулы. На это влияют тип, концентрация и рН буфера, температура и сила электрического поля, а также природа материала носителя.
ДЕНАТУРИРУЮЩИЙ ЭЛЕКТРОФОРЕЗ В ПОЛИАКРИЛАМИДНОМ ГЕЛЕ
Данный метод является примером анализа мономерных полипептидов с молекулярной массой от 14000 дальтон до 100000 дальтон. Возможно расширение границ молекулярных масс (например, путем использования градиентных гелей, особенностей буферной системы), но такие методики анализа не обсуждаются в данной статье.
Денатурирующий электрофорез в полиакриламидном геле с использованием натрия додецилсульфата (ДСН-ПАГ; SDS-PAGE) является наиболее общепринятым методом электрофореза, который используется для оценки качества белковых лекарственных средств и описан ниже в качестве примера указанного метода.
Обычно аналитический электрофорез белков проводят в полиакриламидных гелях в условиях, обеспечивающих диссоциацию белков на отдельные полипептидные субъединицы, что минимизирует их агрегацию.Чаще всего перед нанесением на гель белки подвергают диссоциации, нагревая их с сильным анионным детергентом - ДСН. Денатурированные полипептиды связываются с ДСН, превращаясь в отрицательно заряженные частички с постоянным отношением массы к заряду, независимо от типа белка. Поскольку количество связанного ДСН почти всегда пропорционально молекулярной массе полипептида и не зависит от его последовательности, ДСН-полипептидные комплексы мигрируют в полиакриламидном геле со скоростью, зависящей от размера полипептида.
Электрофоретическая подвижность полученных детергентполипептидных комплексов находится в функциональной взаимосвязи с их молекулярными массами. Миграция ДСН-комплексов происходит в направлении к аноду предположительно комплексы с низкими молекулярными массами движутся быстрее, чем с высокомолекулярными массами. Следовательно, молекулярная масса белка может быть определена калибровкой ДСН-ПАГ, и наличие единичной полосы в геле является критерием чистоты белка.
Однако модификации полипептидной цепи, например, N- или 0-гликозидными, приводят к значительной смене средней молекулярной массы белка, так как ДСН не связывается с карбогидратным компонентом так, как с полипептидным. В этом случае постоянное отношение заряда к молекулярной массе не сохраняется. Средняя молекулярная масса белков, подвергнутых посттрансляционной модификации, не является подлинным отображением массы полипептидной цепи.
ВОССТАНОВЛЕННЫЕ УСЛОВИЯ
Состав и тримерная структура белков часто поддерживаются присутствием дисульфидных связей. Целью ДСН-ПАГ испытаний в восстановленных условиях является разрушение структуры белка восстановлением дисульфидных связей. Полная денатурация и диссоциация белков обработкой 2-меркаптоэтанолом или дитиотреитолом (ДТТ) приводит к развертыванию полипептидной цепи и дальнейшему комплексообразованию с ДСН. В этих условиях молекулярную массу полипептидных субъединиц можно расчитать по линейной регрессии соответствующего стандарта молекулярных масс.
НЕВОССТАНОВЛЕННЫЕ УСЛОВИЯ
Для ряда испытаний полная диссоциация белка на субъенидичные пептиды невозможна. Из-за отсутствия восстанавливающих агентов, таких как 2-меркаптоэтанол или ДТТ, дисульфидные ковалентные связи становятся недоступными, сохраняя олигомерную форму белка. Олигомерные ДСН-белковые комплексы мигрируют свободнее, чем их ДСН-полипептидные субъединицы. Кроме того, невосстановленные белки не могут быть целиком насыщены ДСН и, соответственно, поэтому не могут связывать детергент с постоянным соотношением масс. Это делает молекулярно-массовое определение этих молекул с помощью ДСН-ПАГ неадекватным в сравнении с анализом полностью денатурированных полипептидов, так как необходимо наличие стандартов, которые имеют идентичную с испытуемым неизвестным белком конфигурацию для адекватного сравнения. Напротив проявление одной полосы в таком геле является критерием чистоты белка.
СВОЙСТВА ЭЛЕКТРОФОРЕЗА В ГЕЛЕ С ПРЕРЫВИСТОЙ БУФЕРНОЙ СИСТЕМОЙ
Наиболее широко используемый электрофоретический метод исследования сложных белковых смесей включает использование прерывистой буферной системы, который состоит из двух гелей: разрешающего или разделяющего (нижнего) геля и концентрирующего (верхнего) геля. Два геля отличаются пористостью, рН и ионной силой. Кроме того, используются разные по подвижности ионы в геле и электродных буферах. Буферная прерывистость приводит к концентрации большого объема образцов в концентрирующем геле и улучшению их разделения. При прохождении тока через испытуемый раствор падает напряжение, что вносит белки в концентрирующий гель. Ионы глицината с электродного буфера движутся за белками в концентрирующий гель. Быстро образуется область подвижной границы с высокоподвижными ведущими хролид-ионами и относительно медленными замыкающими ионами глицината. Образуется локализованный высоковольтный градиент между фронтами лидирующих и отстающих ионов, заставляя ДСН-белковые комплексы формировать тонкие зоны (полосы) и мигрировать между фазами хлорида и глицината. В широких границах, независимо от высоты нанесенного образца, все ДСН-белки конденсируются в очень узкую область и движутся к разделяющему гелю в виде четко определяемой тонкой зоны с высокой плотностью белка. Крупнопористый концентрирующий гель не задерживает миграцию большинства белков и, в основном, служит антиконвекторной средой.
На поверхности как концентрирующего, так и разделяющего гелей белки встречаются с резким возрастанием эффекта задерживания вследствие ограниченного размера пор разделяющего геля. Одновременно движение белков разделяющего геля продолжает замедляться вследствие ситовых свойств матрицы. Ионы глицината догоняют белки, а затем передвигаются в пространстве с постоянным рН, образованным трис(гидроксиметил)аминометаном и глицином. Молекулярно-ситовые свойства фазы приводят к разделу ДСН-полипептидных комплексов по их молекулярным массам.
ПРИГОТОВЛЕНИЕ ВЕРТИКАЛЬНЫХ ПРЕРЫВИСТО-БУФЕРНЫХ ДСН-ПОЛИАКРИЛАМИДНЫХ ГЕЛЕЙ
Составление кассет, формирующих гель. Две стеклянные пластинки (например, размером 10 см х 8 см), политетрафторэтиленовую гребенку, две прокладки и силиконовые трубки (например, диаметром 0.6 мм и длиной 35 см) моют с мягким детергентом и ополаскивают водой. Все указанное сушат бумажным полотенцем или тканью. Прокладки и трубки смазывают несиликоновым маслом. Прокладки укладывают вдоль двух коротких сторон стеклянных пластин на расстоянии 2 мм от их краев и 2 мм от длинной стороны, являющейся дном геля. Используя одну прокладку в качестве основы, начинают укладывать трубку. Осторожно просовывают трубку к низу прокладки и протягивают вдоль длинной стороны стеклянной пластинки. Придерживая трубку вдоль длинной стороны пластинки, укладывают трубку по короткой стороне стеклянной пластинки, используя прокладку в качестве направляющей. Накрывают другой стеклянной пластинкой, плотно прижимая кассету руками. Устанавливают по два зажима на две короткие стороны кассеты. Осторожно устанавливают четыре зажима на длинную сторону кассеты геля, формируя дно кассеты. Необходимо удостовериться, чтобы трубка проходила вдоль края стеклянной пластинки и нигде не выдавливалась при размещении зажимов. Кассета готова для заливания гелем.
Приготовление геля. В случае прерывистого буферного ДСН-полиакриламидного геля рекомендуется залить разделительный гель, дождаться его полимеризации и затем залить концентрирующий гель, поскольку гели отличаются содержанием акриламида-бисакриламида, буфером и рН.

Приготовление разделительного геля. В конической колбе готовят соответствующий объем раствора с необходимой концентрацией акриламида для формирования геля, используя указания, приведенные в Табл. 2.2.31.-1. Компоненты смешивают в указанной последовательности. Если необходимо, перед прибавлением раствора аммония персульфата и тетраметилэтилендиамина (ТЕМЭД) раствор фильтруют под вакуумом сквозь ацетатцеллюлозную мембрану (диаметр пор 0.45 мкм); раствор выдерживают под вакуумом, взбалтывая фильтрационное приспособление до окончания образования в растворе пузырьков. Прибавляют соответствующее количество раствора аммония персульфата и ТЕМЭД, как указано в Табл. 2.2.31.-1, взбалтывают и сразу заливают в пространство между двумя пластинками кассеты. Оставляют необходимое место для формирующего геля (к длине зубца гребеня прибавляют 1 см). Используя заостренную стеклянную пипетку, осторожно наслаивают насыщенный водой раствор изобутанола. Гель выдерживают в вертикальном положении при комнатной температуре до полимеризации.
|
1.5М Трис (рН 8.8) (2) |
1,3 2,5 3,8 5,0 6,3 7,5 10,0 12,5 |
|
Раствор 100 г/л ДСН (3) |
0,05 0,1 0,15 0,2 0,25 0,3 0,4 0,5 |
|
Раствор 100 г/л АПС (4) |
0,05 0,1 0,15 0,2 0,25 0,3 0,4 0,5 |
|
ТЕМЭД (5) |
0,002 0,004 0,006 0,008 0,01 0,012 0,016 0,02 |
|
14% акриламид |
|
|
Вода Р |
1,4 2,7 3,9 5,3 6,6 8,0 10,6 13,8 |
|
Раствор акриламида (1) |
2,3 4,6 7,0 9,3 11,6 1,.9 18,6 23,2 |
|
1.5М Трис (рН 8.8) (2) |
1,2 2,5 3,6 5,0 6,3 7,5 10,0 12,5 |
|
Раствор 100 г/л ДСН (3) |
0,05 0,1 0,15 0,2 0,25 0,3 0,4 0,5 |
|
Раствор 100 г/л АПС (4) |
0,05 0,1 0,15 0,2 0,25 0,3 0,4 0,5 |
|
ТЕМЭД (5) |
0,002 0,004 0,006 0,008 0,01 0,012 0,016 0,02 |
|
15% акриламид |
|
|
Вода Р |
1,1 2,3 3,4 4,6 5,7 6,9 9,2 11,5 |
|
Раствор акриламида (1) |
2,5 5,0 7,5 10,0 12,5 15,0 20,0 25,0 |
|
1.5М Трис (рН 8.8) (2) |
1,3 2,5 3,8 5,0 6,3 7,5 10,0 12,5 |
|
Раствор 100 г/л ДСН (3) |
0,05 0,1 0,15 0,2 0,25 0,3 0,4 0,5 |
|
Раствор 100 г/л АПС (4) |
0,05 0,1 0,15 0,2 0,25 0,3 0,4 0,5 |
|
ТЕМЭД (5) |
0,002 0,004 0,006 0,008 0,01 0,012 0,016 0,02 |
|
(1) Раствор акриламида: 30% раствор акриламида/бисакриламида (29:1) Р. (2) 1.5М Трис (рН 8.8): 1.5М буферный раствор трис-гидрохлорида рН 8.8 Р. (3) Раствор 100 г/л ДСН: раствор 100 г/л натрия додецилсульфоната Р. (4) Раствор 100 г/л АПС: раствор 100 г/л аммония персульфата Р. Аммония персульфат доставляет свободные радикалы, которые ускоряют полимеризацию акриламида и бисакриламида. Поскольку раствор аммония персульфата разлагается, следует готовить еженедельно свежие растворы (5) ТЕМЭД: тетраметилэтилендиамин Р. | |
Приготовление концентрирующего геля. После завершения полимеризации (около 30 минут) сливают изобутанол и промывают верхнюю поверхность геля несколько раз водой для удаления нанесенного изобутанола и каких-либо неполимеризованных излишек акриламида. Удаляют как можно больше жидкости с поверхности геля при помощи кончика бумажной салфетки.
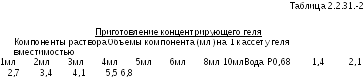
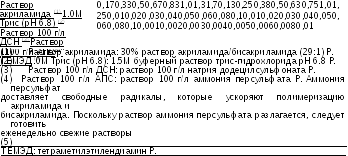
В конической колбе готовят соответствующий объем концентрирующего геля с необходимой концентрацией акриламида, используя значения, указанные в Табл. 2.2.31.-2. Компоненты смешивают в обозначенной последовательности. Если необходимо, перед прибавлением раствора аммония персульфата и ТЕМЭД раствор фильтруют под вакуумом сквозь ацетатцеллюлозную мембрану (диаметр пор 0.45 мкм); раствор выдерживают под вакуумом, взбалтывая фильтрационное приспособление до окончания образования в растворе пузырьков. Прибавляют соответствующее количество раствора аммония персульфата и ТЕМЭД, как указано в Табл. 2.2.31.-2, взбалтывают (встряхивают вращательными движениями) и сразу заливают в пространство между двумя пластинками кассеты прямо на поверхность полимеризованного разделительного геля. В раствор концентрирующего геля сразу вкладывают чистый политетрафторэтиленовый гребень для избежания появления воздушных пузырьков. Прибавляют еще раствор концентрирующего геля до полного заполнения пространства гребня. Гель выдерживают в вертикальном положении при комнатной температуре до полимеризации.
 Сборка
электрофоретического прибора и
проведение электрофоретического
разделения. После
завершения полимеризации (около 30
минут) осторожно удаляют
политетрафторэтиленовый гребень. Сразу
ополаскивают стенки водой или буферным
рабочим раствором для электрофореза
в системе ДСН-ПАГ Р для
удаления излишков неполимеризованного
акриламида. При необходимости поправляют
выступ концентрирующего геля тупой
гиподермичной иголкой, надетой на
шприц. Снимают зажимы с одной короткой
стороны, осторожно вытягивая трубку.
Аналогично снимают зажимы с другой
короткой стороны. Затем удаляют трубку
со дна геля. Помещают гель в электрофоретичный
прибор. Верхний и нижний резервуары
наполняют буфером для электрофореза.
Удаляют все пузырьки, образующиеся на
поверхности геля между двумя стеклянными
пластинками. Для этих целей лучше всего
использовать иголку, надетую на шприц.
Не следует проводить первоначальный
электрофорез до нанесения образцов,
так как это приведет к нарушению
непрерывности буферной системы. Перед
нанесением образцов осторожно
ополаскивают отверстие буфрным
рабочим раствором для электрофореза
в системе ДСН-ПАГ Р. Готовят
испытуемые растворы и растворы сравнения
в рекомендованном буфере для образцов
и обрабатывают, как указано в частной
статье. Наносят необходимое количество
каждого раствора в карманы концентрирующего
геля. Начинают электрофорез в условиях,
указанных в инструкции к прибору.
Изготовители ДСН-ПАГ приборов могут
поставлять гели разных размеров и
толщины. Для получения оптимального
разделения необходимо подбирать время
проведения электрофореза, а также силу
тока/напряжения соответственно с
указанием изготовителя приборов.
Сборка
электрофоретического прибора и
проведение электрофоретического
разделения. После
завершения полимеризации (около 30
минут) осторожно удаляют
политетрафторэтиленовый гребень. Сразу
ополаскивают стенки водой или буферным
рабочим раствором для электрофореза
в системе ДСН-ПАГ Р для
удаления излишков неполимеризованного
акриламида. При необходимости поправляют
выступ концентрирующего геля тупой
гиподермичной иголкой, надетой на
шприц. Снимают зажимы с одной короткой
стороны, осторожно вытягивая трубку.
Аналогично снимают зажимы с другой
короткой стороны. Затем удаляют трубку
со дна геля. Помещают гель в электрофоретичный
прибор. Верхний и нижний резервуары
наполняют буфером для электрофореза.
Удаляют все пузырьки, образующиеся на
поверхности геля между двумя стеклянными
пластинками. Для этих целей лучше всего
использовать иголку, надетую на шприц.
Не следует проводить первоначальный
электрофорез до нанесения образцов,
так как это приведет к нарушению
непрерывности буферной системы. Перед
нанесением образцов осторожно
ополаскивают отверстие буфрным
рабочим раствором для электрофореза
в системе ДСН-ПАГ Р. Готовят
испытуемые растворы и растворы сравнения
в рекомендованном буфере для образцов
и обрабатывают, как указано в частной
статье. Наносят необходимое количество
каждого раствора в карманы концентрирующего
геля. Начинают электрофорез в условиях,
указанных в инструкции к прибору.
Изготовители ДСН-ПАГ приборов могут
поставлять гели разных размеров и
толщины. Для получения оптимального
разделения необходимо подбирать время
проведения электрофореза, а также силу
тока/напряжения соответственно с
указанием изготовителя приборов.
Необходимо удостовериться, что окрашенный фронт доходит до разделительного геля. Когда краситель доходит до нижнего края геля, электрофорез заканчивают. Кассету геля вынимают из прибора и отделяют стеклянные пластинки. Вытаскивают прокладки, отрезают, отделяют концентрирующий гель и окрашивают полученный гель.
ОПРЕДЕЛЕНИЕ БЕЛКОВ В ГЕЛЯХ
Наиболее широко применяется метод окрашивания белков красителем Кумасси (# кислотный синий 92), позволяющий определить от 1 мкг до 10 мкг белков в одной полосе. Окрашивание серебром - наиболее чувствительный метод для окрашивания белков в гелях, при этом определяются полосы, содержащие от 10 нг до 100 нг белка.
Все стадии окрашивания геля проводят при комнатной температуре, осторожно встряхивая (например, на платформе шейкера) в подходящей посуде. При окрашивании гелей необходимо надевать рукавицы, так как на геле остаются отпечатки пальцев.
Краска Кумасси. Гель погружают в большой объем раствора краски Кумасси Р, выдерживают продолжительностью не менее 1 часа. Затем сливают раствор для окрашивания.
Гель обесцвечивают большим объемом обесцвечивающего раствора Р. Обесцвечивающий раствор меняют несколько раз до четкого проявления белковых полос на прозрачном фоне. Чем тщательнее обесцвечивают гель, тем меньшее количество белков можно найти этим методом. Обесцвечивание можно ускорить использованием нескольких граммов анионобменной смолы или маленькой губки, смоченной обесцвечивающим раствором Р.
ПРИМЕЧАНИЕ. Кислотно-спиртовые растворы, используемые в указанных методиках, не полностью фиксируют белки в геле. Это может привести к потерям некоторых низкомолекулярных белков в процессе окрашивания и обесцвечивания тонких гелей. Стойкая фиксация обеспечивается выдерживанием геля в смеси трихлоруксусная кислота Р - метанол Р - вода Р (1:4:5) в течение 1 часа перед погружением геля в раствор краски Кумасси Р.
Окрашивание серебром. Гель погружают в большой объем фиксирующего раствора Р и выдерживают продолжительностью 1 час. Фиксирующий раствор сливают, гель заливают свежим фиксирующим раствором и выдерживают продолжительностью не менее 1 часа и, если возможно, оставляют на ночь. Фиксирующий раствор сливают и гель промывают большим объемом воды Р в течение 1 ч. Затем гель выдерживают в растворе 1% (об/об) глутарового альдегида Р в течение 15 мин, дважды промывают большим объемом воды Р, каждый раз продолжительностью 15 минут, помещают в свежеприготовленный реактив серебра нитрата Р и выдерживают по 15 мин в темном месте. Затем трижды промывают большим объемом воды Р, каждый раз по 5 мин. Гель выдерживают в растворе проявителя Р около 1 минуты до достаточного окрашивания. Проявление останавливают, помещая гель в блокирующий растор Р на 15 мин. Ополаскивают гель водой Р.
ВЫСУШИВАНИЕ ОКРАШЕННЫХ ДСН-ПОЛИАКРИЛАМИДНЫХ ГЕЛЕЙ
Гели высушивают в зависимости от использованного метода окрашивания. Кумасси-окрашенные гели после стадии обесцвечивания выдерживают в растворе 100 г/л глицерина Р в течение 2 ч (возможно инкубирование на ночь). При окрашивании серебром на конечной стадии ополаскивания выдерживают гель в растворе 20 г/л глицерина Р в течение 5 мин.
Два листа пористой целлюлозной пленки погружают в воду Р и выдерживают от 5 до 10 мин. Один из листов помещают на рамку высушивания, осторожно наносят на него гель, удаляют воздушные пузырьки и наносят несколько миллилитров воды Р по краям геля, накрывают другим листом, удаляют воздушные пузырьки и завершают сборку рамки высушивания. Рамку помещают в сушилку и оставляют при комнатной температуре до высушивания геля.
ОПРЕДЕЛЕНИЕ МОЛЕКУЛЯРНОЙ МАССЫ
Молекулярную массу белков определяют, сравнивая их подвижность с известными белками известной молекулярной массой. Имеются заранее смешанные смеси белков с известными и разными интервалами молекулярных масс для равномерного окрашивания и калибрования гелей. Концентрированные растворы белков с известной молекулярной массой разводят соответствующим буферным раствором для образцов и наносят на тот же гель, что и испытуемый белок.
Сразу после проведения электрофореза определяют электрофоретический фронт красителя бромфенолового синего. Это можно сделать нанесением насечки на край геля или введением иголки, смоченной индигокармином на фронт красителя. После окрашивания измеряют расстояние миграции каждой белковой полосы (известных и неизвестных) от края разделительного геля. Расстояние передвижения каждого белка делят на расстояние, пройденное сопутствующим красителем. Полученные результаты передвижения называются относительной подвижностью белков (относительно фронта красителя) и условно обозначаются Rf. Строят график зависимости логарифма относительных молекулярных масс (М.м.) белковых стандартов от условно полученных значений Rf. Обычно график имеет слегка сигмовидную форму. Неизвестные молекулярные массы определяют методом линейной регрессии интерполяцией графика зависимости log М.м. от Rf., если значения, полученные для неизвестных образцов, располагаются на линейной части графика.
ВАЛИДАЦИЯ ИСПЫТАНИЯ
Результаты испытания признаются достоверными если молекулярные массы известных белков расположены вдоль 80% длины геля и по всей области необходимого деления (то есть, области, покрывающей образец и его димеры или образец и сопровождающие примеси), разделение соответствующих белковых полос проявляет линейную зависимость логарифма молекулярной массы от Rf. Дополнительные условия к валидации по отношению к испытуемым растворам указываются в частной статье.
КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ ПРИМЕСЕЙ
Если в частной статье указывают предел содержания примесей, в испытании необходимо использовать раствор сравнения соответствующего разведения. Например, если предел содержания примесей составляет 5%, необходимо использовать раствор сравнения, разведенный по отношению к испытуемому раствору в соотношении 1:20. На электрофореграмме испытуемого раствора ни одна примесь (ни одна полоса, кроме основной) не должна быть интенсивнее основной полосы на электрофореграмме раствора сравнения.
Для валидированной методики содержание примесей может определяться методом внутренней нормализации по отношению к основной полосе с использованием интегрирующего денситометра. При валидации методики необходимо подтвердить линейность сигнала.
