
- •Государственная фармакопея республики беларусь первое издание
- •Республики Беларусь
- •1. Общие сведения
- •1.1. Общие положения
- •1.2. Другие положения, распространяющиеся на общие и частные фармакопейные статьи
- •Условия хранения лекарственного средства
- •Пределы, указываемые на упаковке
- •1.5. Сокращения и обозначения
- •1.6. Единицы международной системы (си), используемые в фармакопейных статьях, и их соответствие другим единицам
- •2. Методы анализа
- •2.1. Оборудование
- •2.1.1. Каплемер
- •2.1.2. Сравнительная таблица пористости стеклянных фильтров
- •Пористость фильтра (ф.Евр.) (1)
- •Максимальный диаметр пор в микрометрах
- •2.1.3. Лампы с ультрафиолетовым излучением для аналитических целей
- •2.1.4. Сита
- •2.2. Физические и физико-химические методы
- •2.2.1. Определение прозрачности и степени мутности жидкостей
- •2.2.2. Определение степени окрашивания жидкостей
- •2.2.3. Потенциометрическое определение рН
- •2.2.4. Зависимость между реакцией раствора, приблизительным значением рН и цветом индикаторов
- •Изменение цвета
- •2.2.5. Относительная плотность
- •2.2.6. Показатель преломления (индекс рефракции)
- •2.2.7. Оптическое вращение
- •2.2.8. Вязкость
- •1/Прив 1
- •2.2.9. Метод капиллярной вискозиметрии
- •2.2.10. Метод ротационной вискозиметрии
- •2.2.11. Температурные пределы перегонки
- •2.2.14. Температура плавления - капиллярный метод
- •2.2.17. Температура каплепадения
- •2.2.18. Температура затвердевания
- •2.2.21. Флуориметрия
- •2.2.22. Атомно-эмиссионная спектрометрия
- •2.2.23. Атомно-абсорбционная спектрометрия
- •2.2.24. Абсорбционная спектрофотометрия в инфракрасной
- •2.2.25. Абсорбционная спектрофотометрия в ультрафиолетовой видимой областях
- •2. Многокомпонентный спектрофотометрический анализ.
- •2.2.26. Бумажная хроматография
- •2.2.27. Тонкослойная хроматография
- •2.2.28. Газовая хроматография
- •2.2.29. Жидкостная хроматография
- •2.2.30. Эксклюзионная хроматография
- •2.2.31. Электрофорез
- •2.2.32. Потеря в массе при высушивании
- •2.2.33. Спектрометрия ядерного магнитного резонанса
- •2.2.34. Термогравиметрия
- •2.2.35. Осмоляльность
- •2.2.36. Потенциометрическое определение концентрации ионов с использованием ионселективных электродов
- •2.2.37. Рентгенофлуоресцентная спектрометрия
- •2.2.38. Удельная электропроводность
- •2.2.39. Молекулярно-массовое распределение декстранов
- •2.2.40. Спектрофотометрия ближнего ик-диапазона
- •2.2.41. Круговой дихроизм
- •2.2.42. Плотность твердых тел
- •2.2.43. Масс-спектрометрия
- •2.2.44. Определение содержания общего органического углерода в воде для фармацевтического применения
- •2.2.45. Сверхкритическая флюидная хроматография
- •2.2.46. Хроматографические методы разделения
- •2.2.47. Капиллярный электрофорез
- •2.2.48. Рамановская спектрометрия (# спектрометрия комбинационного рассеяния)
- •2.2.54. Изоэлектрическое фокусирование
- •2.3.1. Реакции подлинности (идентификации) на ионы и функциональные группы
- •2.3.2. Идентификация жирных масел методом тонкослойной хроматографии
- •2.3.3. Идентификация фенотиазинов методом тонкослойной хроматографии
- •2.3.4. Определение запаха
- •2.4. Испытания на предельное содержание примесей
- •2.4.1. Аммония соли
- •2.4.2. Мышьяк
- •2.4.3. Кальций
- •2.4.6. Магний
- •2.4.7. Магний и щелочноземельные металлы
- •2.4.8. Тяжелые металлы
- •2.4.15. Никель в полиолах
- •2.4.1.6. Общая зола
- •2.4.21. Посторонние масла в жирных маслах методом тонкослойной хроматографии
- •2.4.22. Посторонние жирные кислоты в маслах методом газовой хроматографии
- •2.4.23. Стерины в жирных маслах
- •2.4.24. Идентификация остаточных растворителей и их количественное определение
- •2.4.25. Остаточные количества этиленоксида и диоксана
- •2.4.27. Никель в гидрогенизированных растительных маслах
- •2.5. Методы количественного определения 2.5.1. Кислотное число
- •2.5.3. Гидроксильное число
- •2.5.4. Йодное число
- •2.5.5. Перекисное (пероксидное) число
- •2.5.6. Число омыления
- •2.5.7. Неомыляемые вещества
- •2.5.8. Определение аминного азота в соединениях, которые содержат первичную ароматическую аминогруппу
- •2.5.9. Определение азота после минерализации серной кислотой
- •2.5.10. Метод сжигания в колбе с кислородом
- •2.5.11. Комплексометрическое титрование
- •2.5.12. Вода: полумикрометод (#Метод к.Фишера)
- •2.5.13. Алюминий в адсорбированных вакцинах
- •2.5.14. Кальций в адсорбированных вакцинах
- •2.5.20. Гексозамины в полисахаридных вакцинах
- •2.5.21. Метилпентозы в полисахаридных вакцинах
- •2.5.24. Диоксид углерода в газах
- •2.5.25. Оксид углерода в газах
- •2.5.26. Оксид азота и диоксид азота в газах
- •2.5.27. Кислород в газах
- •2.5.30. Окисляющие вещества
- •2.5.33. Общий белок
- •2.5.34. Уксусная кислота в синтетических пептидах
- •2.6. Биологические испытания
- •2.6.1. Стерильность
- •2.6.2. Микобактерии
- •2.6.3. Испытания на посторонние вирусы с использованием куриных эмбрионов
- •2.6.4. Испытание на вирусы лейкоза
- •2.6.5. Испытание на посторонние вирусы с использованием клеточных культур
- •2.6.6. Испытание на посторонние агенты с использованием цыплят.
- •2.6.7. Микоплазмы
- •2.6.8 Пирогенность
- •2.6.9. Аномальная токсичность
- •2.6.10. Гистамин
- •2.6.11. Депрессорные вещества
- •2.6.12. Микробиологические испытания нестерильной продукции (суммарное количество жизнеспособных аэробов)
- •2.6.13. Микробилогические испытания нестерильной продукции (испытания на наличие специфических микроорганизмов)
- •0,9 % Раствор натрия хлорида
- •1 % Раствор фенолового красного
- •0,5 % Раствор малахитового зеленого
- •2.6.14. Бактериальные эндотоксины
- •1. Предварительные испытания
- •2. Предельное испытание (метод а) (I) Методика
- •2. Полуколичественное испытание (метод в)
- •1. Турбидиметрический принцип (методы с и f)
- •2.6.15. Активатор прекалликреина
- •2.6.16. Испытания на посторонние агенты в вирусных вакцинах для медицинского применения
- •2.6.17. Испытание на антикомплементарную активность иммуноглобулина
- •2.6.18. Испытание живых вирусных вакцин на нейровирулентность
- •2.6.19. Испытание пероральной вакцины полиомиелита на нейровирулентность
- •5.1. Предотвращение загрязнения
- •5.4 Детектирование
- •7.1 Валидация системы для количественного определения методом
- •7.2. Контроль качества реагентов.
- •7.3. Контроль хода испытания.
- •7.4. Внешняя оценка качества
- •2.6.22. Активированные факторы свертывания крови
- •2.7 Биологические методы количественного определения
- •2.7.1. Иммунохимические методы
- •2.7.2. Количественное определение антибиотиков микробиологическим методом
- •2.7.3. Количественное определение кортикотропина
- •2.7.4. Количественное определение фактора свертывания крови VIII
- •2.7.5. Количественное определение гепарина
- •2.7.6. Количественное определение вакцины дифтерии (адсорбированной)
- •2.7.7. Количественное определение вакцины коклюша
- •2.7.8. Количественное определение вакцины столбняка (адсорбированной)
- •2.7.9. Определение функционального состояния Fc-фрагмента иммуноглобулина
- •2.7.10. Количественное определение фактора свертывания крови человека VII
- •2.7.11. Количественное определение фактора свертывания крови человека IX
- •2.7.12. Количественное определение гепарина в концентратах
- •2.7.13. Количественное определение человеческого анти-d-иммуноглобулина
- •2.7.14. Количественное определение антигенной (иммуногенной) активности вакцины гепатита а
- •2.7.15. Количественное определение вакцины гепатита в (rdna)
- •2.7.16. Количественное определение вакцины коклюша (бесклеточной)
- •2.7.17. Количественное определение антитромбина III человека
- •2.7.18. Количественное определение фактора свертывания крови II
- •2.7.19. Количественное определение фактора свертывания крови х
- •2.7.20. Количественное определение инактивированной вакцины полиомиелита in vivo
- •2.7.22. Количественное определение фактора свертывания крови человека XI
- •2.8. Методы анализа лекарственного растительного сырья и лекарственных средств из него
- •2.8.1. Зола, нерастворимая в хлористоводородной кислоте
- •2.8.4. Коэффициент набухания
- •2.8.5. Определение воды в эфирных маслах
- •2.8.10. Растворимость эфирных масел в спирте
- •2.8.11. Определение 1,8-цинеола в эфирных маслах
- •2.8.12. Определение эфирного масла
- •2.8.13. Остаточное количество пестицидов
- •1. Экстракция
- •2. Очистка
- •3. Количественный анализ
- •Относительные времена удерживания инсектицидов
- •2.8.15. Определение показателя горечи
- •2.8.16. Сухой остаток экстрактов
- •2.8.17. Потеря в массе при высушивании экстракта
- •2.9. Фармацевтико-технологические испытания
- •2.9.1. Распадаемость таблеток и капсул
- •2.9.2. Распадаемость суппозиториев и пессариев
- •2.9.3. Тест «растворение» для твердых дозированных форм
- •2.9.4. Тест «растворение» для трансдермальных пластырей
- •2.9.5. Однородность массы для единицы дозированного лекарственного средства
- •2.9.6. Однородность содержания действующего вещества в
- •2.9.7. Прочность таблеток без оболочки на истирание
- •2.9.8. Прочность таблеток на сжатие
- •2.9.9. Измерение консистенции методом пенетрометрии
- •2.9.10 Содержание этанола
- •2.9.11. Испытание на содержание метанола и 2-пропанола
- •2.9.12. Ситовой анализ
- •2.9.15. Насыпной объем
- •2.9.16. Сыпучесть
- •2.9.17. Определение извлекаемого объема парентеральных лекарственных средств
- •Масса действующего вещества высвобожденного при опорожнении
- •Фракция действующего вещества (%)
- •2.9.19. Загрязнение механическими включениями: невидимые частицы.
- •2.9.20. Загрязнение механическими включениями: видимые частицы
- •2.9.21. Загрязнение механическими включениями: метод микроскопии
- •2.9.22. Опредление времени деформации липофильных суппозиториев
- •2.9.23. Определение плотности твердых частиц при помощи пикнометра
- •2.9.24. Устойчивость суппозиториев и пессариев к разрушению
- •2.9.26. Опредедение удельной площади поверхности методом газовой адсорбции
- •III.1.3. Количество образца
- •III.2.1. Метод 1: метод динамического потока
- •III.2.2. Метод 2: метод объёмного анализа
- •2.9.27. Однородность массы одной дозы высвобожденной из многодозового контейнера
- •2.9.28. Определение массы или объема содержимого контейнера для жидких и мягких лекарственных средств
- •3.1. Материалы, используемые для производства контейнеров
- •3.1.1. Материалы, используемые для производства контейнеров для человеческой крови и компонентов
- •3.1.1.1. Материалы на основе пластифицированного поливинилхлорида, используемые для производства
- •3.1.1.2. Материалы на основе пластифицированного поливинилхлорида для трубок, используемых в комплектах для переливания крови и компонентов крови
- •3.1.3. Полиолефины
- •3.1.4. Полиэтилен без добавок для контейнеров для парентеральных и офтальмологических лекарственных средств
- •3.1.5. Полиэтилен с добавками для контейнеров для
- •3.1.6. Полипропилен для контейнеров и укупорочных материалов для парентеральных и офтальмологических лекарственных средств
- •3.1.7. Полиэтиленвинилацетат для контейнеров и трубок для лекарственных средств для парентерального питания
- •3.1.8. Силиконовое масло, используемое в качестве смазывающей добавки
- •3.1.9. Силиконовые эластомеры для укупорочных
- •3.1.10. Материалы на основе непластифицированного поливинилхлорида для контейнеров для неинъекционных водных растворов
- •3.1.11. Материалы на основе непластифицированного поливинилхлорида для контейнеров для твердых лекарственных форм для перорального применения
- •3.1.13. Добавки к пластмассе
- •3.1.14. Материалы на основе пластифицированного поливинилхлорида для контейнеров для водных растворов для внутривенного применения
- •3.1.15. Полиэтилентерефталат для контейнеров для лекарственных средств для непарентерального применения
- •3.2. Контейнеры
- •3.2.1. Стеклянные контейнеры для фармацевтического использования
- •3.2.2. Пластмассовые контейнеры и укупорочные средства для фармацевтического использования
- •3.2.2.1. Пластмассовые контейнеры для водных растворов для парентерального применения
- •3.2.3. Стерильные пластмассовые контейнеры для человеческой крови и ее компонентов
- •3.2.4. Пустые стерильные контейнеры из пластифицированного поливинилхлорида для человеческой крови и ее компонентов
- •3.2.5. Стерильные контейнеры из пластифицированного поливинилхлорида для человеческой крови, содержащие раствор антикоагулянта
- •3.2.6. Комплекты для переливания крови и компонентов крови
- •3.2.8. Стерильные одноразовые пластмассовые шприцы
- •3.2.9. Резиновые укупорочные средства для контейнеров, предназначенных для водных лекарственных средств для парентерального применения, порошков и лиофилизированных порошков
- •4. Реактивы
- •4.1. Реактивы, эталонные растворы, буферные растворы
- •4.1.1. Реактивы
- •4.1.2. Эталонные растворы для испытаний на предельное содержание примесей
- •0,1 М фосфатный буферный раствор рН 8,0. 4008400.
- •4.2. Реактивы, титрованные растворы для объемного нализа
- •1 М щелочной раствор меди-этилендиамина. 3008700
- •5.1 Общие тексты по стерилизации
- •5.1.1. Методы приготовления стерильных продуктов
- •5.1.2. Биологические индикаторы стерилизации
- •5.1.3. Эффективность антимикробных консервантов
- •24 Часа
- •5.1.4. Микробиологическая чистота лекарственных средств
- •5.1.5 .Применение f0 концепции при стерилизации паром водных растворов.
- •5.2. Общая информация о вакцинах
- •5.2.1. Общепринятая терминология
- •5.2.2. Стаи кур, не имеющих конкретных патогенов и используемые для производства вакцин и контроля их качества
- •5.2.3. Субстраты клеток для производства вакцин, используемых людьми
- •5.2.6. Оценка безопасности вакцин
- •5.2.7. Оценка эффективности вакцин
- •5.2.8. Снижение риска передачи возбудителей губчатой энцефалопатии через лекарственные средства
- •1. Общие замечания
- •2. Область применения общей главы
- •3.1. Животные как источник материала
- •3.2. Части тел животных, жидкости и выделения в качестве исходных материалов
- •3.3. Проверка процесса
- •5.3. Статистические методы обработки результатов анализа
- •5.3.1. Статистический анализ результатов биологических исследований и количественных определений
- •1.1. Общие положения и точность
- •2. Рандомизация и независимость конкретных исследований
- •3. Количественные определения, основанные на количественных эффектах
- •3.1. Статистические модели
- •3.2. Модель параллельных линий
- •3.2.2.1 Схема полной рандомизации
- •3.2.2.2 Схема рандомизированных блоков
- •3.3. Модель угловых коэффициентов
- •3.3.5.2 (/7С/)-схема
- •4. Тесты с альтернативным типом эффекта 4.1. Введение
- •4.2. Метод пробит-анализа
- •5.1. Модель параллельных линий.
- •5.2. Модель угловых коэффициентов
- •5.3. Альтернативные эффекты
- •6 Объединение результатов количественного определения 6.1. Введение
- •6.2. Взвешенное объединение результатов количественного определения
- •6.3. Невзвешенное объединение результатов количественного опре- деления
- •6.4. Пример определения взешенной средней активности с доверительн1м интервалом
- •7. Дополнение
- •7.1. Общие линейные модели
- •7.4. Ошибки корреляции
- •8. Таблицы и процедуры генерирования
- •8.5. Случайные размещения
- •8.6. Латинские квадраты
- •9. Принятые обозначения
- •1. Выборка
- •1.1. Среднее зна чение и дисперсия
- •1.3. Доверительные интервалы и оценка их величины.
- •1.4. Односторонние и двусторонние доверительные интервалы.
- •2. Метрологические характеристики методики анализа
- •2.1.1. Объединенная дисперсия и объединенное среднее
- •2.1.2. Критерий Бартлетта.
- •2.1.3. Критерий Кохрейна.
- •2.2. Проверка наличия значимой систематической погрешности.
- •3. Сравнение двух методик анализа по воспроизводимости
- •4. Метрологическая характеристика среднего результата.
- •5. Сравнение средних результатов двух выборок
- •5.3. Известно точное значение величины а.
- •6. Интерпретация результатов анализа, полученных с помощью метрологически аттестованной методики.
- •6.1. Оценка сходимости результатов параллельных определений.
- •6.2. Определение необходимого числа параллельных определений.
- •6.3. Гарантия качества продукции.
- •7. Расчет и статистическая оценка параметров линейной зависимости
- •8. Последовательная схема статистического анализа результатов химических измерений
- •9. Примеры
- •9.1 Вычисление среднего значения и дисперсии.
- •9.2 Проверка однородности выборки малого объема
- •9.3. Вычисление доверительных интервалов и неопределенностей измерений.
- •9.4. Проверка гипотезы равенства дисперсий.
- •9.4.1. Объединение результатов выборок разного объема.
- •9.4.2. Объединение результатов выборок одинакового объема.
- •9.5. Сравнение двух методик анализа по воспроизводимости.
- •9.6. Сравнение средних результатов двух выборок.
- •9.7. Оценка качества продукции.
- •9.8. Контроль содержания салициловой кислоты в салициловом спирте посредством секвенционального анализа.
- •10. Расчет неопределенности функции нескольких случайных переменных
- •10.1. Линейная модель
- •10.1.1. Взвешенное среднее
- •10.2. Подход Уэлча-Сатертуэйта
- •10.3. Примеры расчетов неопределенности функции нескольких переменных
- •10.3.1. Расчет неопределенности вэжх-анализа готового лекарственного средства
- •10.3.1.1. Конечная аналитическая операция
- •10.3.1.2. Суммарная неопределенность пробоподготовки asp,r.
- •10.3.1.3. Расчет суммарной неопределенности анализа aAs,r
- •10.3.2. Прогноз неопределенности спектрофотометрического анализа готового лекарственного средства
- •10.3.3. Расчет среднего значения нескольких неравноточных выборок
- •1. Введение
- •2. Аналитические испытания и методики, подлежащие валидации
- •3. Валидационные характеристики и требования
- •4. Словарь
- •2. Специфичность
- •5. Правильность
- •5.1. Количественное определение
- •5.2. Примеси (количественное содержание).
- •7. Предел обнаружения
- •8. Предел количественного определения
- •8.3. Использование калибровочной прямой и стандартного отклонения сигнала
- •9. Робастность
- •10. Проверка пригодности хроматографической системы
- •3. Неинструментальные испытания на чистоту и предельное содержание примесей
- •5. Разделительные методы
- •6.1. Метод добавок
- •6.2. Сравнение с арбитражным методом
- •5.4. Остаточные количества органических растворителей
- •5.4.1. Введение
- •5.4.2. Область применения
- •5.4.3. Общие положения
- •5.4.4. Предельные содержания остаточных растворителей
- •5.5. Алкоголеметрические таблицы
- •5.6. Отчет об исследовании интерферонов
- •3.3. Процедура исследования
- •3.3.1. Определение уровня доза-ответ
- •5.7. Таблица физических упоминаемых в фармакопеи
- •Вероятность эмиссии
- •Энергия (мЭв)
- •Энергия (мЭв)
- •Вероят ность эмиссии (на
- •Энергия (мЭв)
- •Вероятность эмиссии
- •5.8. Биодоступность и биоэквивалентность генерических лекарственных средств
- •3. Регистрационная оценка взаимозаменяемых лекарственных
- •4. Исследования эквивалентности, необходимые для
- •4.2.1. Исследования биоэквивалентности/биодоступности (исследования на человеке)
- •4.2.2. Общие методические подходы к выполнению исследований биоэк- вивалентности/биодоступности
- •4.2.3. Исследования сравнительной кинетики растворения (исследования вне живого организма)
- •4.3. Отсутствие необходимости в исследованиях биоэквивалентности или биодоступности
- •5. Дизайн и проведение исследований биологической эквивалентности и биодоступности на людях 5.1. Общие требования.
- •5.2. Испытуемые
- •6. Регламент фармакокинетического исследования
- •7. Аналитический метод
- •8. Анализ фармакокинетических данных
- •8.1. Параметры, подлежащие оценке
- •8.1.1. Однократное введение лекарственного средства
- •8.1.2. Многократное введение лекарственного средства
- •9. Исключение резко выделяющихся наблюдений
- •12. Фармакодинамические исследования
- •13. Клинические испытания
- •14. Тест сравнительной кинетики растворения in vitro
- •15. Клинически значимые колебания биодоступности, обуславливающие отказ в регистрации лекарственного средства
- •Лабораторных животных
- •Участие в испытаниях биоэквивалентности/биодоступности
- •Номограмма для определения достаточного числа добровольцев по результатам проведенного исследования.
- •Хорошо растворимые лекарственные средства
- •Средства с высокой степенью абсорбции
- •Перечень терапевтических (лечебных) доз средств на основе лекарственного растительного сырья
- •Основная литература
- •6. Общие статьи на лекарственные формы и субстанции
3.3. Модель угловых коэффициентов
3.3.1 ВВЕДЕНИЕ
Данная модель может применяться, например, для некоторых микробиологических количественных определений, в которых независимая переменная представляет собой концентрацию эссенциального фактора роста для микроорганизмов в среде ниже оптимальной для роста концентрации. На Рисунке 3.3.1.-1. показана модель угловых коэффициентов.
Испытуемый
препарат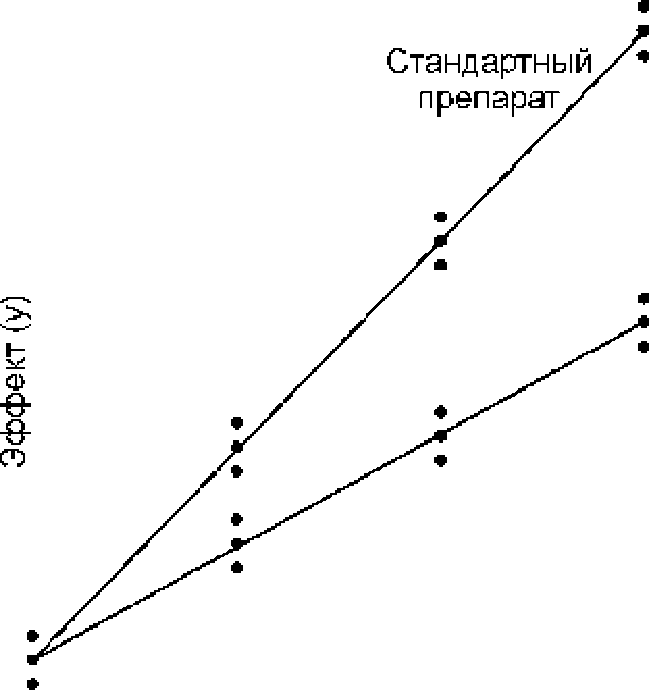
Рисунок 3.3.1.-1. Модель угловых коэффициентов для количественного определения 2x3+1. Оценка предполагаемой активности испытуемого препарата завышена по отношению к истинной.
По горизонтальной оси абсцисс откладываются значения доз, начало оси координат соответствует нулевой дозе; значения доз возрастают слева направо. По вертикальной оси ординат откладываются полученные эффекты. Индивидуальный результат каждого исследования показан в виде черной точки. Две линии представляют собой зависимости доза - эффект, рассчитанные для стандартного и испытуемого препаратов, исходя из предположения, что они пересекаются друг с другом в точке, соответствующей нулевой дозе. В отличие от модели параллельных линий, значения доз не представляются в виде логарифмов.
Так же, как и в случае количественных определений, основанных на модели параллельных линий, важно, чтобы предполагаемая активность была как можно ближе к истинной и, если возможно, желательно приготовить разведения испытуемого и стандартного препаратов с одинаковыми активностями. Чем точнее будет предполагаемая активность, тем ближе линии будут располагаться одна к одной. Отношение угловых коэффициентов представляет собой отношение «истинного» значения активности испытуемого препарата к его предполагаемой активности. Если угол наклона линии испытуемого препарата больше угла наклона линии стандартного препарата, это означает, что активность была занижена и при расчетах оцененная активность будет выше предполагаемой активности. Аналогично, если угол наклона линии испытуемого препарата меньше угла наклона линии стандартного препарата, то активность была завышена, и расчеты покажут, что оцененная активность будет ниже предполагаемой.
В ходе эксперимента, все результаты следует проверить на выполнение условий 1, 2 и 3, приведенных в Разделе 3.1. Процедура проведения дисперсионного анализа описана в Разделе 3.3.3, таким образом, он предполагает возможность проверки выполнения условий 4В и 5В, приведенных в Разделе 3.1.
3.3.2 ПЛАН КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ
Использование методов статистического анализа, приведенных в данном разделе, накладывает на количественные определения следующие ограничения:
как стандартный, так и испытуемый препараты должны анализироваться при одинаковом числе равновеликих разведений;
возможно наличие дополнительной группы экспериментальных объектов, которым не вводят препарат (плацебо группа);
во всех группах должно быть одинаковое число экспериментальных объектов.
Как уже было отмечено в Разделе 3.1.3, планы количественных определений, которые не отвечают требованиям этих ограничений, могут быть также корректными и обоснованными. Однако, описанные здесь простые методы статистического анализа, в данном случае неприменимы, и следует либо обратиться за помощью к специалисту, либо использовать соответствующее программное обеспечение.
Обычно предпочтительным является использование плана исследования с двумя дозами каждого препарата и одной плацебо группой. Так называемая «(2h+1) точечная схема с общей нулевой точкой», которая обеспечивает очень высокую точность наряду с возможностью проверки достоверности ограничений, упомянутых выше. Однако, не всегда может допускаться линейность зависимостей вплоть до нулевой дозы. Если допускается небольшая потеря точности, можно использовать план, который не предполагает проведение плацебо исследования. В этом случае предпочтительно использовать по три дозы каждого препарата, «(3h) точечная схема с общей нулевой точкой». Эти дозы назначаются следующим образом:
стандартный препарат вводится в максимальной дозе, которая должна быть близка к наивысшей дозе, воспроизводящей средний эффект на линейном отрезке зависимости «доза - эффект», но не превышать ее;
Две другие дозы равномерно распределяются в промежутке между максимальной и нулевой дозами;
Испытуемый препарат вводится в соответствующих дозах, определенных исходя из предполагаемой активности вещества.
Возможно использование схем полной рандомизации, рандомизированных блоков или латинских квадратов, описанные в Разделе 3.2.2. Так же, как и для модели параллельных линий, использование любой из этих схем требует корректировки ошибки суммы квадратов. Ниже описана схема анализа в случае, если со стандартным препаратом сравнивается один или несколько испытуемых препаратов.
3.3.3 ДИСПЕРСИОННЫЙ АНАЛИЗ
3.3.3.1 (ЛсС+1)-схема
Результаты проверяют согласно требованиям, описанным в Разделе 3.1 и, если необходимо, проводят их преобразование. Затем для каждого эксперимента и каждого препарата вычисляют среднее значение, как описано в Таблице 3.3.3.1 -i. Дополнительно рассчитывают среднее значение для плацебо исследований (В).
В Таблицах 3.3.3.1.-1 - 3.3.3.1.-3 приведен расчет суммы квадратов для дисперсионного анализа. Сумма квадратов, обусловленная нелинейностью, может быть рассчитана только в том случае, если в план количественного определения было включено, по крайней мере, по три дозы каждого из препаратов. Неисключенную (остаточную) погрешность находят путем вычитания вариации, предусмотренной планом эксперимента, из общей вариации для результата исследования (Таблица 3.3.3.1.-iv).
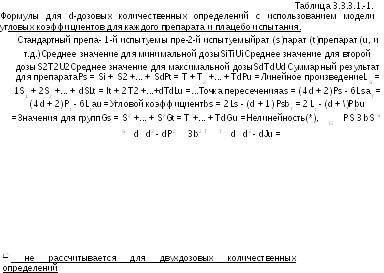
Далее дисперсионный анализ завершают следующим образом: каждую сумму квадратов отклонений делят на соответствующее число степеней свободы для вычисления дисперсии (среднего квадрата отклонений). Затем оценивают значимость отношения дисперсии (среднего квадрата отклонений) для каждой переменной к неисклю-ченной (остаточной) погрешности (s2) (F-отношение). Для этого можно воспользоваться Таблицей 8.1 или соответствующей подпрограммой компьютерного программного обеспечения.
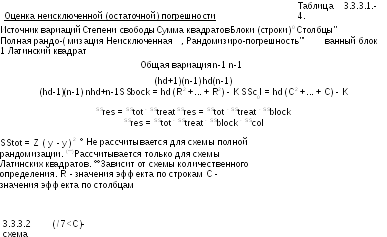
Таблица 3.3.3.1.-2. Дополнительные формулы для проведения дисперсионного анализа
nhd2 - nhd
hd2 - hd + 4d + 2
Hi =
n
4d3 - 2d2 - 2d
a
as + ат +... h(d2 - d)
K
hd +1

 Для
этой схемы используются, в основном,
те же самые формулы, что и для (hd+1)-схемы,
за исключением некоторых небольших
различий: - переменная В
исключается
из всех формул.
Для
этой схемы используются, в основном,
те же самые формулы, что и для (hd+1)-схемы,
за исключением некоторых небольших
различий: - переменная В
исключается
из всех формул.
„ n(PS + Pt + ...)2
Значение К рассчитывается как K = —hd
SSblank исключается из дисперсионного анализа.
Число степеней свободы для вариаций, обусловленных группами равно hd-1.
Число степеней свободы для неисключенной (остаточной) погрешности и общей вариации рассчитывают, как описано для модели параллельных линий (см. Таблицу 3.2.3.-IV).
Обоснованность (достоверность) количественного определения, активность и границы доверительного интервала определяют, как описано в Разделах 3.3.4 и 3.3.5.
3.3.4 ИССЛЕДОВАНИЯ ДОСТОВЕРНОСТИ
Результаты количественного определения считаются «статистически значимыми», если результаты, полученные при дисперсионном анализе, удовлетворяют следующим условиям:
Вариация, обусловленная плацебо в (г^+1)-схеме, не является статистически зна-
чимой, т.е. рассчитанная вероятность >0.05. Это означает, что результаты, полученные при плацебо исследовании, не существенно отличаются от общей точки пересечения и линейная зависимость сохраняется вплоть до нулевой дозы.
Вариация, связанная с точкой пересечения, не является значимой, т.е. рассчитанная
вероятность >0.05. Это означает, что выполняется условие 5В, Раздел 3.1.
В количественном определении, которое включает, по крайней мере, по три дозы для каждого из препаратов, вариация, обусловленная нелинейностью, не является значимой, т.е. рассчитанная вероятность >0.05. Это означает, что выполняется условие 4В, Раздел 3.1.
Статистически значимая вариация, обусловленная проведением плацебо исследования, свидетельствует о том, что предположение о линейности не подтверждается для диапазона доз возле нулевой точки. Если это отклонение носит скорее систематический, чем случайный характер, наиболее подходящей является ^)-схема. При этом любые результаты, связанные с плацебо исследованиями, должны быть исключены.
Если все выполненные исследования свидетельствуют о достоверности (обоснованности) количественного определения, активность и границы доверительного интервала рассчитываются, как описано в Разделе 3.3.5.
3.3.5 ОЦЕНКА АКТИВНОСТИ И ГРАНИЦ ДОВЕРИТЕЛЬНОГО ИНТЕРВАЛА 3.3.5.1 (ЛС+1)-схема
Общая точка пересечения а' для препаратов может быть вычислена по форму-
ле:
a =(2d +1)B +(2d - 3)ha (335 1 -1)
h(2d -3)+2d +i
bs
=
6LS-
3Щ°;1)a
(3.3.5.1.-2)
6LS - 3d(d + 1)a1
2d3 + 3d2 + d
Отношение активностей для каждого из препаратов, теперь может быть рассчитано следующим образом:
RT = (3.3.5.1.-3) bs
Для определения рассчитанной активности RT, полученное значение нужно умножить на предполагаемую активность АТ испытуемого препарата. Если интервал между дозами стандартного и испытуемого препаратов не был одинаковым, активность следует умножить на величину Is/IT. Обратите внимание, что в отличие от модели параллельных линий, антилогарифмы при этом не вычисляются.
Доверительный интервал для переменной Rt вычисляется по формуле: CRT - K ± (C -1 )(CRT +1) + K'(K'-2CRT ) (3.3.5.1.-4)
где:
bS - s2t2V1 K = (C-1)V2
V1 и V2 связаны с дисперсией и ковариацией числителя и знаменателя Rt . Их рассчитывают по формулам:
(3.3.5.1.-5)
1 n(2d +1) [ d(d +1) + 2(2d +1) + hd(d -1),
V2
= 3d(d
+1)
(3.3.5.1.-6)
2 (3d +1)(d +2)+hd(d -1)
Доверительный интервал умножается на величину АТ и, если необходимо, на величину IS/IT.
