
- •Государственная фармакопея республики беларусь первое издание
- •Республики Беларусь
- •1. Общие сведения
- •1.1. Общие положения
- •1.2. Другие положения, распространяющиеся на общие и частные фармакопейные статьи
- •Условия хранения лекарственного средства
- •Пределы, указываемые на упаковке
- •1.5. Сокращения и обозначения
- •1.6. Единицы международной системы (си), используемые в фармакопейных статьях, и их соответствие другим единицам
- •2. Методы анализа
- •2.1. Оборудование
- •2.1.1. Каплемер
- •2.1.2. Сравнительная таблица пористости стеклянных фильтров
- •Пористость фильтра (ф.Евр.) (1)
- •Максимальный диаметр пор в микрометрах
- •2.1.3. Лампы с ультрафиолетовым излучением для аналитических целей
- •2.1.4. Сита
- •2.2. Физические и физико-химические методы
- •2.2.1. Определение прозрачности и степени мутности жидкостей
- •2.2.2. Определение степени окрашивания жидкостей
- •2.2.3. Потенциометрическое определение рН
- •2.2.4. Зависимость между реакцией раствора, приблизительным значением рН и цветом индикаторов
- •Изменение цвета
- •2.2.5. Относительная плотность
- •2.2.6. Показатель преломления (индекс рефракции)
- •2.2.7. Оптическое вращение
- •2.2.8. Вязкость
- •1/Прив 1
- •2.2.9. Метод капиллярной вискозиметрии
- •2.2.10. Метод ротационной вискозиметрии
- •2.2.11. Температурные пределы перегонки
- •2.2.14. Температура плавления - капиллярный метод
- •2.2.17. Температура каплепадения
- •2.2.18. Температура затвердевания
- •2.2.21. Флуориметрия
- •2.2.22. Атомно-эмиссионная спектрометрия
- •2.2.23. Атомно-абсорбционная спектрометрия
- •2.2.24. Абсорбционная спектрофотометрия в инфракрасной
- •2.2.25. Абсорбционная спектрофотометрия в ультрафиолетовой видимой областях
- •2. Многокомпонентный спектрофотометрический анализ.
- •2.2.26. Бумажная хроматография
- •2.2.27. Тонкослойная хроматография
- •2.2.28. Газовая хроматография
- •2.2.29. Жидкостная хроматография
- •2.2.30. Эксклюзионная хроматография
- •2.2.31. Электрофорез
- •2.2.32. Потеря в массе при высушивании
- •2.2.33. Спектрометрия ядерного магнитного резонанса
- •2.2.34. Термогравиметрия
- •2.2.35. Осмоляльность
- •2.2.36. Потенциометрическое определение концентрации ионов с использованием ионселективных электродов
- •2.2.37. Рентгенофлуоресцентная спектрометрия
- •2.2.38. Удельная электропроводность
- •2.2.39. Молекулярно-массовое распределение декстранов
- •2.2.40. Спектрофотометрия ближнего ик-диапазона
- •2.2.41. Круговой дихроизм
- •2.2.42. Плотность твердых тел
- •2.2.43. Масс-спектрометрия
- •2.2.44. Определение содержания общего органического углерода в воде для фармацевтического применения
- •2.2.45. Сверхкритическая флюидная хроматография
- •2.2.46. Хроматографические методы разделения
- •2.2.47. Капиллярный электрофорез
- •2.2.48. Рамановская спектрометрия (# спектрометрия комбинационного рассеяния)
- •2.2.54. Изоэлектрическое фокусирование
- •2.3.1. Реакции подлинности (идентификации) на ионы и функциональные группы
- •2.3.2. Идентификация жирных масел методом тонкослойной хроматографии
- •2.3.3. Идентификация фенотиазинов методом тонкослойной хроматографии
- •2.3.4. Определение запаха
- •2.4. Испытания на предельное содержание примесей
- •2.4.1. Аммония соли
- •2.4.2. Мышьяк
- •2.4.3. Кальций
- •2.4.6. Магний
- •2.4.7. Магний и щелочноземельные металлы
- •2.4.8. Тяжелые металлы
- •2.4.15. Никель в полиолах
- •2.4.1.6. Общая зола
- •2.4.21. Посторонние масла в жирных маслах методом тонкослойной хроматографии
- •2.4.22. Посторонние жирные кислоты в маслах методом газовой хроматографии
- •2.4.23. Стерины в жирных маслах
- •2.4.24. Идентификация остаточных растворителей и их количественное определение
- •2.4.25. Остаточные количества этиленоксида и диоксана
- •2.4.27. Никель в гидрогенизированных растительных маслах
- •2.5. Методы количественного определения 2.5.1. Кислотное число
- •2.5.3. Гидроксильное число
- •2.5.4. Йодное число
- •2.5.5. Перекисное (пероксидное) число
- •2.5.6. Число омыления
- •2.5.7. Неомыляемые вещества
- •2.5.8. Определение аминного азота в соединениях, которые содержат первичную ароматическую аминогруппу
- •2.5.9. Определение азота после минерализации серной кислотой
- •2.5.10. Метод сжигания в колбе с кислородом
- •2.5.11. Комплексометрическое титрование
- •2.5.12. Вода: полумикрометод (#Метод к.Фишера)
- •2.5.13. Алюминий в адсорбированных вакцинах
- •2.5.14. Кальций в адсорбированных вакцинах
- •2.5.20. Гексозамины в полисахаридных вакцинах
- •2.5.21. Метилпентозы в полисахаридных вакцинах
- •2.5.24. Диоксид углерода в газах
- •2.5.25. Оксид углерода в газах
- •2.5.26. Оксид азота и диоксид азота в газах
- •2.5.27. Кислород в газах
- •2.5.30. Окисляющие вещества
- •2.5.33. Общий белок
- •2.5.34. Уксусная кислота в синтетических пептидах
- •2.6. Биологические испытания
- •2.6.1. Стерильность
- •2.6.2. Микобактерии
- •2.6.3. Испытания на посторонние вирусы с использованием куриных эмбрионов
- •2.6.4. Испытание на вирусы лейкоза
- •2.6.5. Испытание на посторонние вирусы с использованием клеточных культур
- •2.6.6. Испытание на посторонние агенты с использованием цыплят.
- •2.6.7. Микоплазмы
- •2.6.8 Пирогенность
- •2.6.9. Аномальная токсичность
- •2.6.10. Гистамин
- •2.6.11. Депрессорные вещества
- •2.6.12. Микробиологические испытания нестерильной продукции (суммарное количество жизнеспособных аэробов)
- •2.6.13. Микробилогические испытания нестерильной продукции (испытания на наличие специфических микроорганизмов)
- •0,9 % Раствор натрия хлорида
- •1 % Раствор фенолового красного
- •0,5 % Раствор малахитового зеленого
- •2.6.14. Бактериальные эндотоксины
- •1. Предварительные испытания
- •2. Предельное испытание (метод а) (I) Методика
- •2. Полуколичественное испытание (метод в)
- •1. Турбидиметрический принцип (методы с и f)
- •2.6.15. Активатор прекалликреина
- •2.6.16. Испытания на посторонние агенты в вирусных вакцинах для медицинского применения
- •2.6.17. Испытание на антикомплементарную активность иммуноглобулина
- •2.6.18. Испытание живых вирусных вакцин на нейровирулентность
- •2.6.19. Испытание пероральной вакцины полиомиелита на нейровирулентность
- •5.1. Предотвращение загрязнения
- •5.4 Детектирование
- •7.1 Валидация системы для количественного определения методом
- •7.2. Контроль качества реагентов.
- •7.3. Контроль хода испытания.
- •7.4. Внешняя оценка качества
- •2.6.22. Активированные факторы свертывания крови
- •2.7 Биологические методы количественного определения
- •2.7.1. Иммунохимические методы
- •2.7.2. Количественное определение антибиотиков микробиологическим методом
- •2.7.3. Количественное определение кортикотропина
- •2.7.4. Количественное определение фактора свертывания крови VIII
- •2.7.5. Количественное определение гепарина
- •2.7.6. Количественное определение вакцины дифтерии (адсорбированной)
- •2.7.7. Количественное определение вакцины коклюша
- •2.7.8. Количественное определение вакцины столбняка (адсорбированной)
- •2.7.9. Определение функционального состояния Fc-фрагмента иммуноглобулина
- •2.7.10. Количественное определение фактора свертывания крови человека VII
- •2.7.11. Количественное определение фактора свертывания крови человека IX
- •2.7.12. Количественное определение гепарина в концентратах
- •2.7.13. Количественное определение человеческого анти-d-иммуноглобулина
- •2.7.14. Количественное определение антигенной (иммуногенной) активности вакцины гепатита а
- •2.7.15. Количественное определение вакцины гепатита в (rdna)
- •2.7.16. Количественное определение вакцины коклюша (бесклеточной)
- •2.7.17. Количественное определение антитромбина III человека
- •2.7.18. Количественное определение фактора свертывания крови II
- •2.7.19. Количественное определение фактора свертывания крови х
- •2.7.20. Количественное определение инактивированной вакцины полиомиелита in vivo
- •2.7.22. Количественное определение фактора свертывания крови человека XI
- •2.8. Методы анализа лекарственного растительного сырья и лекарственных средств из него
- •2.8.1. Зола, нерастворимая в хлористоводородной кислоте
- •2.8.4. Коэффициент набухания
- •2.8.5. Определение воды в эфирных маслах
- •2.8.10. Растворимость эфирных масел в спирте
- •2.8.11. Определение 1,8-цинеола в эфирных маслах
- •2.8.12. Определение эфирного масла
- •2.8.13. Остаточное количество пестицидов
- •1. Экстракция
- •2. Очистка
- •3. Количественный анализ
- •Относительные времена удерживания инсектицидов
- •2.8.15. Определение показателя горечи
- •2.8.16. Сухой остаток экстрактов
- •2.8.17. Потеря в массе при высушивании экстракта
- •2.9. Фармацевтико-технологические испытания
- •2.9.1. Распадаемость таблеток и капсул
- •2.9.2. Распадаемость суппозиториев и пессариев
- •2.9.3. Тест «растворение» для твердых дозированных форм
- •2.9.4. Тест «растворение» для трансдермальных пластырей
- •2.9.5. Однородность массы для единицы дозированного лекарственного средства
- •2.9.6. Однородность содержания действующего вещества в
- •2.9.7. Прочность таблеток без оболочки на истирание
- •2.9.8. Прочность таблеток на сжатие
- •2.9.9. Измерение консистенции методом пенетрометрии
- •2.9.10 Содержание этанола
- •2.9.11. Испытание на содержание метанола и 2-пропанола
- •2.9.12. Ситовой анализ
- •2.9.15. Насыпной объем
- •2.9.16. Сыпучесть
- •2.9.17. Определение извлекаемого объема парентеральных лекарственных средств
- •Масса действующего вещества высвобожденного при опорожнении
- •Фракция действующего вещества (%)
- •2.9.19. Загрязнение механическими включениями: невидимые частицы.
- •2.9.20. Загрязнение механическими включениями: видимые частицы
- •2.9.21. Загрязнение механическими включениями: метод микроскопии
- •2.9.22. Опредление времени деформации липофильных суппозиториев
- •2.9.23. Определение плотности твердых частиц при помощи пикнометра
- •2.9.24. Устойчивость суппозиториев и пессариев к разрушению
- •2.9.26. Опредедение удельной площади поверхности методом газовой адсорбции
- •III.1.3. Количество образца
- •III.2.1. Метод 1: метод динамического потока
- •III.2.2. Метод 2: метод объёмного анализа
- •2.9.27. Однородность массы одной дозы высвобожденной из многодозового контейнера
- •2.9.28. Определение массы или объема содержимого контейнера для жидких и мягких лекарственных средств
- •3.1. Материалы, используемые для производства контейнеров
- •3.1.1. Материалы, используемые для производства контейнеров для человеческой крови и компонентов
- •3.1.1.1. Материалы на основе пластифицированного поливинилхлорида, используемые для производства
- •3.1.1.2. Материалы на основе пластифицированного поливинилхлорида для трубок, используемых в комплектах для переливания крови и компонентов крови
- •3.1.3. Полиолефины
- •3.1.4. Полиэтилен без добавок для контейнеров для парентеральных и офтальмологических лекарственных средств
- •3.1.5. Полиэтилен с добавками для контейнеров для
- •3.1.6. Полипропилен для контейнеров и укупорочных материалов для парентеральных и офтальмологических лекарственных средств
- •3.1.7. Полиэтиленвинилацетат для контейнеров и трубок для лекарственных средств для парентерального питания
- •3.1.8. Силиконовое масло, используемое в качестве смазывающей добавки
- •3.1.9. Силиконовые эластомеры для укупорочных
- •3.1.10. Материалы на основе непластифицированного поливинилхлорида для контейнеров для неинъекционных водных растворов
- •3.1.11. Материалы на основе непластифицированного поливинилхлорида для контейнеров для твердых лекарственных форм для перорального применения
- •3.1.13. Добавки к пластмассе
- •3.1.14. Материалы на основе пластифицированного поливинилхлорида для контейнеров для водных растворов для внутривенного применения
- •3.1.15. Полиэтилентерефталат для контейнеров для лекарственных средств для непарентерального применения
- •3.2. Контейнеры
- •3.2.1. Стеклянные контейнеры для фармацевтического использования
- •3.2.2. Пластмассовые контейнеры и укупорочные средства для фармацевтического использования
- •3.2.2.1. Пластмассовые контейнеры для водных растворов для парентерального применения
- •3.2.3. Стерильные пластмассовые контейнеры для человеческой крови и ее компонентов
- •3.2.4. Пустые стерильные контейнеры из пластифицированного поливинилхлорида для человеческой крови и ее компонентов
- •3.2.5. Стерильные контейнеры из пластифицированного поливинилхлорида для человеческой крови, содержащие раствор антикоагулянта
- •3.2.6. Комплекты для переливания крови и компонентов крови
- •3.2.8. Стерильные одноразовые пластмассовые шприцы
- •3.2.9. Резиновые укупорочные средства для контейнеров, предназначенных для водных лекарственных средств для парентерального применения, порошков и лиофилизированных порошков
- •4. Реактивы
- •4.1. Реактивы, эталонные растворы, буферные растворы
- •4.1.1. Реактивы
- •4.1.2. Эталонные растворы для испытаний на предельное содержание примесей
- •0,1 М фосфатный буферный раствор рН 8,0. 4008400.
- •4.2. Реактивы, титрованные растворы для объемного нализа
- •1 М щелочной раствор меди-этилендиамина. 3008700
- •5.1 Общие тексты по стерилизации
- •5.1.1. Методы приготовления стерильных продуктов
- •5.1.2. Биологические индикаторы стерилизации
- •5.1.3. Эффективность антимикробных консервантов
- •24 Часа
- •5.1.4. Микробиологическая чистота лекарственных средств
- •5.1.5 .Применение f0 концепции при стерилизации паром водных растворов.
- •5.2. Общая информация о вакцинах
- •5.2.1. Общепринятая терминология
- •5.2.2. Стаи кур, не имеющих конкретных патогенов и используемые для производства вакцин и контроля их качества
- •5.2.3. Субстраты клеток для производства вакцин, используемых людьми
- •5.2.6. Оценка безопасности вакцин
- •5.2.7. Оценка эффективности вакцин
- •5.2.8. Снижение риска передачи возбудителей губчатой энцефалопатии через лекарственные средства
- •1. Общие замечания
- •2. Область применения общей главы
- •3.1. Животные как источник материала
- •3.2. Части тел животных, жидкости и выделения в качестве исходных материалов
- •3.3. Проверка процесса
- •5.3. Статистические методы обработки результатов анализа
- •5.3.1. Статистический анализ результатов биологических исследований и количественных определений
- •1.1. Общие положения и точность
- •2. Рандомизация и независимость конкретных исследований
- •3. Количественные определения, основанные на количественных эффектах
- •3.1. Статистические модели
- •3.2. Модель параллельных линий
- •3.2.2.1 Схема полной рандомизации
- •3.2.2.2 Схема рандомизированных блоков
- •3.3. Модель угловых коэффициентов
- •3.3.5.2 (/7С/)-схема
- •4. Тесты с альтернативным типом эффекта 4.1. Введение
- •4.2. Метод пробит-анализа
- •5.1. Модель параллельных линий.
- •5.2. Модель угловых коэффициентов
- •5.3. Альтернативные эффекты
- •6 Объединение результатов количественного определения 6.1. Введение
- •6.2. Взвешенное объединение результатов количественного определения
- •6.3. Невзвешенное объединение результатов количественного опре- деления
- •6.4. Пример определения взешенной средней активности с доверительн1м интервалом
- •7. Дополнение
- •7.1. Общие линейные модели
- •7.4. Ошибки корреляции
- •8. Таблицы и процедуры генерирования
- •8.5. Случайные размещения
- •8.6. Латинские квадраты
- •9. Принятые обозначения
- •1. Выборка
- •1.1. Среднее зна чение и дисперсия
- •1.3. Доверительные интервалы и оценка их величины.
- •1.4. Односторонние и двусторонние доверительные интервалы.
- •2. Метрологические характеристики методики анализа
- •2.1.1. Объединенная дисперсия и объединенное среднее
- •2.1.2. Критерий Бартлетта.
- •2.1.3. Критерий Кохрейна.
- •2.2. Проверка наличия значимой систематической погрешности.
- •3. Сравнение двух методик анализа по воспроизводимости
- •4. Метрологическая характеристика среднего результата.
- •5. Сравнение средних результатов двух выборок
- •5.3. Известно точное значение величины а.
- •6. Интерпретация результатов анализа, полученных с помощью метрологически аттестованной методики.
- •6.1. Оценка сходимости результатов параллельных определений.
- •6.2. Определение необходимого числа параллельных определений.
- •6.3. Гарантия качества продукции.
- •7. Расчет и статистическая оценка параметров линейной зависимости
- •8. Последовательная схема статистического анализа результатов химических измерений
- •9. Примеры
- •9.1 Вычисление среднего значения и дисперсии.
- •9.2 Проверка однородности выборки малого объема
- •9.3. Вычисление доверительных интервалов и неопределенностей измерений.
- •9.4. Проверка гипотезы равенства дисперсий.
- •9.4.1. Объединение результатов выборок разного объема.
- •9.4.2. Объединение результатов выборок одинакового объема.
- •9.5. Сравнение двух методик анализа по воспроизводимости.
- •9.6. Сравнение средних результатов двух выборок.
- •9.7. Оценка качества продукции.
- •9.8. Контроль содержания салициловой кислоты в салициловом спирте посредством секвенционального анализа.
- •10. Расчет неопределенности функции нескольких случайных переменных
- •10.1. Линейная модель
- •10.1.1. Взвешенное среднее
- •10.2. Подход Уэлча-Сатертуэйта
- •10.3. Примеры расчетов неопределенности функции нескольких переменных
- •10.3.1. Расчет неопределенности вэжх-анализа готового лекарственного средства
- •10.3.1.1. Конечная аналитическая операция
- •10.3.1.2. Суммарная неопределенность пробоподготовки asp,r.
- •10.3.1.3. Расчет суммарной неопределенности анализа aAs,r
- •10.3.2. Прогноз неопределенности спектрофотометрического анализа готового лекарственного средства
- •10.3.3. Расчет среднего значения нескольких неравноточных выборок
- •1. Введение
- •2. Аналитические испытания и методики, подлежащие валидации
- •3. Валидационные характеристики и требования
- •4. Словарь
- •2. Специфичность
- •5. Правильность
- •5.1. Количественное определение
- •5.2. Примеси (количественное содержание).
- •7. Предел обнаружения
- •8. Предел количественного определения
- •8.3. Использование калибровочной прямой и стандартного отклонения сигнала
- •9. Робастность
- •10. Проверка пригодности хроматографической системы
- •3. Неинструментальные испытания на чистоту и предельное содержание примесей
- •5. Разделительные методы
- •6.1. Метод добавок
- •6.2. Сравнение с арбитражным методом
- •5.4. Остаточные количества органических растворителей
- •5.4.1. Введение
- •5.4.2. Область применения
- •5.4.3. Общие положения
- •5.4.4. Предельные содержания остаточных растворителей
- •5.5. Алкоголеметрические таблицы
- •5.6. Отчет об исследовании интерферонов
- •3.3. Процедура исследования
- •3.3.1. Определение уровня доза-ответ
- •5.7. Таблица физических упоминаемых в фармакопеи
- •Вероятность эмиссии
- •Энергия (мЭв)
- •Энергия (мЭв)
- •Вероят ность эмиссии (на
- •Энергия (мЭв)
- •Вероятность эмиссии
- •5.8. Биодоступность и биоэквивалентность генерических лекарственных средств
- •3. Регистрационная оценка взаимозаменяемых лекарственных
- •4. Исследования эквивалентности, необходимые для
- •4.2.1. Исследования биоэквивалентности/биодоступности (исследования на человеке)
- •4.2.2. Общие методические подходы к выполнению исследований биоэк- вивалентности/биодоступности
- •4.2.3. Исследования сравнительной кинетики растворения (исследования вне живого организма)
- •4.3. Отсутствие необходимости в исследованиях биоэквивалентности или биодоступности
- •5. Дизайн и проведение исследований биологической эквивалентности и биодоступности на людях 5.1. Общие требования.
- •5.2. Испытуемые
- •6. Регламент фармакокинетического исследования
- •7. Аналитический метод
- •8. Анализ фармакокинетических данных
- •8.1. Параметры, подлежащие оценке
- •8.1.1. Однократное введение лекарственного средства
- •8.1.2. Многократное введение лекарственного средства
- •9. Исключение резко выделяющихся наблюдений
- •12. Фармакодинамические исследования
- •13. Клинические испытания
- •14. Тест сравнительной кинетики растворения in vitro
- •15. Клинически значимые колебания биодоступности, обуславливающие отказ в регистрации лекарственного средства
- •Лабораторных животных
- •Участие в испытаниях биоэквивалентности/биодоступности
- •Номограмма для определения достаточного числа добровольцев по результатам проведенного исследования.
- •Хорошо растворимые лекарственные средства
- •Средства с высокой степенью абсорбции
- •Перечень терапевтических (лечебных) доз средств на основе лекарственного растительного сырья
- •Основная литература
- •6. Общие статьи на лекарственные формы и субстанции
1. Турбидиметрический принцип (методы с и f)
Данный принцип представляет собой фотометрическое испытание, основанное на измерении увеличения степени мутности. В зависимости от используемого подхода, с использованием данного метода могут быть проведены турбидиметрическое испытание методом конечной точки и кинетическое турбидиметрическое испытание.
Турбидиметрический метод конечной точки (метод F) основан на количественном соотношении между концентрацией эндотоксина и степенью мутности (выражающейся в пропускании или поглощении света) реакционной смеси в конце инкубационного периода.
Кинетическое турбидиметрическое испытание (метод С) заключается либо в измерении времени, требующегося для достижения заданного значения поглощения в реакционной смеси, либо в определении скорости увеличения степени мутности.
Испытание проводят при температуре инкубации, рекомендованной производителем лизата (обычно 37±10).
ХРОМОГЕННЫЙ ПРИНЦИП (МЕТОДЫ D и E)
Данный принцип основан на измерении количества хромофора, высвобождаемого из соответствующего хромогенного пептида в результате реакции эндотоксинов с лизатом. В зависимости от используемого подхода, с использованием данного метода могут быть проведены хромогенное испытание методом конечной точки и кинетическое хромогенное испытание.
Хромогенный метод конечной точки (метод Е) основан на количественном соотношении между концентрацией эндотоксина и количеством хромофора, высвобождаемого к концу инкубационного периода.
Кинетическое хромогенное испытание (метод D) заключается либо в измерении времени, требующегося для достижения заданного значения поглощения в реакционной смеси, либо в определении скорости появления окраски.
Испытание проводят при температуре инкубации, рекомендованной производителем лизата (обычно 37±10).
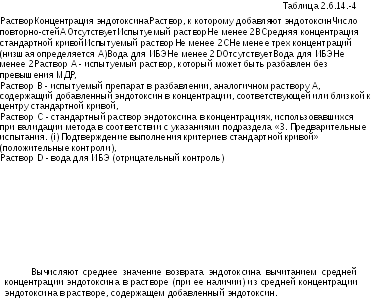
ПРЕДВАРИТЕЛЬНЫЕ ИСПЫТАНИЯ
Предварительные испытания проводят для обеспечения точности и достоверности результатов турбидиметрических и хромогенных испытаний. В ходе предварительных испытаний подтверждают выполнение критериев стандартной кривой и отсутствие мешающего влияния испытуемого раствора на результаты испытания.
При внесении любых изменений в экспериментальные условия, которые могут повлиять на результаты, требуется подтверждение пригодности метода испытания.
(i) Подтверждение выполнения критериев стандартной кривой
Для получения стандартной кривой готовят не менее трех концентраций эндотоксина с использованием стандартного раствора эндотоксина. Проводят испытание с каждым стандартным раствором эндотоксина не менее трех раз в соответствии с рекомендациями производителя лизата (объемные отношения, время инкубации, температура, рН и т.д.).
Если при использовании кинетических методов желаемый интервал в логарифмической шкале превышает 2, в испытание должны быть включены дополнительные стандарты для включения каждого увеличенного логарифмического значения в диапазон стандартной кривой.
В диапазоне концентраций эндотоксина, указанном производителем лизата, абсолютное значение коэффициента корреляции, | r |, должно превышать или быть равным 0,980.
(ii) Определение мешающих факторов
 Выбирают
концентрацию эндотоксина в центре или
недалеко от центра стандартной кривой.
Готовят растворы
A, B, C
и
D
в соответствии с Таблицей 2.6.14.-4. Проводят
испытание с каждым из этих растворов
не менее, чем в двух повторностях в
соответствии с рекомендациями
производителя лизата (объем испытуемого
раствора и раствора лизата, объемное
соотношение испытуемого раствора
и раствора лизата, время инкубации и
т.д.).
Выбирают
концентрацию эндотоксина в центре или
недалеко от центра стандартной кривой.
Готовят растворы
A, B, C
и
D
в соответствии с Таблицей 2.6.14.-4. Проводят
испытание с каждым из этих растворов
не менее, чем в двух повторностях в
соответствии с рекомендациями
производителя лизата (объем испытуемого
раствора и раствора лизата, объемное
соотношение испытуемого раствора
и раствора лизата, время инкубации и
т.д.).
Считают, что испытуемый раствор не содержит мешающих факторов, если в условиях испытания вычисленная концентрация эндотоксина, добавленного к испытуемому раствору, находится в пределах 50-200% от известной концентрации добавленного эндотоксина, после вычитания концентрации эндотоксина, обнаруженной в растворе, не содержащем добавок стандарта.
Если возврат эндотоксина не попадает в указанные пределы, следует провести операцию исключения мешающих факторов в соответствии с указаниями, приведенными при описании принципа гелевого сгустка, подраздел «1. Предварительные испытания. (ii) Определение мешающих факторов». Эффективность обработки подтверждают повторным проведением испытания на мешающие факторы.
ИСПЫТАНИЕ
Метод
Следуют указаниям, приведенным в подразделе «3. Предварительные испытания. (ii) Определение мешающих факторов».
Вычисления
Для раствора А в каждой повторности определяют концентрацию эндотоксина с использованием стандартной кривой, полученной из ряда положительных контролей, раствор С.
Результаты испытания считают достоверными при выполнении следующих трех условий:
(а) результат, полученный для раствора D (отрицательный контроль), не превышает предельное холостое значение, требуемое в описании используемого лизата,
(б) результаты, полученные для растворов С (положительные контроли) со- ответствуют требованиям валидации, приведенным в подразделе «1. Предвари- тельные испытания. (i) Подтверждение выполнения критериев стандартной кри- вой»,
(с) возврат эндотоксина, вычисленный из концентрации эндотоксина, определенной в растворе В, после вычитания концентрации эндотоксина, определенной в растворе А, находится в пределах 50-200%.
(iii) Интерпретация
Испытуемый препарат соответствует требованиям испытания, если средняя концентрация эндотоксина в повторностях раствора А, с учетом разведений и концентрации, менее предельного значения эндотоксина для препарата.
РЕАГЕНТЫ
Раствор лизата
Лизат амебоцитов растворяют путем осторожного перемешивания в воде для ИБЭ или в буфере, в соответствии с рекомендациями производителя лизата. Восстановленный лизат хранят в охлажденном или замороженном состоянии, в соответствии с указаниями производителя.
Лизат амебоцитов
Лизат амебоцитов - лиофилизированный продукт, полученный из амебо-цитного лизата мечехвоста (Limulus polyphemus или Tachypleus tridentatus). Этот реагент может производиться только в соответствии с предписаниями компетентных органов.
Лизат амебоцитов, кроме эндотоксинов, может реагировать и с некоторыми (3-гликанами. Имеются препараты лизата амебоцитов, не реагирующие с гликана-ми; они изготавливаются путем удаления из лизата амебоцитов G-фактора, реагирующего с гликанами, или ингибированием реакционной системы G-фактора в лизате амебоцитов. Эти препараты могут использоваться для определения эндотоксинов в присутствии гликанов.
(iii) Вода для ИБЭ (вода для испытания на бактериальные эндотоксины)
Вода для ИБЭ - вода для инъекций R или вода, подготовленная с использованием других методов, не дающая реакции с лизатом на пределе чувствительности реагента.
Следующая часть публикуется в информационных целях. ИСПЫТАНИЕ НА БАКТЕРИАЛЬНЫЕ ЭНДОТОКСИНЫ: РУКОВОДСТВО 1. ВВЕДЕНИЕ
Эндотоксины, источником которых являются грамотрицательные микроорганизмы, являются наиболее распространенной причиной токсических реакций, приписываемых наличию в фармацевтических препаратах пирогенных примесей; их пирогенная активность намного выше, чем у большинства других пирогенных субстанций. Эндотоксины представляют собой липополисахариды. Несмотря на то, что существует незначительное количество пирогенов другой структуры, обычно по отсутствию бактериальных эндотоксинов в продукте можно сделать вывод об отсутствии пирогенных компонентов при условии, что наличие пироген-ных субстанций, не относящихся к эндотоксинам, можно исключить.
Присутствие эндотоксинов в продукте может маскироваться факторами, влияющими на протекание реакции эндотоксинов с лизатом амебоцитов. Поэтому аналитик, желающий заменить требуемое в фармакопейной статье испытание на пирогенность с использованием кроликов тестом на бактериальные эндотоксины, должен продемонстрировать, что этот тест может быть выполнен для данного продукта; при этом может оказаться необходимым выполнение процедуры удаления мешающих факторов.
Как указано в методике испытания на бактериальные эндотоксины, результаты испытания образца можно считать достоверными лишь при наличии следующей информации:
Должна быть установлена пригодность материала, используемого в испытании. Должно быть гарантировано отсутствие эндотоксинов в воде для ИБЭ и других реагентах, а чувствительность лизата амебоцитов должна быть проверена для подтверждения чувствительности, заявленной производителем.
В связи с тем, что испытуемый продукт может влиять на ход испытания, чувствительность лизата амебоцитов должна быть определена в присутствии и отсутствии испытуемого продукта. Между двумя значениями чувствительности не должно быть существенной разницы.
В испытании на бактериальные эндотоксины (2.6.14) указаны методы исключения мешающих факторов; в случае наличия мешающих факторов после применения этого метода должно быть проведено дополнительное испытание с целью проверки надежности удаления или нейтрализации мешающих факторов.
В данном разделе поясняются причины требований, предъявляемых в испытании на бактериальные эндотоксины, и даются указания, касающиеся регистрации и интерпретации результатов.
Замена требуемого по частной статье испытания на пирогенность с использованием кроликов на испытание с участием лизата амебоцитов фактически означает использование альтернативного метода анализа и, поэтому, требует валидации; в подразделе 11 приведены некоторые указания, касающихся практических действий в данном направлении.
Ссылка на метод, который следует применять для данного продукта, содержится в соответствующих частных статьях; если метод не указан, применяют метод А. Если используется метод, отличный от предписанного, должно быть продемонстрировано, что применяемый метод является подходящим для данного продукта и дает результат, находящийся в согласии с результатом, получаемым предписанным методом (см. также подраздел 13).
2. МЕТОД
Несмотря на то, что добавление эндотоксинов к амебоцитному лизату в растворе может приводить к помутнению, осаждению или гелеобразованию, для определения конечной точки фармакопейного испытания первого типа использовали лишь образование гелевого сгустка. Преимуществом являлась простота принятия решения о том, выдерживает ли продукт испытание, которое обосновывается наличием или отсутствием гелеобразования, легко определяемыми невооруженным глазом. Количественные методы С, D, E и F были разработаны позже; они требуют более сложного оборудования, но легче поддаются автоматизации для регулярного контроля большого количества образцов одного и того же продукта.
Эндотоксины могут адсорбироваться на поверхности пробирок или пипеток, выполненных из некоторых видов пластика и типов стекла. Могут возникать помехи, обусловленные высвобождением веществ из пластических материалов. Поэтому используемые материалы следует подвергать проверке; последующие партии пробирок или пипеток могут иметь несколько отличающийся состав, и поэтому рекомендуется повторять такие испытания при начале работы с новой партией материала.
Решение об использовании испытания на бактериальные эндотоксины в качестве теста на предельное содержание подразумевает, во-первых, что для испытуемого продукта должна быть определена пороговая концентрация эндотоксина и, во-вторых, что требуется определить, выше или ниже этого порога концентрация эндотоксина в испытуемом продукте. Количественные методы С, D, E и F дают возможность определить концентрацию эндотоксина в образце, но для определения соответствия Фармакопее и при рутинном контроле качества, основной вопрос заключается в том, превышает ли эта концентрация установленный предел.
При установлении пороговой концентрации эндотоксина в испытуемом продукте следует уделять должное внимание человеческой дозе этого продукта: цель должна заключаться в том, чтобы гарантировать, что пока концентрация эндотоксина в продукте остается ниже такого порогового значения, даже максимальная доза, вводимая указанным путем в течение часа, не будет содержать эндотоксин в количестве, достаточном для возникновения токсической реакции.
Как в случае равенства концентрации эндотоксинов в продукте пороговому значению, так и в случае значительно больших концентраций, возникает гелеоб-разование, и продукт не выдерживает испытание, ввиду того, что характер испытания «все или ничего» делает невозможным различение концентрации, в точности равной пороговой, и более высокой. Вывод о том, что концентрация эндотоксина не превышает пороговое значение, можно сделать лишь при отсутствии ге-леобразования.
Для продуктов, находящихся в твердом состоянии, такая пороговая концентрация эндотоксина на единицу массы или Международную Единицу продукта подлежит переводу в концентрацию эндотоксина в миллилитре испытуемого раствора, так как испытание может быть выполнено только с раствором. Случай, когда продукция уже пребывает в жидком виде (например, инфузионные жидкости), будет оговорен ниже.
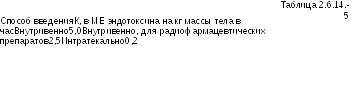
Предельное содержание эндотоксинов: для активных субстанций, предназначенных для парентерального введения, определяется на основании дозы и равно:
K
м ,
где :
К - допустимая пирогенная доза эндотоксина, вводимая в течение часа на килограмм массы тела,
М - максимальная рекомендованная доза продукта, вводимая в течение часа на килограмм массы тела.
 Предельное
содержание эндотоксинов зависит от
продукта и пути его введения и
устанавливается в частных статьях.
Предлагаемые значения К
приведены
в Таблице 2.6.14.-5.
Предельное
содержание эндотоксинов зависит от
продукта и пути его введения и
устанавливается в частных статьях.
Предлагаемые значения К
приведены
в Таблице 2.6.14.-5.
Какое разведение продукта должно быть использовано в испытании для получения максимальной уверенности в том, что отрицательный результат свидетельствует о том, что концентрация эндотоксина в продукте менее предельной, а положительный результат означает, что с помощью лизата обнаруживается концентрация, равная или превышающая предельную? Такое разведение зависит от установленного предела и от чувствительности лизата: для него применяется термин «максимально допустимое разведение» (МДР), и его значение может быть вычислено по следующей формуле:
М Предельное содержание эндотоксинов х Концентрация испытуемого раствора
Д = l '
Концентрация испытуемого раствора:
в мг/мл, если предельное содержание эндотоксинов выражено в массовых единицах (МЕ/мг),
в Ед/мл, если предельное содержание эндотоксинов выражено в пересчете на единицу биологической активности (МЕ/Ед)
в мл/мл, если предельное содержание эндотоксинов выражено в объемных единицах (МЕ/мл).
Л - чувствительность лизата в гель-тромб-методе, указанная на этикетке, или низшая точка стандартной кривой в турбидиметрических или хромогенных методах.
В случаях, когда значение максимально допустимого разведения не является целочисленным, для рутинных целей может быть использовано подходящее целое число, меньшее МДР (что означает разведение раствора продукта в степени, меньшей, чем МДР). В таком случае, отрицательный результат свидетельствует о том, что концентрация эндотоксина в продукте ниже предельного значения. Однако, когда концентрация эндотоксина в продукте в таком испытании ниже предельного значения, но достаточно высока для того, чтобы реакция с лизатом привела к образованию сгустка, испытание в таких условиях может дать положительный результат. Поэтому, когда испытание с использованием такой «удобной» степени разведения дает положительный результат, продукт следует развести до МДР и повторить испытание. В любых сомнительных или спорных случаях следует использовать МДР.
Это подчеркивает важность подтверждения чувствительности лизата.
Пример
Следует провести испытание раствора фенитоина натриевой соли концентрацией 50 мг/мл, предназначенного для внутривенного введения. МДР определяют, используя следующие значения переменных:
М - максимальная человеческая доза = 15 мг на килограмм массы тела в час. с = 50 мг/мл.
К = 5 МЕ эндотоксина на килограмм в час. Л = 0,4 МЕ эндотоксина на миллилитр.
, ,ттп 5 х 50 1 „, ^„ МДР = х — = 41,67
15 0,4
Для рутинных испытаний этого продукта может быть целесообразно 1 мл испытуемого раствора разбавить до 20 мл (величина МДР/2, округленная до ближайшего меньшего целого числа). Однако, если испытание дает положительный результат, следует 1 мл разбавить до 41,67 мл и повторить испытание. Разведение до 41,67 необходимо также в тех случаях, когда испытание проводится для разрешения спорной ситуации.
СТАНДАРТНЫЙ МАТЕРИАЛ
Стандарт эндотоксина BRP используется в качестве препарата сравнения. Его количественное определение проводят в сравнении с Международным стандартом эндотоксина ВОЗ, и его активность выражается в МЕ эндотоксина в ампуле. Международная единица эндотоксина определяется как специфическая активность определенной массы Международного стандарта.
Для рутинных целей может быть использован другой препарат эндотоксина, при условии проведения его количественного определения в сравнении с Международным стандартом эндотоксина или BRP, и его активность выражена в МЕ эндотоксина.
Примечание: Одна международная единица (МЕ) эндотоксина эквивалентна одной единице эндотоксина (ЕЭ).
ВОДА ДЛЯ ИБЭ
Определение отсутствия эндотоксина в продукте путем проведения испытания на пирогенность на кроликах было исключено по практическим и теоретическим причинам:
Испытание на кроликах не обладает достаточной чувствительностью для определения эндотоксина в воде для ИБЭ, предназначенной для проведения испытаний продуктов с очень низкой предельной концентрацией эндотоксинов;
Относительно низкая точность температурной реакции у кроликов привела бы к необходимости проведения большого количества повторных испытаний;
Термины «пирогены» и «эндотоксины» относятся к группам веществ, которые не достаточно полно совпадают друг с другом.
В описании испытания на бактериальные эндотоксины указывается, что для приготовления воды для ИБЭ, кроме трехкратной дистилляции, могут быть использованы и другие методы. К хорошим результатам приводило использование метода обратного осмоса; некоторые аналитики могут предпочесть перегонять воду более трех раз. Какой бы метод ни использовался, полученный продукт не должен содержать поддающихся определению эндотоксинов.
рН СМЕСИ
Оптимальное гелеобразование смеси при проведении испытания на бактериальные эндотоксины достигается при значениях рН от 6,0 до 8,0. Однако, добавление лизата к образцу может привести к снижению рН.
ВАЛИДАЦИЯ ЛИЗАТА
При приготовлении растворов лизата важно следовать инструкциям производителя.
Факторы положительных конечных разведений в методах гелевого сгустка А и В переводят в логарифмы. Причина этого заключается в том, что если построить график частотного распределения этих логарифмических значений, то он обычно намного ближе к кривой нормального распределения, чем частотное распределение самих факторов разведения; фактически, они настолько близки, что допускается использование нормального частотного распределения в качестве математической модели и вычисление границ доверительного интервала с помощью t-критерия Стьюдента.
ПРЕДВАРИТЕЛЬНОЕ ИСПЫТАНИЕ НА МЕШАЮЩИЕ ФАКТОРЫ
Некоторые продукты не могут быть подвергнуты испытанию на наличие эндотоксинов непосредственно, так как они не смешиваются с реактивами, не могут быть доведены до рН 6,0-8,0 или являются ингибиторами или активаторами геле-образования. Поэтому требуется проведение предварительного испытания для проверки наличия мешающих факторов; в случае их обнаружения должно быть продемонстрировано что, процедура их удаления была эффективной.
Цель предварительного испытания состоит в проверке нулевой гипотезы о том, что чувствительность лизата в присутствии продукта существенно не отличается от чувствительности лизата в его отсутствии. В методах А и В используется простой критерий: нулевая гипотеза принимается, если чувствительность лизата в присутствии продукта составляет не менее 50% и не более 200% чувствительности самого лизата.
В соответствии с классическим подходом, следует вычислить среднее значение логарифма коэффициента разведения для чувствительности в присутствии и отсутствии продукта и оценить разницу между двумя средними значениями с помощью t-критерия Стьюдента.
Испытание на мешающие факторы в методах гелевого сгустка А и В требует использования образца продукта, в котором отсутствуют эндотоксины в поддающейся определению концентрации. Это представляет теоретическую проблему при испытании абсолютно новых продуктов. Поэтому для количественных методов С, D, Е и F был разработан другой подход.
ИСКЛЮЧЕНИЕ МЕШАЮЩИХ ФАКТОРОВ
Методика удаления мешающих факторов не должна приводить к уменьшению или увеличению количества эндотоксинов в испытуемом продукте (например, вследствие адсорбции). Корректный способ проверки этого состоит в применении методики к обогащенному образцу продукта, т.е. к образцу, к которому было добавлено известное количество эндотоксина, с дальнейшим измерением его возврата.
Методы С и D. Если помехи обусловлены природой анализируемого продукта и не могут быть исключены классическими методами, может оказаться возможным построение стандартной кривой с использованием продукта того же типа, разбавленного или обработанного соответствующим образом для очистки от эндотоксинов. Испытание на эндотоксины может быть проведено с использованием полученной кривой.
Определено, что в большинстве случаев ультрафильтрация с использованием асимметрических мембранных фильтров, описанная в испытании на бактериальные эндотоксины, приводит к адекватным результатам. Фильтры должны пройти соответствующую валидацию в связи с тем, что производные целлюлозы ((3-D-гликаны) при некоторых обстоятельствах могут обусловить получение ложных положительных результатов.
Установлено, что полисульфоновые фильтры, упоминавшиеся в предшествующем описании, являются непригодными, так как при их использовании были получены ложные положительные результаты.
ЦЕЛЬ ПРОВЕДЕНИЯ КОНТРОЛЬНЫХ ИСПЫТАНИЙ
Цель контроля, содержащего воду для ИБЭ и стандартный препарат эндотоксина с концентрацией, в два раза превышающей чувствительность лизата, указанную на этикетке, состоит в проверке активности лизата в условиях испытания во время его проведения. Целью отрицательного контроля является подтверждение отсутствия поддающейся определению концентрации эндотоксина в воде для
ИБЭ.
Положительный контроль, в котором содержится испытуемый продукт в концентрации, используемой при проведении испытания, предназначен для демонстрации отсутствия мешающих факторов в условиях испытания во время его проведения.
РЕГИСТРАЦИЯ И ИНТЕРПРЕТАЦИЯ РЕЗУЛЬТАТОВ
Незначительные количества эндотоксина в воде для ИБЭ или в любом другом реагенте или материале, с которым лизат находится в контакте в ходе испытания, могут не определятся до тех пор, пока они не достигнут предела чувствительности лизата. Однако, они могут увеличить количество эндотоксина в растворе, содержащем испытуемый продукт, до значения, слегка превышающего предел чувствительности, и вызвать положительную реакцию.
Риск того, что это произойдет, может быть уменьшен путем проверки воды для ИБЭ и других реагентов и материалов с использованием наиболее чувствительного лизата из имеющихся в наличии, или, по крайней мере, более чувствительного, чем лизат, использованный при проведении испытания продукта. Даже в этом случае риск такого «ложного положительного результата» не может быть полностью исключен. Следует, однако, понимать, что в этом отношении методика испытания является безопасной, в отличие от методики испытания, допускающей ложный отрицательный результат, который может привести к выпуску недоброкачественного продукта, опасного для здоровья пациента.
11. ЗАМЕНА ИСПЫТАНИЯ НА ПИРОГЕННОСТЬ НА КРОЛИКАХ ИСПЫТАНИЕМ
НА БАКТЕРИАЛЬНЫЕ ЭНДОТОКСИНЫ
В частных статьях, касающихся фармацевтической продукции, предназначенной для парентерального применения, которая может содержать токсические количества бактериальных эндотоксинов, содержатся требования о проведении испытания либо на бактериальные эндотоксины, либо на пирогенность с использованием кроликов. В общем случае:
В любой частной статье при необходимости проведения подобного испытания содержится только один тест, либо на пирогенность, либо на бактериальные эндотоксины.
При отсутствии доказательств обратного, испытание на бактериальные эндотоксины является предпочтительным по отношению к испытанию на пиро-генность, так как обычно оно обеспечивает равную или лучшую защиту пациента.
Перед включением испытания на бактериальные эндотоксины в частную статью должны быть получены доказательства того, что один из методов, описанных в разделе 2.6.14, является подходящим для испытания данного продукта.
Необходимую информацию предоставляют производители. Приветствуется предоставление компаниями любых имеющихся подтверждающих данных, касающихся применимости испытания на бактериальные эндотоксины к интересующим субстанциям и готовым формам. К таким данным относятся методы подготовки образцов и процедуры, необходимые для исключения мешающих факторов. Кроме того, должны быть предоставлены любые доступные параллельные данные по проведению испытания на пирогенность с использованием кроликов, которые могли бы подтвердить возможность замены испытания на пирогенность тестом на бактериальные эндотоксины.
Дополнительные требования приведены в следующих подразделах.
ИСПОЛЬЗОВАНИЕ МЕТОДА ИСПЫТАНИЯ НА БАКТЕРИАЛЬНЫЕ ЭНДОТОКСИНЫ, ОТЛИЧНОГО ОТ ПРЕДПИСАННОГО В ЧАСТНОЙ СТАТЬЕ
Если в частной статье предписывается проведение испытания на бактериальные эндотоксины, и не указан ни один из методов (А-F), описанных в разделе 2.6.14, то для данного продукта была подтверждена пригодность метода А (предельное испытание методом гелевого сгустка). Если указан один из других методов (В-F), то для этого продукта была подтверждена пригодность указанного метода.
ВАЛИДАЦИЯ АЛЬТЕРНАТИВНЫХ МЕТОДОВ
Замена испытания на пирогенность на кроликах тестом на бактериальные эндотоксины, а также замена установленного или подразумеваемого метода определения бактериальных эндотоксинов другим следует считать использованием альтернативного метода взамен фармакопейного испытания. Общее положение
по использованию альтернативного метода взамен фармакопейного теста приведено в разделе «Общие положения»:
«Описанные испытания и методики количественного определения являются официальными методами, на которых основаны стандарты Фармакопеи. По соглашению с компетентными органами в целях контроля могут использоваться альтернативные методы анализа, при условии, что используемые методы позволяют сделать определенное заключение о том, может ли быть достигнуто согласие со стандартами статей, если бы были использованы официальные методы. В сомнительных и спорных случаях единственными надежными методами считают методы, приведенные в Фармакопее».
Для валидации метода испытания на бактериальные эндотоксины, отличного от подразумеваемого или указанного в частной статье, предлагаются следующие процедуры.
Процедура, материалы и реагенты, используемые при проведении испытания с применением лизата амебоцитов, должны пройти валидацию в соответствии с указаниями, приведенными в испытании на бактериальные эндотоксины.
Должно быть проведено испытание на наличие мешающих факторов (и, при необходимости, процедура по их исключению) на образцах, отобранных, по меньшей мере, из трех партий продукции. Следует иметь в виду, что в методах D и Е, использующих хромогенный пептид, требуются реагенты, не используемые в методах А, В, С и F, и поэтому соответствие методов А, В, С и F требованиям, предъявляемым к мешающим факторам, не может быть без соответствующего подтверждения экстраполировано на методы D и Е.
14. ВАЛИДАЦИЯ ИСПЫТАНИЯ ДЛЯ НОВЫХ ПРОДУКТОВ
Процедуры, описанные в пунктах 13.1 и 13.2, должны быть выполнены для всех новых продуктов, предназначенных для парентерального применения, которые, в соответствии с требованиями Фармакопеи, должны быть подвергнуты испытанию на наличие бактериальных эндотоксинов.
