
- •Фтизіатрія
- •Оглавление
- •Розділ перший. Загальні питання фтизіатрії історичний нарис вчення про туберкульоз
- •Епідеміологія туберкульозу
- •Фактори ризику інфікування після контакту із збудником туберкульозу.
- •Епідеміологічні показники поширеності туберкульозу
- •Збудник туберкульозу, його властивості
- •Патогенез і патоморфологія туберкульозу
- •Патоморфологія туберкульозу
- •Методика обстеження хворого на туберкульоз
- •Огляд, фізикальні методи обстеження
- •Дослідження крові
- •Лабораторні методи виявлення мікобактерій туберкульозу
- •Туберкулінодіагностика
- •Імунологічна діагностика туберкульозу
- •Променева діагностика
- •Функціональні методи дослідження
- •Методи інструментального дослідження
- •Класифікація туберкульозу
- •II. Клінічні форми туберкульозу:
- •III. Характеристика туберкульозного процесу
- •3. Етіологічне підтвердження діагнозу туберкульозу. Етіологічне підтвер
- •IV. Ускладнення туберкульозу
- •V. Клінічна та диспансерна категорія обліку хворого
- •VI. Ефективність лікування хворих на туберкульоз
- •Розділ другий. Клінічні форми туберкульозу. Первинний туберкульоз
- •Первинний туберкульозний комплекс
- •Туберкульоз внутрішньогрудних лімфатичних вузлів
- •Особливості первинного туберкульозу у підлітків
- •Особливості первинного туберкульозу у дорослих
- •Вторинний туберкульоз Дисемінований туберкульоз легень
- •Вогнищевий туберкульоз легень
- •Інфільтративний туберкульоз легень
- •Казеозна пневмонія
- •Туберкульома легень
- •Фіброзно - кавернозний туберкульоз легень
- •Циротичний туберкульоз легень
- •Туберкульоз легень, поєднаний з професійними пиловими захворюваннями легень (коніотуберкульоз)
- •Ускладнення туберкульозу органів дихання
- •Недостатність дихання
- •Легеневе серце
- •Кровохаркання і легенева кровотеча
- •1. Для прискореного зменшення тиску в судинах призначають:
- •Спонтанний пневмоторакс
- •Ателектаз
- •Амілоїдоз внутрішніх органів
- •Бронхіальні та торакальні нориці
- •Залишкові зміни після перенесеного туберкульозу легень
- •Туберкульоз органів дихання у поєднанні з іншими захворюваннями і станами Туберкульоз легень і неспецифічні захворювання органів дихання
- •Туберкульоз легень і цукровий діабет
- •Туберкульоз легень і виразка шлунка та дванадцятипалої кишки
- •Туберкульоз легень і алкоголізм
- •Туберкульоз легень і рак
- •Туберкульоз легень у віл - інфікованих та хворих на снід
- •Туберкульоз легень у вагітних
- •Туберкульоз у осіб похилого і старечого віку
- •Розділ третій туберкульоз позалегеневої локалізації клінічні форми позалегеневого туберкульозу
- •Туберкульозний плеврит (у тому числі емпієма)
- •Туберкульоз нервової системи і мозкових оболонок
- •Туберкульоз кісток і суглобів
- •Туберкульоз сечостатевої системи
- •Туберкульоз периферичних лімфатичних вузлів
- •Туберкульоз кишок, очеревини та брижових лімфатичних вузлів
- •Міліарний туберкульоз
- •Розділ четвертий. Лікування хворих на туберкульоз принципи лікування хворих на туберкульоз
- •Протитуберкульозні засоби
- •Фармакологічна характеристика птп.
- •Комбіновані антимікобактеріальні препарати
- •Фторхінолони.
- •Побічна дія антимікобактеріальних препаратів
- •Стійкість мікобактерій туберкульозу до антимікобактеріальних препаратів та її клінічне значення
- •Мікробіологічна діагностика чутливості мікобактерій туберкульозу до антимікобактеріальних препаратів
- •Шляхи і методи введення антимікобактеріальних препаратів
- •Стандартизована антимікобактеріальна терапія хворих на туберкульоз
- •Контроль ефективності антимікобактеріальної терапії
- •Антимікобактеріальна терапія хворих на туберкульоз у стаціонарних і амбулаторних умовах
- •Патогенетична і симптоматична терапія
- •Санаторно - курортне лікування хворих на туберкульоз
- •Колапсохірургічні методи лікування
- •Штучний пневмоторакс
- •Пневмоперитонеум
- •Хірургічне лікування хворих на туберкульоз легень
- •Пневмонектомія
- •Лобектомія
- •Сегментектомія
- •Кавернотомія і кавернопластика
- •Торакопластика
- •Екстраплевральний пневмоторакс
- •Інші методи хірургічного лікування
- •Реабілітація хворих на туберкульоз
- •Експертиза працездатності хворих на туберкульоз
- •Розділ п'ятий. Організація боротьби з туберкульозом протитуберкульозні заклади Протитуберкульозний диспансер, структура, завдання
- •Групи диспансерного спостереження
- •Оцінка ефективності лікування
- •1. Ефективне лікування:
- •2. Неефективне (невдале) лікування:
- •10. Бактеріовиділювачі
- •Організація виявлення хворих на туберкульоз
- •Виявлення туберкульозу при зверненні за медичною допомогою
- •Участь медичних працівників загальної мережі у своєчасному виявленні туберкульозу
- •Державний санітарно - епідеміологічний нагляд
- •Профілактика туберкульозу
- •Санітарно - просвітня робота
- •Основи dots - стратегії
- •Виявлення хворих на туберкульоз за допомогою dots - стратегії
- •Лікування хворих на туберкульоз за dots - стратегією
- •Оцінка результатів лікування за dots - стратегією
- •Хіміопрофілактика
- •Матеріально - технічне забезпечення
- •Розділ шостий завдання для тестового контролю
Патоморфологія туберкульозу
Реакція в місці локалізації МБТ спочатку має неспецифічний характер. Така реакція спостерігається в тканинах незалежно від виду збудника. Відбуваються порушення мікроциркуляції, підвищення проникності судинної стінки, локальний набряк тканин, інфільтрація зони ураження лейкоцитами, моноцитами й іншими форменими елементами крові. Перші специфічні морфологічні ознаки туберкульозного запалення з'являються пізніше, через 2 - 3 тижні після інфікування МБТ.
Розвиток специфічного для туберкульозу запалення обумовлений імунологічними зрушеннями, які виникають при взаємодії макроорганізму з туберкульозним збудником. У зв'язку з цим специфічну запальну реакцію при туберкульозі характеризують як класичний приклад запалення на імунній основі.
Головним морфологічним елементом туберкульозного запалення є горбок, який частіше називають туберкульозною гранульомою.
Візуалізація туберкульозної гранульоми можлива при світловій мікроскопії.
Найважливішою відмінною рисою туберкульозної гранульоми є наявність центрально розташованої зони сирчастого, або казеозного, некрозу - щільного аморфного клітинного детриту, що утворився внаслідок ушкодження й загибелі фагоцитів. Зона казеозного некрозу оточена декількома шарами епітеліоїдних клітин, макрофагів, лімфоцитів і плазматичних клітин. Серед епітеліоїдних клітин знаходяться великі багатоядерні клітини Пирогова - Лангханса. У зовнішніх відділах клітинного шару можна побачити полінуклеарні лейкоцити й фібробласти. Клітинні елементи, розташовані навколо зони казеозного некрозу, утворюють грануляційну тканину. У клітинах, розташованих ближче до казеозно - некротичних мас, відзначаються ознаки дистрофії й деструкції.
Специфічне запалення захоплює різні морфологічні структури ураженого органа - клітини паренхіми, лімфатичні й кровоносні судини. При туберкульозі легень у специфічну запальну реакцію також залучаються бронхи.
Імуноморфологічні особливості специфічного запалення дозволяють вважати туберкульоз гранулематозним захворюванням.
Функціональний стан паренхіматозних клітин у зоні ураження істотно порушується. У них чітко виявляються ознаки дистрофії й деструкції. Різко знижується резорбтивна функція лімфатичних капілярів. Виникають ушкодження ендотелію лімфатичних капілярів з виходом лімфи в міжклітинний простір. Спостерігаються грубі порушення мікроциркуляції з тромбозом дрібних кровоносних судин. Ушкодження кровоносних судин обумовлені фіксацією в їх базальному шарі циркулюючих імунних комплексів (ЦІК), які можна виявити при електронній мікроскопії. Кровоносні капіляри в туберкульозній гранульомі практично відсутні. Живлення клітинних елементів здійснюється в основному шляхом омивання їх міжклітинною рідиною.
Клітинний склад гранульоми піддається динамічним змінам на різних стадіях її розвитку. За переваги того чи іншого типу клітинних елементів виділяють епітеліоїдно - клітинні, лімфоїдні й гігантськоклітинні туберкульозні гранульоми. У випадках переваги зони некрозу гранульоми називають некротичними.
Особливості клітинного складу гранульоми й вираженість некротичних змін залежать від характеру клітинної реакції в зоні ураження. При продуктивній клітинній реакції в гранульомі переважають епітеліоїдні, макрофагальні, багатоядерні гігантські клітини. Зовнішній відділ клітинного шару містить фібробласти, які синтезують колаген. Некротичні зміни в центрі гранульоми виражені слабко, а іноді відсутні. Перевага ексудативної клітинної реакції проявляється збільшенням зони некрозу. Вона займає 1/3 або 1/2 загального обсягу гранульоми. У клітинному шарі переважають макрофаги й лімфоїдні елементи з обмеженою присутністю епітеліоїдних і гігантських клітин на межі з зоною казеозного некрозу. Переважно альтеративна реакція характеризується формуванням некротичних гранульом, у яких клітинний вал виражений вкрай слабко, а іноді практично відсутній.
Переважання ексудативної тканинної реакції свідчить про прогресування туберкульозного запалення. Тканина, що оточує окремі гранульоми, просочується серозно - фібринозним ексудатом. Поступово відбувається злиття гранульом. У результаті формується туберкульозне вогнище — патологічне утворення діаметром до 1 см. Прогресування вогнищ проявляється розширенням зони перифокального запалення, що спочатку може бути серозним, фібринозним або гнійним. Потім виникають ознаки специфічного запалення - утворюються нові туберкульозні гранульоми з вираженою зоною некрозу, оточеною шаром з нечисленних епітеліоїдних і поодиноких гігантських клітин. Грануляційна тканина інфільтрується макрофагами, лімфоїдними елементами, а також полінуклеарами. Прогресування процесу приводить до злиття вогнищ і формування туберкульозних інфільтратів з ділянками казеозного некрозу. Надалі відбувається інфільтрація казеозних мас полінуклеарними лейкоцитами. Протеолітичні ферменти, що виділяються лейкоцитами, викликають розплавлення казеозних мас. При їх відторгненні формуються виразки або порожнини розпаду, які потім можуть трансформуватися в каверни. Різке пригнічення клітинного імунітету приводить до швидкого прогресування патологічного процесу з виникненням некротичних гранульом. Досить швидко в ураженому органі формуються великі зони казеозного некрозу.
Інтенсивність розвитку туберкульозного запалення, вираженість і зміна запальних тканинних реакцій - проліферації, ексудації й альтерації - у значній мірі залежать від кількості МБТ, що потрапили в організм, і їх вірулентності. В експерименті встановлено, що туберкульозна гранульома в легені тварини (собаки) формується при введенні 10 МБТ, велике вогнище - 106, каверна - 108 мікобактерій. Ексудативна й альтеративна тканинна реакція домінує при збільшенні мікобактеріальної популяції, високій вірулентності мікобактерій, підвищеній чутливості клітин до збудника туберкульозу в сполученні з недостатньою ефективністю фагоцитозу. У цих умовах туберкульозний процес прогресує й при відсутності лікувальних заходів часто призводить до летального наслідку.
Зворотний розвиток туберкульозного запалення в більшості випадків супроводжується поступовим розсмоктуванням ексудату, ущільненням зони казеозного некрозу й формуванням навколо туберкульозних гранульом і вогнищ сполучнотканинної капсули. У загоєнні й наступному рубцюванні гранулематозних вогнищ велике значення має інфільтрація їх фібробластами, що забезпечують формування колагенових волокон. Внаслідок зворотнього розвитку патологічного процесу вони піддаються гіалінозу. У капсулі, що оточує туберкульозні гранульоми й вогнища, іноді можна виявити скупчення лімфоцитів. їх поява зазвичай обумовлена високою ефективністю захисних імунологічних реакцій. Розсмоктування ексудату із трансформацією туберкульозних грануляцій у сполучну тканину може привести до фіброзних (циротичних) змін в ураженому органі.
Відсутність в осумкованних вогнищах специфічної грануляційної тканини вказує на благополучне завершення запалення й підтверджує клінічне вилікування туберкульозу з формуванням залишкових посттуберкульозних змін. Ці зміни відрізняються великим поліморфізмом. Вони можуть бути представлені рубцем, інкапсульованим або кальцинованим фіброзним вогнищем, ділянкою вогнищевого або дифузного пневмо - фіброзу. Іноді наприкінці туберкульозного запалення формуються «сановані» порожнини розпаду. Рідше спостерігаються карніфікація легені й утворення бронхоектазів.
У залишкових посттуберкульозних змінах серед фіброзних волокон знаходяться метаболічно неактивні МБТ.
Залишкові посттуберкульозні зміни є резервуаром ендогенної туберкульозної інфекції. Вони підтримують протитуберкульозний імунітет, а при несприятливих для макроорганізму умовах створюють загрозу повторного захворювання на туберкульоз.
Інволюція туберкульозного запалення з повним розсмоктуванням патологічних вогнищ без будь - яких залишкових змін і повною елімінацією мікобактерій з організму - велика рідкість. Такий наслідок інколи можливий при неускладнених первинних формах туберкульозу й швидкому відновленні імунітету, порушеного на початку захворювання.
Проникнення в організм МБТ нерідко викликає різні неспецифічні зміни в тканинах. Ці зміни етіологічно обумовлені присутністю мікобактерій, проте ознак специфічного запалення не мають. У зв'язку з цим їх прийнято називати параспецифічними.
Параспецифічні тканинні реакції можуть розвиватися в серцево - судинній системі, різних паренхіматозних органах. Найчастіше вони виникають при первинному або ди - семінованому туберкульозі.
Морфологічні ознаки параспецифічних реакцій представлені токсико - алергічним тромбоваскулітом, а також периваскулярними вузлуватими або дифузними інфільтратами з мононуклеарних макрофагів, лімфоцитів і плазматичних клітин. Найбільш виражені такі зміни в лімфатичних вузлах.
Параспецифічні реакції при туберкульозі вперше відзначили патологоанатоми, які характеризували їх як «маски» первинного туберкульозу. Залежно від локалізації параспецифічних змін були виділені серцево - судинна, ендокринна, нервово - дистрофічна, суглобна, шлунково - кишкова «маски» захворювання.
При своєчасній діагностиці туберкульозу й адекватному лікуванні параспецифічні зміни досить швидко піддаються зворотньому розвитку без будь - яких залишкових змін. При відсутності лікування в зоні параспецифічних змін згодом можуть виникнути ураження специфічного характеру.
Виділення в перебігу туберкульозу двох послідовних періодів - первинного і вторинного - знаходить відображення й в особливостях патоморфологічної картини.
Первинний туберкульоз завжди залучає в патологічний процес лімфатичну систему. Обмежений або тотальний казеозний некроз лімфатичних вузлів - найважливіша риса первинного туберкульозу. Наявність великої перифокальної запальної реакції навколо основного вогнища - також важлива відмінна риса первинного туберкульозу. При легеневому ураженні первинний афект переважно локалізується у добре вентильованих відділах, тобто в середніх і нижніх частках легені. Внаслідок бактеріемії, характерної для первинного періоду туберкульозної інфекції, у легенях та інших органах формуються гематогенні вогнища - відсіви. Нерідко виникають поширені параспецифічні реакції. Залишкові посттуберкульозні зміни при первинному туберкульозі формуються повільно. Вони поступово розсмоктуються, рубцюються або звапнюються, іноді піддаються осифікації.
Вторинний туберкульоз розвивається на тлі залишкових змін, що сформувалися в процесі первинного туберкульозу. При вторинному туберкульозі специфічний процес виникає на фоні ослабленого протитуберкульозного імунітету. Регіонарні лімфатичні вузли в патологічний процес не залучаються. Туберкульозне ураження частіше має органний характер з утворенням вогнища, інфільтрату, каверни. У розвитку вторинного туберкульозу велике значення має бронхогенний шлях поширення МБТ. У більшості випадків вторинний туберкульоз уражає легеню, в основному верхні й задні відділи. У залишкових змінах, що формуються внаслідок вторинного туберкульозу, зазвичай відсутні ознаки кальцинації або осифікації.
Контрольні питання
Які є джерела виділення МБТ у навколишнє середовище?
Якими шляхами МБТ потрапляють до організму?
Що таке контактний шлях зараження?
Як поширюються МБТ, потрапивши до організму?
Що таке інфікування?
Що є головним фактором поширення туберкульозу?
Який період називається антеімунологічним?
Що таке "латентний мікробізм"?
Що означає поняття "прихована інфекція"
Що представляють собою "параспецифічні реакції"?
Чим проявляються параспецифічні реакції?
Як можуть виникати вторинні форми туберкульозу?
Який період називається імунологічним?
Чи можна віднести туберкульоз до спадкових захворювань?
ІМУНІТЕТ
Імунітет - специфічна реактивність, спосіб захисту організму від живих тіл і речовин, що несуть ознаки генетичної чужорідності; здатність вищих організмів розпізнавати, знешкоджувати і елімінувати генетично чужорідні речовини; функція спеціалізованої системи генетичного нагляду організму - імунної системи (Р. В. Петров).
Імунітет при туберкульозі істотно відрізняється від імунітету при інших інфекціях. Інфікування мікобактеріями туберкульозу не завжди супроводжується розвитком захворювання, що свідчить про наявність природної стійкості до них (природний імунітет). Вона ґрунтується на спроможності організму ліквідувати збудника захворювання і запобігти хворобі. Природний протитуберкульозний імунітет неоднаково виражений у різних видів тварин. Серед ссавців слабкішу резистентність мають морські свинки, кролики, мавпи; відносно стійкі білі миші, людина; найбільше стійкі щури і собаки.
Наслідок інфікування МБТ у тварин із відносною природною стійкістю залежить від багатьох чинників: дози і вірулентності МБТ, шляху їх проникнення, а головне - від ступеня резистентності. Доказом наявності природної резистентності в людини є секційні дані, що свідчать про майже 100 % - ну інфікованість МБТ дорослого населення, але відомо, що захворілі складають усього частки відсотка. Це свідчить про те, що організм людини сприйнятливий до туберкульозної інфекції, але в той же час порівняно стійкий. Існує природна резистентність багатьох тканин організму людини до туберкульозної інфекції. Це підтверджується тим, що в ранній період інфікування відбувається генералізація МБТ по всьому організму, проте первинне туберкульозне вогнище розвивається переважно в легенях.
В основі природної резистентності лежать неімунологічні феномени: захисна дія непошкодженої шкіри і слизових оболонок, фізико - хімічні особливості тканин, антимікробні гуморальні чинники (лізоцим, плазмін, (3 - лізин та ін.) (табл.1.3). У механізмі природної резистентності особлива роль приділяється фагоцитуючим клітинам, особливо макрофагам. Для туберкульозу характерне внутрішньоклітинне паразитування збудника, але взаємодія МБТ і макрофагів не завжди закінчується руйнуванням мікроба. Встановлено, що в умовах макроорганізму тільки біля 5 % МБТ знищуються макрофагами, інші руйнуються частково або поширюються в організмі макрофагами. Ця неспроможність фагоцитозу сприяє залученню в процесі імунізації великої кількості лімфоїдних клітин, але з іншого боку веде до дисемінації МБТ. Слід зазначити і той факт, що МБТ можуть зруйнувати макрофаги і потім піддатися повторному фагоцитуванню. Макрофаги, зливаючись один з одним, утворюють гігантські клітини Пирогова - Лангханса, що є проявом захисту організму проти МБТ. Отже, фагоцитоз є ефективним фактором протитуберкульозного захисту. Фагоцитарна активність неоднозначна у тварин із різною природною стійкістю: у резистентних осіб відбувається більш виражене пригнічення розмноження МБТ, ніж у чутливих видів. Неспецифічні за своєю сутністю фагоцитарні клітини здійснюють і специфічні функції: захоплюють і переносять антиген до імунокомпетентних клітин і органів.
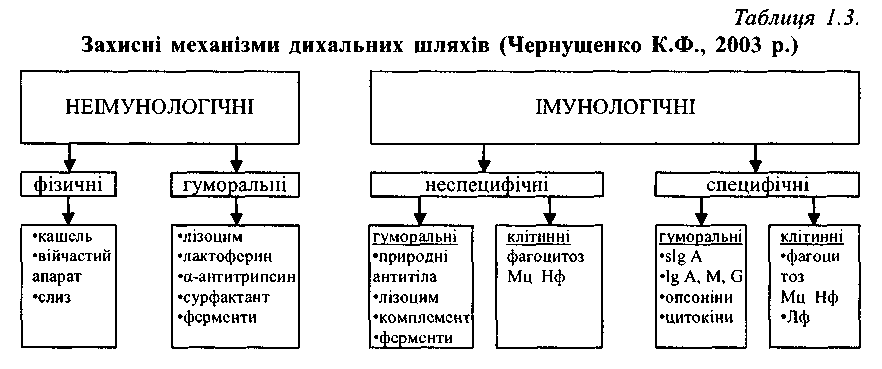
У відповідь на вторгнення МБТ в організмі розвиваються і специфічні імунологічні зміни, що визначають набутий протитуберкульозний імунітет. Доказом розвитку імунітету є ефективність застосування вакцини БЦЖ, запропонованої Кальметом і Гере - ном. Дослідженнями численних авторів доведено, що масова вакцинація різко зменшила захворюваність на туберкульоз. Набутий імунітет виникає не тільки в результаті вакцинації, але і внаслідок природного інфікування. Триває післявакцинальний імунітет 5 - 6 років. У механізмі набутого імунітету відіграють роль три основних феномени: підвижена чутливість сповільненого типу (ПЧСТ), антитілоутворення і фагоцитоз.
Підвищена чутливість сповільненого типу розглядається більшістю дослідників як основна ланка в механізмі протитуберкульозного імунітету. ПЧСТ або туберкулінова алергія - класичний приклад інфекційної алергії. Вона полягає у підвищеній чутливості організму до повторного введення МБТ або продуктів їхньої життєдіяльності (туберкулін). ПЧСТ розвивається не відразу після вакцинації або інфікування, а через певний період інкубації (доалергічний період), тривалість якого може коливатися від декількох днів до декількох місяців і залежить від виду тварин, способу зараження, дози і вірулентності МБТ. У людини цей період складає в середньому 2 - 3 місяці.
Сутність алергії при туберкульозі давно цікавить дослідників. Ще в 1891 році Р. Кох описав відмінність реакцій організму на первинне і повторне проникнення мікобактерій туберкульозу. Ця відмінність стала основою класичного феномену Коха. Сутність феномену: у здорових морських свинок підшкірне введення МБТ викликає місцеву запальну реакцію, що супроводжується генералізацією інфекції; у інфікованих тварин повторне введення МБТ вже через кілька годин викликає місцеве запалення, швидку виразку, що загоюється через декілька днів. Тканини інфікованої тварини створюють своєрідний бар'єр, який захищає організм. Ця бар'єрно - фіксуюча здатність тканин інфікованого організму є проявом алергії, що захищає організм від повторного проникнення МБТ. Наслідок реакції залежить від ступеня підвищеної чутливості, що визначається як дозою первинного інфекту, так і тривалістю періоду між первинним і повторним інфікуванням. Має значення і кількість МБТ при повторному інфікуванні.
ПЧСТ при туберкульозі - тимус залежний імунологічний феномен, який є специфічним. Головними клітинами - ефекторами ПЧСТ є Т - лімфоцити, що кооперуються з В - клітинами і макрофагами. Доказом ролі Т - лімфоцитів у реалізації стійкості до МБТ є можливість пасивного переносу ПЧСТ від сенсибілізованих тварин інтактним. Вважають, що розвиток імунітету при туберкульозі поєднаний із функцією Т - хелперів 1 - го типу і синтезом визначеного профілю цитокінів - інтерлейкін - 2 (ІЛ), інтерферон - у, ІЛ - 12. Це визначає головну роль в імунітеті ПЧСТ. Проте не можна заперечити і ролі Т - хелперів 2 - го типу, що синтезують інші цитокіни (ІЛ - 4, ІЛ - 5, ІЛ - 6, ІЛ - 10, ІЛ - 13) і підсилюють антитілоутворення (синтез специфічних антитіл і IgE). Ці типи імунної відповіді знаходяться у взаємній конкуренції, але не виключена їх спільна участь у реалізації специфічної відповіді на МБТ.
Виявлення ПЧСТ можливе при проведенні внутрішньошкірної туберкулінової проби Манту. Вона і зараз не втратила свого діагностичного значення, особливо для виявлення післявакцинальної алергії і віражу, проте в даний час з'явилися нові методи виявлення ПЧСТ, які ґрунтуються на визначенні реакції імунокомпетентних клітин на туберкулін: реакція бластної трансформації лімфоцитів (РБТЛ), інгібіції міграції лейкоцитів (ІМЛ), цитотоксичний ефект сенсибілізованих лімфоцитів на клітини - мішені (ЦТЛ). Реакції, що відображають інтенсивність ПЧСТ, найбільш виражені на висоті вакцинного імунітету як в експерименті, так і у вакцинованих БЦЖ людей. ПЧСТ може бути пригнічена застосуванням препаратів, що діють на Т - лімфоцити. Преднізолон, імуран та інші призводять до різкого пригнічення ПЧСТ і в свою чергу до послаблення протитуберкульозного імунітету і прогресування туберкульозної інфекції.
Гуморальні реакції. Також розвиваються в організмі людини в результаті інфікування МБТ. Широкий спектр протитуберкульозних антитіл обумовлений складністю антигенної структури МБТ. При цьому слід зазначити низький рівень антитіл при туберкульозі, незважаючи на виражені антигенні властивості МБТ. Вважають, що ПЧСТ індукується білковими компонентами, а антитілоутворення - як білковими, так і ліпополісахарид - ними фракціями. Це є причиною різноманітності специфічних протитуберкульозних антитіл. Дотепер не визначена сутність антитілоутворення в механізмі протитуберкульозної стійкості. Чітко встановлено, що антитілам не властивий захисний ефект, тобто попереднє введення їх здоровій тварині не запобігає розвитку туберкульозної інфекції. Сироватки крові, що містять антитіла, не пригнічують росту МБТ in vitro. Пасивне введення В - лімфоцитів інфікованої тварини здоровим не передає їм стійкості до МБТ.
Встановлено, що специфічні протитуберкульозні антитіла здатні підсилювати фагоцитоз. Таким чином, переважно клітинний характер протитуберкульозного імунітету доповнюється гуморальною ланкою, яка визначає кооперацію Т - , В - лімфоцитів і фагоцитуючих клітин.
Високий рівень антитіл, який має місце при хронічних формах туберкульозу, може несприятливо впливати на перебіг туберкульозного процесу. Крім того, доведено, що антитіла беруть участь у комплексоутворенні, високий рівень якого порушує трофіку тканин і сприяє їх некротизуванню. Існує залежність частоти виявлення антитіл від тривалості туберкульозного процесу. Антитіла визначаються найчастіше у хворих із фіброзно - кавернозною формою процесу, і значно рідше - в осіб з "малими" формами. На підставі цих даних можна зробити висновок, що антитіла при туберкульозі свідчать про тривалість антигенного впливу.
Фагоцитоз. У протитуберкульозному захисті дуже велика роль фагоцитів, особливо макрофагів, які тісно взаємодіють із лімфоцитами. Сенсибілізовані лімфоцити здійснюють специфічний вплив на макрофаги за допомогою синтезованих ними ци - токінів, завдяки чому макрофаги та інші фагоцитуючі клітини залучаються у вогнище повторного вторгнення МБТ, підсилюється їх здатність до переварювання поглинених МБТ, пригнічується ріст МБТ у вогнищі запалення. Цей ефект лімфоцитів специфічний. У свою чергу контакт фагоцитуючих клітин із МБТ супроводжується синтезом цитокінів (прозапальної, протизапальної дії), які забезпечують клітинну взаємодію під час розвитку реакцій протитуберкульозного імунітету. У макрофагах різко підсилюються метаболічні процеси, ферментативна активність (гідролази, протеази, фосфоліпази та ін.). Макрофаги неоднорідні за своєю значимістю. Деякі здійснюють активний фагоцитоз, інші виконують синтетичну функцію, що забезпечує міжклітинну взаємодію. Істотна роль приділяється їх спроможності до виведення імунних комплексів із організму.
Результат взаємодії між МБТ і макрофагами залежить від функціонального стану останніх, а саме від їхньої здатності синтезувати гідролітичні ферменти, цитокіни і метаболіти кисню. Пригнічення фагоцитарної і секреторної здатності макрофагів, що може мати місце при імунодефіцитних станах різного генезу (опромінення, інтоксикація, імуносупресивна терапія тощо), сприяє персистенції МБТ.
Клітини ендотелію кровоносних судин. У розвитку імунної відповіді на МБТ беруть участь і клітини ендотелію кровоносних судин, що виділяють біологічно активні речовини: адгезивні молекули (L - , Р - , Е - селектини, інтегрини й ін.), різні цитокіни, фактори росту. Вони забезпечують взаємодію ендотелію з іншими клітинними елементами (Т - лімфоцити, макрофаги, нейтрофілоцити, тромбоцити). В останні роки клітинам ендотелію відводиться істотна роль як у реалізації захисних реакцій, так і в імуно - патологічних процесах.
Стан, що виникає після вакцинації БЦЖ чи після первинного інфікування, не визначає абсолютної стійкості проти МБТ. Інтенсивність протитуберкульозного захисту залежить як від характеру антигенного впливу (вид збудника, вірулентність, масивність), так і від стану макроорганізму, в першу чергу від стану імунної системи (наявність вродженого імунодефіциту), а також факторів, що можуть викликати вторинну її дефектність: опромінення, вживання імунодепресантів, інтоксикація. Відіграють роль і інші фактори: стан нервової, ендокринної систем, характер обмінних процесів та ін.
Тривалий час вважалося, що імунітет при туберкульозі носить "нестерильний" характер. Це ґрунтувалося на тому, що для підтримки імунітету необхідна обов'язкова наявність в організмі МБТ чи їх субстанцій. Однак дослідження багатьох авторів довели, що для підтримки імунітету наявність живих мікроорганізмів не потрібна.
Імунологічна пам'ять. Це збереження антигенних детермінант на клітинних елементах крові й у сироватці крові (М. М. Авербах). У механізмі підтримки імунітету цей феномен грає велику роль.
Серйозною проблемою фтизіатрії є широке інфікування практично здорового населення; більшість осіб туберкулінпозитивні, що свідчить про наявність персистуючої туберкульозної інфекції. Дуже важливе значення має виявлення серед них груп ризику, в яких можливий розвиток захворювання. Потрібні критерії визначення активації старих вогнищ, у яких можуть зберігатися МБТ у тій чи іншій формі (L - форми, фільтрівні форми). Багато авторів пов'язують захворювання на туберкульоз і реактивацію туберкульозної інфекції зі зниженням природної опірності і набутого протитуберкульозного імунітету. У клініці немає можливості оцінити стан імунної системи до захворювання, тому не можна з повною вірогідністю поєднати розвиток патології з початковими порушеннями імунної системи. Проте відомо, що більш висока захворюваність на туберкульоз зустрічається у хворих на діабет, у перехворілих на кір, у ВІЛ - інфікованих, тобто в осіб з порушеннями в імунній системі. Проблема імунодефіциту актуальна також тому, що значно збільшується число хворих на туберкульоз серед осіб, котрі зловживають наркотиками.
Різний ступінь природної стійкості до туберкульозної інфекції різних видів тварин і людини пов'язаний із генетичними факторами, що визначають різну схильність до захворюваності різних людей. Виконано досить багато досліджень, що довели асоціацію генів HLA - системи зі стійкістю до туберкульозу. Показано, що несприятливий перебіг туберкульозного процесу частіше зустрічається в осіб з DR - 2 антигенами, сприятливий - з DR - 3. Гени HLA - комплексу І і II класів є важливими факторами, що визначають патогенез туберкульозу, контролюючи стійкість і сприйнятливість до туберкульозної інфекції. Перебування Ir - генів поблизу HLA - DR локусу обумовлює регуляцію сили імунної відповіді Т - і В - лімфоцитів на мікобактеріальні антигени.
Контрольні питання
Від яких чинників залежать наслідки інфікування МБТ?
Які імунологічні феномени лежать в основі природної резистентності туберкульозу?
Які основні феномени у механізмі набутого імунітету при туберкульозі?
Яка основна ланка в механізмі протитуберкульозного імунітету?
У чому сутність класичного феномену Коха?
