
- •В.И. Вигдорович, с.В. Романцова, н.В. Шель, и.В. Зарапина
- •Оглавление
- •Предисловие
- •Часть I. Основы органической химии
- •Структура органических соединений
- •Теория строения органических соединений а.М. Бутлерова
- •Изомерия органических соединений
- •Индуктивный и мезомерный эффекты
- •Понятие о мезомерном эффекте
- •Типы реакций органических соединений. Понятие о механизме реакции
- •Типы реакций в органической химии
- •Направление и селективность химической реакции
- •Предельные (насыщенные) углеводороды
- •Изомерия алканов.Для алканов характерен один из видов структурной изомерии – изомерия углеродной цепи (строения углеродного скелета). Приведем примеры таких изомеров:
- •Физические свойства алканов
- •Физические характеристики некоторых нормальных углеводородов
- •Влияние разветвления молекул алканов на их физические характеристики
- •Химические свойства алканов
- •Некоторые отдельные представители
- •Экологическая характеристика алканов
- •Задачи по теме
- •Циклоалканы
- •Физические свойства циклоалканов
- •Получение циклоалканов
- •Химические свойства малых циклов
- •Применение циклоалканов
- •Экологическая оценка
- •Непредельные углеводороды Алкены (олефины)
- •Физические свойства олефинов
- •Получение олефиновых углеводородов
- •Химические свойства олефинов
- •Отдельные представители олефинов
- •Экологические характеристики
- •Задачи по теме
- •Алкадиены (диеновые углеводороды)
- •Методы получение диенов
- •Химические свойства диенов
- •Каучуки
- •Экологическая характеристика
- •Задачи по теме
- •Алкины (ацетиленовые углеводороды)
- •Методы получения алкинов
- •Физические свойства алкинов
- •Химические свойства алкинов
- •Экологическая характеристика
- •Задачи по теме
- •Предельные спирты
- •Предельные одноатомные спирты
- •Получение одноатомных спиртов
- •Физические свойства первичных спиртов
- •Химические свойства одноатомных спиртов
- •Отдельные представители
- •Предельные многоатомные спирты
- •Получение двухатомных спиртов
- •Получение трехатомных спиртов
- •Физические свойства многоатомных спиртов
- •Химические свойства многоатомных спиртов
- •Экологическая характеристика
- •Задачи по теме
- •Предельные оксосоединения
- •Альдегиды
- •Получение альдегидов
- •Физические свойства альдегидов
- •Химические свойства альдегидов
- •Отдельные представители
- •Экологическая характеристика
- •Получение кетонов
- •Химические свойства кетонов
- •Отдельные представители
- •Задачи по теме
- •Карбоновые кислоты
- •Электронное строение карбоксильной группы
- •Предельные карбоновые кислоты
- •Физические свойства кислот
- •Получение карбоновых кислот
- •Химические свойства карбоновых кислот
- •Свойства отдельных представителей гомологического ряда
- •Задачи по теме
- •Азотсодержащие органические соединения
- •Нитросоединения
- •Нитрилы и изоцианиды
- •Алифатические амины
- •Физические свойства аминов
- •Получение аминов
- •Химические свойства аминов
- •Отдельные представители
- •Экологическая характеристика
- •Задачи по теме
- •Аминокислоты
- •Физические свойства α-аминокислот
- •Способы получения -аминокислот
- •Способы получения -аминокислот
- •Химические свойства аминокислот
- •Отдельные представители
- •Простые и сложные эфиры Простые эфиры
- •Способы получения простых эфиров
- •Физические свойства простых эфиров
- •Химические свойства простых эфиров
- •Отдельные представители
- •Сложные эфиры карбоновых кислот Получение сложных эфиров карбоновых кислот
- •Химические свойства эфиров карбоновых кислот
- •Физические свойства жиров
- •Химические свойства жиров
- •Сложные липиды
- •Ароматические углеводороды, арены Бензол и его производные
- •Методы получения бензола и его гомологов
- •Получение гомологов бензола
- •Физические свойства аренов
- •Химические свойства
- •Экологиченские характеристики
- •Ароматические оксосоединения Фенолы
- •Некоторые физические и термодинамические характеристики ряда фенолов
- •Получение фенола
- •Некоторые химические свойства фенола
- •Задачи по теме
- •Гетероциклические соединения
- •Пятичленные гетероциклы с одним гетероатомом
- •Химические свойства пиридина
- •Диоксины
- •Физико-химические свойства ксенобиотиков типа диоксинов
- •Источники ксенобиотиков
- •Пестициды
- •Фуллерены. Синтез и свойства соединений на их основе
- •Методы получения гидридов фуллеренов
- •Кислотность фуллеренов
- •Применение фуллеренов
- •Высокомолекулярные соединения
- •Свойства высокомолекулярных соединений
- •Основные химические реакции высокомолекулярных соединений
- •Часть II основы химической термодинамики
- •Понятия и термины химической термодинамики
- •Внутренняя энергия
- •Первое началотермодинамики
- •Следствия из первого начала термодинамики
- •Теплоемкость при постоянном объеме, сv
- •Теплоемкость при постоянном давлении
- •Равновесные процессы. Максимальная работа
- •Термохимия
- •Закон Гесса
- •Следствия из закона Гесса
- •И окончательно
- •Связь h и u химических реакций
- •Зависимость тепловых эффектов от температуры. Закон Кирхгофа
- •Совершенно очевидно, что разности Сi можно выразить через уравнение
- •Средняя теплоемкость
- •Работа тепловой машины. Теорема и цикл Карно
- •Второе начало термодинамики
- •Энтропия как критерий самопроизвольного течения процесса
- •Следовательно, если такой процесс протекает в изолированной системе, то
- •Расчет энтропии
- •Расчет изменения энтропии идеального газа
- •Задачи для самостоятельного решения
- •Принцип локального равновесия
- •Важно найти функции, определяющие зависимость deSиdiSот экспериментально измеряемых величин.
- •Статистическая интерпретация энтропии
- •Химический потенциал и химическое сродство
- •Химический потенциал
- •Химическое сродство
- •Уравнение Клапейрона-Клаузиуса
- •Термодинамические потенциалы
- •Свободная энергия Гиббса
- •Для чистого вещества
- •Условия самопроизвольного протекания процесса
- •Уравнение Гиббса-Гельмгольца
- •Тепловая теорема Нернста. Третий закон термодинамики
- •Некоторые аспекты, связанные с достижением химического равновесия
- •Изотерма химической реакции
- •Изобара химической реакции
- •Задачи для самостоятельного решения
- •Задача 7.Для реакции
- •Задача 8.Для реакции
- •Задача 10.Для реакции
- •Задача 11. Для реакции
- •Литература Основная литература
- •Дополнительная литература
Индуктивный и мезомерный эффекты
Н
–С–Х –С–Н –С–Н –С–Х






 апомним
читателям, что под поляризацией молекул
понимается смещение электрического
заряда, носителем которого являются
электроны, участвующие в образовании
химических связей. При этом атомы, более
электроотрицательные, чем углерод,
притягивают к себе электронные пары,
образующие-связи.
Такая поляризация представляет собой
индуктивный эффект, обозначаемый какIили ().
Примем за точку отсчета образование
связи , тогда при переходе к (ХН) электронная пара может быть сдвинута
в сторону заместителя, обозначенного
через Х или, напротив, от него. (Сдвиг
электронной пары в порядке интерпретации
физического смысла можно, в первом
приближении, трактовать как увеличение
или уменьшение доли времени в обслуживании
соответствующего ядра). В первом случае
имеет место отрицательный индуктивный
эффект (I),
во втором – положительный (+I).
апомним
читателям, что под поляризацией молекул
понимается смещение электрического
заряда, носителем которого являются
электроны, участвующие в образовании
химических связей. При этом атомы, более
электроотрицательные, чем углерод,
притягивают к себе электронные пары,
образующие-связи.
Такая поляризация представляет собой
индуктивный эффект, обозначаемый какIили ().
Примем за точку отсчета образование
связи , тогда при переходе к (ХН) электронная пара может быть сдвинута
в сторону заместителя, обозначенного
через Х или, напротив, от него. (Сдвиг
электронной пары в порядке интерпретации
физического смысла можно, в первом
приближении, трактовать как увеличение
или уменьшение доли времени в обслуживании
соответствующего ядра). В первом случае
имеет место отрицательный индуктивный
эффект (I),
во втором – положительный (+I).
Таким образом, уточняя, отметим, что при +Iэлектронная пара смещается в сторону атома углерода в большей мере, чем это имеет место в случае связи С–Н.
Положительным индуктивным эффектом характеризуются алкильные радикалы, атомы металлов (в металлорганических соединениях), отрицательным – атомы галогенов, функциональные группы, содержащие кислород, азот, серу, кратные связи, а также группы, несущие положительный заряд (например, диазогруппа).
Например, при замещении в углеродной цепи карбоновой кислоты атомов водорода на галоген, - углеродный атом, связанный с галогеном (наиболее эффективно сF) становится более электроположительным, то есть на нем возрастает дробный положительный заряд (+). А общая электронная пара стягивается к более электроотрицательному атому галогена. Одновременно- углеродный атом, имеющий частичный положительный заряд, в свою очередь, оттягивает электронную пару от- углеродного атома и от атома углерода карбоксильной группы. В этом случае водород карбоксильной группы в силу наличия на нем положительного частичного заряда становится более подвижным, то есть менее прочно связанным с молекулярным остовом, и происходит усиление кислотных свойств. При передаче по углеродной цепи индуктивный эффект затухает. Продемонстрируем это на примере величин констант электролитической диссоциации хлормасляных кислот.
масляная кислота СН3(СН2)2СООН, Ка= 1,5105
- хлормасляная кислота СН3СН2СНClСООН, Ка= 1,4103
- хлормасляная кислота СН3СНClСН2СООН, Ка= 8,7105
- хлормасляная кислота СН2Cl(CН2)2СООН, Ка= 3,0105
Атом галогена не только усиливает кислотные, но и ослабляет основные свойства химических соединений. Это, как и эффект затухания, хорошо прослеживается на величинах констант основности (Кв) анилина и его производных
анилин С6Н5NH2Кв= 3,81010
о–хлоранилин ClС6Н4NH2Кв= 4,41011
м–хлоранилин ClС6Н4NH2Кв= 2,21011
п–хлоранилин ClС6Н4NH2Кв= 9,51011
и хлорпроизводных первичных аминов
этиламин Кв= 4,7104
хлорэтиламин Кв= 2103
хлорпропиламин Кв= 3105
хлорбутиламин Кв= 6105
хлорпентиламин Кв= 9105
Понятие о мезомерном эффекте
По терминологии выдающегося американского химика, дважды лауреата нобелевской премии Лайнуса Полинга это явление определяется как резонанс. Суть мезомерного М-эффекта в следующем. Покажем это на конкретных примерах. Соли карбоновых кислот, например, ацетат натрия диссоциирует по уравнению (RH):
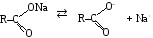
Но в образующемся анионе атомы кислорода тождественны и, следовательно, несут одинаковый дробный отрицательный заряд (), равный0,5. Тогда можно записать.
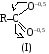
Изогнутые стрелки показывают направление сдвига электронных пар.
Подобная картина
наблюдается и в анионе угольной кислоты
(СО![]() ),
когда вновь наблюдается выравнивание
зарядов и отождествление атомов
кислорода, входящих в анион.
),
когда вновь наблюдается выравнивание
зарядов и отождествление атомов
кислорода, входящих в анион.
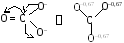
Выравнивание зарядов сопровождается понижением энергии U(повышением стабильности) соответствующих частиц. ВеличинаU, наблюдаемая в этом случае место, называется энергией резонанса.
Мезомерный эффект проявляется в химических соединениях (частицах) и влияет на перераспределение зарядов в молекуле.
Если в молекуле имеются системы сопряженных простых и кратных связей или атомы с неподеленными электронными парами, включенными в систему сопряжения, они могут участвовать в образовании общего -электронного облака. Участие групп в сопряжении и влияние их на состояние -электронного облака молекулы называют мезомерным эффектом (сдвиг электронной плотности сопряжённых -связей), или эффектом сопряжения (обычно обозначается заглавной буквой М; реже – заглавной буквой С). Для его обозначения используется изогнутая стрелка. У атомов азота, кислорода, фтора внешняя электронная оболочка заполнена, и они способны смещать p-электроны неподеленной электронной пары в сторону бензольного ядра или ненасыщенного углеродного атома:
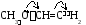
Е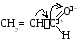 сли
в систему сопряжения входит кратная
связь между разнородными атомами, то
общее-электронное
облако смещается в сторону более
электроотрицательного атома:
сли
в систему сопряжения входит кратная
связь между разнородными атомами, то
общее-электронное
облако смещается в сторону более
электроотрицательного атома:

Положительный мезомерный эффект проявляют группы, в составе которых есть атомы с неподелённой электронной парой: –ОН; –OR; –NH2; NR2; –SH; галогены (смещение электронной плотности от гетероатома); отрицательный: группы NO2, CN, СООН, SО3Н (смещение электронной плотности к гетероатому функциональной группы). Наличие индуктивного и мезомерного эффектов приводит к перераспределению электронной плотности в молекуле. В результате на одних атомах концентрируется частичный отрицательный, а на других — частичный положительный заряды. В свою очередь, это перераспределение зарядов определяет реакционную способность соединений, их кислотно-основные свойства, дипольный момент молекул, силу межмолекулярных связей (а значит и такие свойства как температуры кипения и плавления, растворимость).
