
- •В.И. Вигдорович, с.В. Романцова, н.В. Шель, и.В. Зарапина
- •Оглавление
- •Предисловие
- •Часть I. Основы органической химии
- •Структура органических соединений
- •Теория строения органических соединений а.М. Бутлерова
- •Изомерия органических соединений
- •Индуктивный и мезомерный эффекты
- •Понятие о мезомерном эффекте
- •Типы реакций органических соединений. Понятие о механизме реакции
- •Типы реакций в органической химии
- •Направление и селективность химической реакции
- •Предельные (насыщенные) углеводороды
- •Изомерия алканов.Для алканов характерен один из видов структурной изомерии – изомерия углеродной цепи (строения углеродного скелета). Приведем примеры таких изомеров:
- •Физические свойства алканов
- •Физические характеристики некоторых нормальных углеводородов
- •Влияние разветвления молекул алканов на их физические характеристики
- •Химические свойства алканов
- •Некоторые отдельные представители
- •Экологическая характеристика алканов
- •Задачи по теме
- •Циклоалканы
- •Физические свойства циклоалканов
- •Получение циклоалканов
- •Химические свойства малых циклов
- •Применение циклоалканов
- •Экологическая оценка
- •Непредельные углеводороды Алкены (олефины)
- •Физические свойства олефинов
- •Получение олефиновых углеводородов
- •Химические свойства олефинов
- •Отдельные представители олефинов
- •Экологические характеристики
- •Задачи по теме
- •Алкадиены (диеновые углеводороды)
- •Методы получение диенов
- •Химические свойства диенов
- •Каучуки
- •Экологическая характеристика
- •Задачи по теме
- •Алкины (ацетиленовые углеводороды)
- •Методы получения алкинов
- •Физические свойства алкинов
- •Химические свойства алкинов
- •Экологическая характеристика
- •Задачи по теме
- •Предельные спирты
- •Предельные одноатомные спирты
- •Получение одноатомных спиртов
- •Физические свойства первичных спиртов
- •Химические свойства одноатомных спиртов
- •Отдельные представители
- •Предельные многоатомные спирты
- •Получение двухатомных спиртов
- •Получение трехатомных спиртов
- •Физические свойства многоатомных спиртов
- •Химические свойства многоатомных спиртов
- •Экологическая характеристика
- •Задачи по теме
- •Предельные оксосоединения
- •Альдегиды
- •Получение альдегидов
- •Физические свойства альдегидов
- •Химические свойства альдегидов
- •Отдельные представители
- •Экологическая характеристика
- •Получение кетонов
- •Химические свойства кетонов
- •Отдельные представители
- •Задачи по теме
- •Карбоновые кислоты
- •Электронное строение карбоксильной группы
- •Предельные карбоновые кислоты
- •Физические свойства кислот
- •Получение карбоновых кислот
- •Химические свойства карбоновых кислот
- •Свойства отдельных представителей гомологического ряда
- •Задачи по теме
- •Азотсодержащие органические соединения
- •Нитросоединения
- •Нитрилы и изоцианиды
- •Алифатические амины
- •Физические свойства аминов
- •Получение аминов
- •Химические свойства аминов
- •Отдельные представители
- •Экологическая характеристика
- •Задачи по теме
- •Аминокислоты
- •Физические свойства α-аминокислот
- •Способы получения -аминокислот
- •Способы получения -аминокислот
- •Химические свойства аминокислот
- •Отдельные представители
- •Простые и сложные эфиры Простые эфиры
- •Способы получения простых эфиров
- •Физические свойства простых эфиров
- •Химические свойства простых эфиров
- •Отдельные представители
- •Сложные эфиры карбоновых кислот Получение сложных эфиров карбоновых кислот
- •Химические свойства эфиров карбоновых кислот
- •Физические свойства жиров
- •Химические свойства жиров
- •Сложные липиды
- •Ароматические углеводороды, арены Бензол и его производные
- •Методы получения бензола и его гомологов
- •Получение гомологов бензола
- •Физические свойства аренов
- •Химические свойства
- •Экологиченские характеристики
- •Ароматические оксосоединения Фенолы
- •Некоторые физические и термодинамические характеристики ряда фенолов
- •Получение фенола
- •Некоторые химические свойства фенола
- •Задачи по теме
- •Гетероциклические соединения
- •Пятичленные гетероциклы с одним гетероатомом
- •Химические свойства пиридина
- •Диоксины
- •Физико-химические свойства ксенобиотиков типа диоксинов
- •Источники ксенобиотиков
- •Пестициды
- •Фуллерены. Синтез и свойства соединений на их основе
- •Методы получения гидридов фуллеренов
- •Кислотность фуллеренов
- •Применение фуллеренов
- •Высокомолекулярные соединения
- •Свойства высокомолекулярных соединений
- •Основные химические реакции высокомолекулярных соединений
- •Часть II основы химической термодинамики
- •Понятия и термины химической термодинамики
- •Внутренняя энергия
- •Первое началотермодинамики
- •Следствия из первого начала термодинамики
- •Теплоемкость при постоянном объеме, сv
- •Теплоемкость при постоянном давлении
- •Равновесные процессы. Максимальная работа
- •Термохимия
- •Закон Гесса
- •Следствия из закона Гесса
- •И окончательно
- •Связь h и u химических реакций
- •Зависимость тепловых эффектов от температуры. Закон Кирхгофа
- •Совершенно очевидно, что разности Сi можно выразить через уравнение
- •Средняя теплоемкость
- •Работа тепловой машины. Теорема и цикл Карно
- •Второе начало термодинамики
- •Энтропия как критерий самопроизвольного течения процесса
- •Следовательно, если такой процесс протекает в изолированной системе, то
- •Расчет энтропии
- •Расчет изменения энтропии идеального газа
- •Задачи для самостоятельного решения
- •Принцип локального равновесия
- •Важно найти функции, определяющие зависимость deSиdiSот экспериментально измеряемых величин.
- •Статистическая интерпретация энтропии
- •Химический потенциал и химическое сродство
- •Химический потенциал
- •Химическое сродство
- •Уравнение Клапейрона-Клаузиуса
- •Термодинамические потенциалы
- •Свободная энергия Гиббса
- •Для чистого вещества
- •Условия самопроизвольного протекания процесса
- •Уравнение Гиббса-Гельмгольца
- •Тепловая теорема Нернста. Третий закон термодинамики
- •Некоторые аспекты, связанные с достижением химического равновесия
- •Изотерма химической реакции
- •Изобара химической реакции
- •Задачи для самостоятельного решения
- •Задача 7.Для реакции
- •Задача 8.Для реакции
- •Задача 10.Для реакции
- •Задача 11. Для реакции
- •Литература Основная литература
- •Дополнительная литература
Первое началотермодинамики
Первое начало термодинамики в дифференциальной форме записывается следующим образом
Q = dU + А, (10)
где dU – бесконечно малое изменение внутренней энергии, Q и А – бесконечно малые величины теплоты и работы. Вся полученная системой теплота расходуется на изменение ее внутренней энергии и совершение работы. Или
dU = Q + А,
то есть изменение внутренней энергии системы равно сумме полученной ей теплоты и совершения работы с учетом знака. Такая картина характерна для обычно используемого подхода равновесной термодинамикой. Иной подход предлагают Л. Пригожин и Д. Кондепуди. Так как тепловой поток обусловлен процессами, происходящими за конечное время и в предположении, что величина теплового потока известна, количество теплоты dQ, которым система обменялась с окружающей средой за бесконечно малый промежуток времени d, вполне определяемо. Это же касается и dА. Тогда полное изменение энергии закрытой системы за время d имеет вид
dU = dQ + dА.
Для открытой системы необходимо учесть вклад из-за потока вещества dUвещ.
dU = dQ + dА + dUвещ
Однако вернемся к рассмотрению, используемому равновесной термодинамикой. Из закона сохранения энергии и с учетом уравнения (10) следует зависимость
Q = U + A, (11)
где U = U2 –U1.
Для бесконечно малых элементарных процессов справедливо уравнение (10).
Следует отметить, что производимая системой работа может быть связана не только с изменением объема. В таком случае, помимо работы, обусловленной изменением объема, нужно учесть и все остальные возможные ее виды (А), в том числе и связанную с химическим превращением вещества. Тогда
А = pV + А,
и уравнение (10) принимает вид
Q = dU + pdV + А. (12)
Следствия из первого начала термодинамики
Дело в том, что процессы, в которых участвует та или иная система, могут протекать при различных условиях. Для простоты примем А = 0.
1. Изохорический процесс. В этом случае помимо А = 0, также и dV = 0. Уравнение (12) принимает вид
QV = dU (13)
или
![]()
и
![]()
QV = U2 –U1 = U.
Отсюда следует, что, если поглощение (или отдача) теплоты не вызывает изменения агрегатного состояния, то происходит изменение внутренней энергии системы, что выразится только в повышении температуры системы.
Теплоемкость при постоянном объеме, сv
Вообще теплоемкостью С тела называется отношение поглощенного количества теплоты dQк вызванному этим повышению температуры. Вместе с темdQ/dТ равняется производной, так какdQне изменениеQ, а ее малое количество. Чтобы это подчеркнуть, пишутQ/dТ. Теплоемкость в таком определении не является функцией состояния.
Но изменение температуры системы зависит от условий, от того имеет место V = const или р = const. Соответствующие теплоемкости обозначаются как СV или Ср.
В случае индивидуального вещества удельной теплоемкостью называется теплоемкость его 1 г, молярной – 1 моля.
Исходя из сказанного, с учетом уравнения (13)
![]() .
.
Учитывая, что
![]() ,
,
можно записать
dU = CVdT. (14)
2. Изотермический процесс, dT= 0.
С учетом уравнений (10) и (14) запишем
Q = CVdT + pdV.
Так как первое слагаемое правой части последнего уравнения равно нулю, имеем
Q=pdV
и
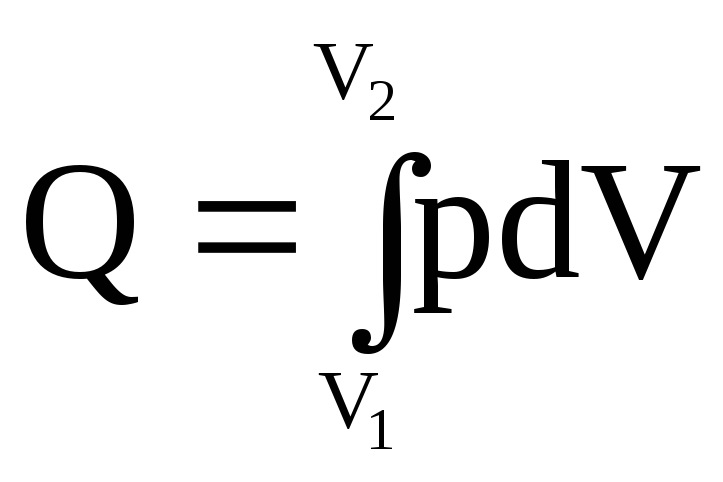 .
.
Интеграл можно взять, если известна зависимость p от V. Для 1 моля идеального газа запишем
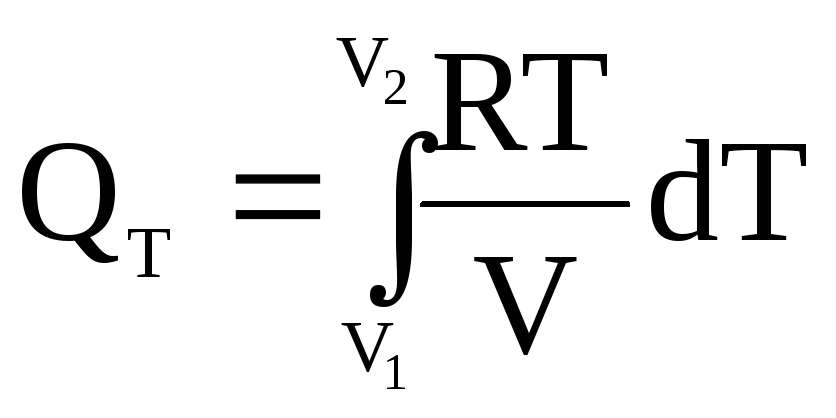
![]() . (15)
. (15)
Для n моль вещества однокомпонентной системы уравнение (15) принимает вид
![]() . (15а)
. (15а)
Так как для идеального газа действительно соотношение
![]() ,
,
то можно записать:
![]() .
.
3. Изобарический процесс, dр = 0.
![]()
и
Qp = (U2 – U1) + p(V2 – V1) (16)
Qp = (U2 +pV2) – (U1 + pV1).
Сумма U +pV (17) называется энтальпией (теплосодержанием) системы и обозначается через Н.
Тогда из уравнения (16) имеем
Qp = Н2 – Н1 = Н.
Применительно к химическим взаимодействиям изменение энтальпии равно тепловому эффекту химической реакции при постоянном объеме. Так как U и V являются функциями состояния, ей же является и энтальпия.
