
- •В.И. Вигдорович, с.В. Романцова, н.В. Шель, и.В. Зарапина
- •Оглавление
- •Предисловие
- •Часть I. Основы органической химии
- •Структура органических соединений
- •Теория строения органических соединений а.М. Бутлерова
- •Изомерия органических соединений
- •Индуктивный и мезомерный эффекты
- •Понятие о мезомерном эффекте
- •Типы реакций органических соединений. Понятие о механизме реакции
- •Типы реакций в органической химии
- •Направление и селективность химической реакции
- •Предельные (насыщенные) углеводороды
- •Изомерия алканов.Для алканов характерен один из видов структурной изомерии – изомерия углеродной цепи (строения углеродного скелета). Приведем примеры таких изомеров:
- •Физические свойства алканов
- •Физические характеристики некоторых нормальных углеводородов
- •Влияние разветвления молекул алканов на их физические характеристики
- •Химические свойства алканов
- •Некоторые отдельные представители
- •Экологическая характеристика алканов
- •Задачи по теме
- •Циклоалканы
- •Физические свойства циклоалканов
- •Получение циклоалканов
- •Химические свойства малых циклов
- •Применение циклоалканов
- •Экологическая оценка
- •Непредельные углеводороды Алкены (олефины)
- •Физические свойства олефинов
- •Получение олефиновых углеводородов
- •Химические свойства олефинов
- •Отдельные представители олефинов
- •Экологические характеристики
- •Задачи по теме
- •Алкадиены (диеновые углеводороды)
- •Методы получение диенов
- •Химические свойства диенов
- •Каучуки
- •Экологическая характеристика
- •Задачи по теме
- •Алкины (ацетиленовые углеводороды)
- •Методы получения алкинов
- •Физические свойства алкинов
- •Химические свойства алкинов
- •Экологическая характеристика
- •Задачи по теме
- •Предельные спирты
- •Предельные одноатомные спирты
- •Получение одноатомных спиртов
- •Физические свойства первичных спиртов
- •Химические свойства одноатомных спиртов
- •Отдельные представители
- •Предельные многоатомные спирты
- •Получение двухатомных спиртов
- •Получение трехатомных спиртов
- •Физические свойства многоатомных спиртов
- •Химические свойства многоатомных спиртов
- •Экологическая характеристика
- •Задачи по теме
- •Предельные оксосоединения
- •Альдегиды
- •Получение альдегидов
- •Физические свойства альдегидов
- •Химические свойства альдегидов
- •Отдельные представители
- •Экологическая характеристика
- •Получение кетонов
- •Химические свойства кетонов
- •Отдельные представители
- •Задачи по теме
- •Карбоновые кислоты
- •Электронное строение карбоксильной группы
- •Предельные карбоновые кислоты
- •Физические свойства кислот
- •Получение карбоновых кислот
- •Химические свойства карбоновых кислот
- •Свойства отдельных представителей гомологического ряда
- •Задачи по теме
- •Азотсодержащие органические соединения
- •Нитросоединения
- •Нитрилы и изоцианиды
- •Алифатические амины
- •Физические свойства аминов
- •Получение аминов
- •Химические свойства аминов
- •Отдельные представители
- •Экологическая характеристика
- •Задачи по теме
- •Аминокислоты
- •Физические свойства α-аминокислот
- •Способы получения -аминокислот
- •Способы получения -аминокислот
- •Химические свойства аминокислот
- •Отдельные представители
- •Простые и сложные эфиры Простые эфиры
- •Способы получения простых эфиров
- •Физические свойства простых эфиров
- •Химические свойства простых эфиров
- •Отдельные представители
- •Сложные эфиры карбоновых кислот Получение сложных эфиров карбоновых кислот
- •Химические свойства эфиров карбоновых кислот
- •Физические свойства жиров
- •Химические свойства жиров
- •Сложные липиды
- •Ароматические углеводороды, арены Бензол и его производные
- •Методы получения бензола и его гомологов
- •Получение гомологов бензола
- •Физические свойства аренов
- •Химические свойства
- •Экологиченские характеристики
- •Ароматические оксосоединения Фенолы
- •Некоторые физические и термодинамические характеристики ряда фенолов
- •Получение фенола
- •Некоторые химические свойства фенола
- •Задачи по теме
- •Гетероциклические соединения
- •Пятичленные гетероциклы с одним гетероатомом
- •Химические свойства пиридина
- •Диоксины
- •Физико-химические свойства ксенобиотиков типа диоксинов
- •Источники ксенобиотиков
- •Пестициды
- •Фуллерены. Синтез и свойства соединений на их основе
- •Методы получения гидридов фуллеренов
- •Кислотность фуллеренов
- •Применение фуллеренов
- •Высокомолекулярные соединения
- •Свойства высокомолекулярных соединений
- •Основные химические реакции высокомолекулярных соединений
- •Часть II основы химической термодинамики
- •Понятия и термины химической термодинамики
- •Внутренняя энергия
- •Первое началотермодинамики
- •Следствия из первого начала термодинамики
- •Теплоемкость при постоянном объеме, сv
- •Теплоемкость при постоянном давлении
- •Равновесные процессы. Максимальная работа
- •Термохимия
- •Закон Гесса
- •Следствия из закона Гесса
- •И окончательно
- •Связь h и u химических реакций
- •Зависимость тепловых эффектов от температуры. Закон Кирхгофа
- •Совершенно очевидно, что разности Сi можно выразить через уравнение
- •Средняя теплоемкость
- •Работа тепловой машины. Теорема и цикл Карно
- •Второе начало термодинамики
- •Энтропия как критерий самопроизвольного течения процесса
- •Следовательно, если такой процесс протекает в изолированной системе, то
- •Расчет энтропии
- •Расчет изменения энтропии идеального газа
- •Задачи для самостоятельного решения
- •Принцип локального равновесия
- •Важно найти функции, определяющие зависимость deSиdiSот экспериментально измеряемых величин.
- •Статистическая интерпретация энтропии
- •Химический потенциал и химическое сродство
- •Химический потенциал
- •Химическое сродство
- •Уравнение Клапейрона-Клаузиуса
- •Термодинамические потенциалы
- •Свободная энергия Гиббса
- •Для чистого вещества
- •Условия самопроизвольного протекания процесса
- •Уравнение Гиббса-Гельмгольца
- •Тепловая теорема Нернста. Третий закон термодинамики
- •Некоторые аспекты, связанные с достижением химического равновесия
- •Изотерма химической реакции
- •Изобара химической реакции
- •Задачи для самостоятельного решения
- •Задача 7.Для реакции
- •Задача 8.Для реакции
- •Задача 10.Для реакции
- •Задача 11. Для реакции
- •Литература Основная литература
- •Дополнительная литература
Отдельные представители олефинов
Этилен (этен) – бесцветный газ со слабым запахом и сладковатым вкусом. Температура воспламенения на воздухе 546С. Растворяется 0,25 объемов С2Н4в 1 объеме воды и 3,59 объемов в этаноле. Пределы взрывоопасных концентраций в воздухе: 3 об. % (нижний) – 34 об. % (верхний). Используется для получения полиэтилена (до 40 %), этанола (25 %), окиси этилена (10 %).
Пропилен (пропен). Бесцветный горючий газ со слабым запахом. Температура самовоспламенения 45,5С, пределы взрываемости в смеси с воздухом – 2,0 об. % (нижний) – 11,1 об. % (верхний). Содержится в значительных количествах в газах крекинга нефти и пиролиза нефтепродуктов.
Используется для получения изопрена
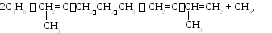
акрилонитрила (СН2=ССN), ацетальдегида, изопропилового спирта, полипропилена и др.
Экологические характеристики
В окружающую среду алкены попадают при техногенных выбросах многочисленных нефтехимических, нефтеперерабатывающих и химических предприятий, при сварочных работах, в процессах, связанных с использованием бутадиенового каучука. В воде они нестабильны, но при низких температурах сохраняются без превращения 10 суток. Обладают наркотическим действием. В силу более высокой растворимости в воде их наркотический эффект выражен сильнее, чем у предельных углеводородов.
ПДКм.р.и ПДКс.с.соответственно раны: для этилена – 3 мг/м3и 3 мг/м3; для пентена – 3 мг/м3и 3 мг/м3; для 1-пентена – 1,5 мг/м3и 1,5 мг/м3; для гексенов – 0,4 мг/м3и 0,085 мг/м3.
Запах этилена человек ощущает при С > 0,02 мг/л, быстрый наркоз от него без заметной предварительной стадии возбуждения наступает при 80 об. % в смеси с кислородом. Запах пропилена человек ощущает при С > 0,017 мг/л. При содержании С3Н6в воздухе порядка 15 об. % через 30 минут наступает потеря сознания, в присутствии 24 об. % – смерть через 3 минуты.
Задачи по теме
Задача 1.Найти массу бромалкана, полученного при взаимодействии 8,4 г алкена с избытком бромоводорода, если масса брома в молекуле продукта в 11,43 раза больше массы водорода.
Запишем уравнение реакции в общем виде.
CkH2k + HBr CkH2k+1Br
Откуда следует:
![]()
![]() ,
,
где М(Br) = 80,M(H) = 1. Тогда уточненное уравнение реакции имеет вид:
C3H6 + HBr C3H7Br.
Следовательно: n(C3H6) =n(C3H7Br);
m(C3H7Br)
= n(C3H7Br)
M(C3H7Br)
![]() ;
;
m(C3H7Br) = 24,6 г.
Задача 2.Для полного сгорания 0,448 л алкенового углеводорода (объем пересчитан на нормальные условия) потребовалось 3,84 г кислорода. Написать уравнение прошедшей реакции.
Напишем уравнение реакции в общем виде.
CkH2k+
![]() kCO2+kH2O
kCO2+kH2O
![]() n(
n(![]() =
0,02 моль;
=
0,02 моль;
![]() n(O2)
= 0,12 моль,
n(O2)
= 0,12 моль,
Vm– молярный объем любого газа при заданных условиях.
Учтем, что величина стехиометрического коэффициента перед кислородом равна отношению количеств вещества кислорода и углеводорода, принявших участие в реакции. Тогда:
![]() ;
k= 4.
;
k= 4.
Уточненное уравнение реакции имеет вид:
С4Н8+ 6О24СО2+ 4Н2О.
Задача 3.Написать уравнение реакции взаимодействия алкена с водой, если для полной гидратации 14 г исходного продукта потребовалось 3,6 г Н2О.
Запишем уравнение реакции в общем виде:
CkH2k + HОН CkH2k+1ОН.
В соответствии с ним имеем:
n(CkH2k) =n(H2O);n(H2O) =m(H2O) /M(H2O) = 3,6 / 18 = 0,2 моль.
m(CkH2k) = n(CkH2k) M(CkH2k).
Откуда:
![]() ;
;
M(CkH2k) = 70 г/моль.
Из общей формулы гомологического ряда алкенов следует:
14k= 70;k= 5.
Уточненное уравнение реакции имеет вид:
C5H10+HОНC5H11ОН.
