- •В.И. Вигдорович, с.В. Романцова, н.В. Шель, и.В. Зарапина
- •Оглавление
- •Предисловие
- •Часть I. Основы органической химии
- •Структура органических соединений
- •Теория строения органических соединений а.М. Бутлерова
- •Изомерия органических соединений
- •Индуктивный и мезомерный эффекты
- •Понятие о мезомерном эффекте
- •Типы реакций органических соединений. Понятие о механизме реакции
- •Типы реакций в органической химии
- •Направление и селективность химической реакции
- •Предельные (насыщенные) углеводороды
- •Изомерия алканов.Для алканов характерен один из видов структурной изомерии – изомерия углеродной цепи (строения углеродного скелета). Приведем примеры таких изомеров:
- •Физические свойства алканов
- •Физические характеристики некоторых нормальных углеводородов
- •Влияние разветвления молекул алканов на их физические характеристики
- •Химические свойства алканов
- •Некоторые отдельные представители
- •Экологическая характеристика алканов
- •Задачи по теме
- •Циклоалканы
- •Физические свойства циклоалканов
- •Получение циклоалканов
- •Химические свойства малых циклов
- •Применение циклоалканов
- •Экологическая оценка
- •Непредельные углеводороды Алкены (олефины)
- •Физические свойства олефинов
- •Получение олефиновых углеводородов
- •Химические свойства олефинов
- •Отдельные представители олефинов
- •Экологические характеристики
- •Задачи по теме
- •Алкадиены (диеновые углеводороды)
- •Методы получение диенов
- •Химические свойства диенов
- •Каучуки
- •Экологическая характеристика
- •Задачи по теме
- •Алкины (ацетиленовые углеводороды)
- •Методы получения алкинов
- •Физические свойства алкинов
- •Химические свойства алкинов
- •Экологическая характеристика
- •Задачи по теме
- •Предельные спирты
- •Предельные одноатомные спирты
- •Получение одноатомных спиртов
- •Физические свойства первичных спиртов
- •Химические свойства одноатомных спиртов
- •Отдельные представители
- •Предельные многоатомные спирты
- •Получение двухатомных спиртов
- •Получение трехатомных спиртов
- •Физические свойства многоатомных спиртов
- •Химические свойства многоатомных спиртов
- •Экологическая характеристика
- •Задачи по теме
- •Предельные оксосоединения
- •Альдегиды
- •Получение альдегидов
- •Физические свойства альдегидов
- •Химические свойства альдегидов
- •Отдельные представители
- •Экологическая характеристика
- •Получение кетонов
- •Химические свойства кетонов
- •Отдельные представители
- •Задачи по теме
- •Карбоновые кислоты
- •Электронное строение карбоксильной группы
- •Предельные карбоновые кислоты
- •Физические свойства кислот
- •Получение карбоновых кислот
- •Химические свойства карбоновых кислот
- •Свойства отдельных представителей гомологического ряда
- •Задачи по теме
- •Азотсодержащие органические соединения
- •Нитросоединения
- •Нитрилы и изоцианиды
- •Алифатические амины
- •Физические свойства аминов
- •Получение аминов
- •Химические свойства аминов
- •Отдельные представители
- •Экологическая характеристика
- •Задачи по теме
- •Аминокислоты
- •Физические свойства α-аминокислот
- •Способы получения -аминокислот
- •Способы получения -аминокислот
- •Химические свойства аминокислот
- •Отдельные представители
- •Простые и сложные эфиры Простые эфиры
- •Способы получения простых эфиров
- •Физические свойства простых эфиров
- •Химические свойства простых эфиров
- •Отдельные представители
- •Сложные эфиры карбоновых кислот Получение сложных эфиров карбоновых кислот
- •Химические свойства эфиров карбоновых кислот
- •Физические свойства жиров
- •Химические свойства жиров
- •Сложные липиды
- •Ароматические углеводороды, арены Бензол и его производные
- •Методы получения бензола и его гомологов
- •Получение гомологов бензола
- •Физические свойства аренов
- •Химические свойства
- •Экологиченские характеристики
- •Ароматические оксосоединения Фенолы
- •Некоторые физические и термодинамические характеристики ряда фенолов
- •Получение фенола
- •Некоторые химические свойства фенола
- •Задачи по теме
- •Гетероциклические соединения
- •Пятичленные гетероциклы с одним гетероатомом
- •Химические свойства пиридина
- •Диоксины
- •Физико-химические свойства ксенобиотиков типа диоксинов
- •Источники ксенобиотиков
- •Пестициды
- •Фуллерены. Синтез и свойства соединений на их основе
- •Методы получения гидридов фуллеренов
- •Кислотность фуллеренов
- •Применение фуллеренов
- •Высокомолекулярные соединения
- •Свойства высокомолекулярных соединений
- •Основные химические реакции высокомолекулярных соединений
- •Часть II основы химической термодинамики
- •Понятия и термины химической термодинамики
- •Внутренняя энергия
- •Первое началотермодинамики
- •Следствия из первого начала термодинамики
- •Теплоемкость при постоянном объеме, сv
- •Теплоемкость при постоянном давлении
- •Равновесные процессы. Максимальная работа
- •Термохимия
- •Закон Гесса
- •Следствия из закона Гесса
- •И окончательно
- •Связь h и u химических реакций
- •Зависимость тепловых эффектов от температуры. Закон Кирхгофа
- •Совершенно очевидно, что разности Сi можно выразить через уравнение
- •Средняя теплоемкость
- •Работа тепловой машины. Теорема и цикл Карно
- •Второе начало термодинамики
- •Энтропия как критерий самопроизвольного течения процесса
- •Следовательно, если такой процесс протекает в изолированной системе, то
- •Расчет энтропии
- •Расчет изменения энтропии идеального газа
- •Задачи для самостоятельного решения
- •Принцип локального равновесия
- •Важно найти функции, определяющие зависимость deSиdiSот экспериментально измеряемых величин.
- •Статистическая интерпретация энтропии
- •Химический потенциал и химическое сродство
- •Химический потенциал
- •Химическое сродство
- •Уравнение Клапейрона-Клаузиуса
- •Термодинамические потенциалы
- •Свободная энергия Гиббса
- •Для чистого вещества
- •Условия самопроизвольного протекания процесса
- •Уравнение Гиббса-Гельмгольца
- •Тепловая теорема Нернста. Третий закон термодинамики
- •Некоторые аспекты, связанные с достижением химического равновесия
- •Изотерма химической реакции
- •Изобара химической реакции
- •Задачи для самостоятельного решения
- •Задача 7.Для реакции
- •Задача 8.Для реакции
- •Задача 10.Для реакции
- •Задача 11. Для реакции
- •Литература Основная литература
- •Дополнительная литература
Физические свойства олефинов
Соединения С1– С4при обычных условиях газы, С5– С17– жидкости, С18и более тяжелые – твердые вещества. Некоторые физические константы этиленовых углеводородов приведены в таблице 5.
Таблица 5
Некоторые физические константы ряда олефиновых углеводородов
|
Формула |
Название |
Тпл,С |
Ткип,С |
плотность
| |
|
тривиальное |
по женевской номенклатуре | ||||
|
Н2С=СН2 |
этилен |
этен |
169,4 |
103,9 |
0,566
( |
|
СН3СН=СН2 |
пропилен |
пропен |
185,2 |
47,0 |
0,609
( |
|
СН3СН2СН=СН2 |
-бутилен |
1-бутен |
130,0 |
5,0 |
0,688
( |
|
|
изобутилен (-бутилен) |
2-метилпропен |
|
6,0 |
|
|
СН3СН2СН2СН=СН2 |
-амилен |
1-пентен |
138,0 |
29,9 |
0,640 (20С) |
|
СН3СН2СН=СНСН3 |
-амилен |
2-пентен |
139,0 |
36,4 |
0,651 |
Получение олефиновых углеводородов
В природе соединения этого класса встречается не часто. Сравнительно велико их присутствие в нефтях Канады, из них и ряда других выделены соединения от С6Н12до С13Н26.
Синтетические методы следующие.
1. Первые четыре члена гомологического ряда получают крекингом алканов. Процесс связан с разрывом СС – связей при высоких температурах (700С). Например
С7Н16![]() С4Н10+ СН3СН=СН2
С4Н10+ СН3СН=СН2
2. Дегидрогенизация предельных углеводородов

3. Дегалогенирование дигалогенпроизводных
СН3СНBrСНBrСН3+ZnСН3СН=СНСН3+ZnBr2
4. Дегидрогалогенирование (горячим спиртовым раствором щелочи)
СН3СНBrСH3+KOH![]() СН3СН=СН2+KBr+H2O
СН3СН=СН2+KBr+H2O
На примере реакции дегидрогалогенирования рассмотрим механизм реакции элиминирования.
Вообще реакции элиминирования классифицируются по признаку относительного расположения центров, от которых отщепляются группы: 1,1-, 1,2-, 1,3- элиминирование.
В реакции 1,1-элиминирования (-элиминирования) обе группы отщепляются от одного и того же атома, в результате образуются карбены:
СHCl3 :CCl2 + НCl
хлороформ дихлоркарбен хлороводород
Однако карбены не являются конечными продуктами реакции, поскольку они очень реакционноспособны. Первоначально образующийся карбен может перегруппировываться или димеризоваться в более стабильное вещество.
1,3- или -элиминирование, так же как и элиминирование от более удалённых центров, обычно даёт циклические продукты; но чем удалённее центры, тем сложнее осуществить элиминирование из-за снижения вероятности встречи реакционных центров.
Наиболее обычный из типов этой реакции – 1,2- или -элиминирование, в этом случае отщепляются группы, связанные с соседними атомами углерода и реакция приводит к образованию двойной и тройной связи:
СН3
–
СН2
–
СН2ОН
![]() СН3–СН2=СН2
+ Н2О
СН3–СН2=СН2
+ Н2О
1-пропанол пропен вода
Реакция элиминирования может быть мономолекулярной (Е1) или бимолекулярной (Е2).
Перейдём к реакции дегидрогалогенирования галогеналканов.
Третичные галогеналканы при нагревании и поляризующем воздействии диполей растворителя медленно подвергаются слабой ионизации. Образующийся при этом карбкатион быстро выталкивает протон, захватываемый присутствующим в среде основанием – гидроксид- или алкоксид-ионом (НО– или RO–). Самая медленная стадия реакции (образование карбкатиона) не зависит от реагента, поэтому реакцию называют мономолекулярной (E1):
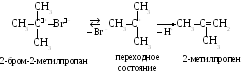
Механизм E1 характерен для третичных галогеналканов. У этих соединений связь С–Hal более полярна по сравнению со вторичными и первичными замещенными, и ионизация протекает легче. Но основная причина состоит в том, что образующийся третичный карбкатион более устойчив, чем вторичный или первичный. Стабилизация карбкатиона (компенсация положительного заряда) является следствием действия положительного индукционного эффекта алкильных радикалов вокруг третичного атома углерода, а также благодаря перекрыванию свободной р-орбитали С-атома с -орбиталями соседних С–Н – связей (эффект сверхсопряжения). Чем больше таких связей по соседству, тем более скомпенсирован заряд.
Д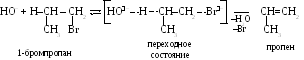 ля
первичных галогеналканов характерен
бимолекулярный механизм
элиминирования (Е2),
при котором
в решающей стадии реакции участвуют
два вещества: галогеналкан и
реагент-основание (спиртовой раствор
щелочи):
ля
первичных галогеналканов характерен
бимолекулярный механизм
элиминирования (Е2),
при котором
в решающей стадии реакции участвуют
два вещества: галогеналкан и
реагент-основание (спиртовой раствор
щелочи):
Гидроксид (алкоксид-)-ион атакует в молекуле галогеналкана водород, находящийся у соседнего с галогеном атомом углерода. Последовательное перемещение электронов -связей от гидроксид-иона в сторону галогена разрыхляет связи С–Н и С–Вr, и в возникающем переходном состоянии происходит их синхронный разрыв. Освобождающаяся электронная пара связи С–Н образует двойную связь.
Реакция элиминирования протекает в соответствии с правилом Зайцева: при дегидрогалогенировании водород отщепляется предпочтительно от соседнего, наименее гидрогенизированного атома углерода:
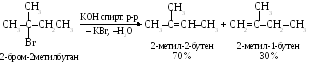
5. Очень распространено получение олефиновых углеводородов дегидратацией спиртов
СН3СН2ОH
![]() Н2С=СН2+ Н2О
Н2С=СН2+ Н2О
Порядок отщепления молекулы воды также определяется правилом Зайцева: наиболее легко отщепляется атом водорода от соседнего наименее гидрогенизированного атома углерода, соединенного с гидроксильной группой.
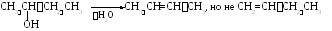
Третичные спирты дегидратируются наиболее легко.
6. Частичное гидрирование ацетиленовых углеводородов (о них речь впереди)
НССН
+ Н2![]() Н2С=СН2
Н2С=СН2