
- •В.И. Вигдорович, с.В. Романцова, н.В. Шель, и.В. Зарапина
- •Оглавление
- •Предисловие
- •Часть I. Основы органической химии
- •Структура органических соединений
- •Теория строения органических соединений а.М. Бутлерова
- •Изомерия органических соединений
- •Индуктивный и мезомерный эффекты
- •Понятие о мезомерном эффекте
- •Типы реакций органических соединений. Понятие о механизме реакции
- •Типы реакций в органической химии
- •Направление и селективность химической реакции
- •Предельные (насыщенные) углеводороды
- •Изомерия алканов.Для алканов характерен один из видов структурной изомерии – изомерия углеродной цепи (строения углеродного скелета). Приведем примеры таких изомеров:
- •Физические свойства алканов
- •Физические характеристики некоторых нормальных углеводородов
- •Влияние разветвления молекул алканов на их физические характеристики
- •Химические свойства алканов
- •Некоторые отдельные представители
- •Экологическая характеристика алканов
- •Задачи по теме
- •Циклоалканы
- •Физические свойства циклоалканов
- •Получение циклоалканов
- •Химические свойства малых циклов
- •Применение циклоалканов
- •Экологическая оценка
- •Непредельные углеводороды Алкены (олефины)
- •Физические свойства олефинов
- •Получение олефиновых углеводородов
- •Химические свойства олефинов
- •Отдельные представители олефинов
- •Экологические характеристики
- •Задачи по теме
- •Алкадиены (диеновые углеводороды)
- •Методы получение диенов
- •Химические свойства диенов
- •Каучуки
- •Экологическая характеристика
- •Задачи по теме
- •Алкины (ацетиленовые углеводороды)
- •Методы получения алкинов
- •Физические свойства алкинов
- •Химические свойства алкинов
- •Экологическая характеристика
- •Задачи по теме
- •Предельные спирты
- •Предельные одноатомные спирты
- •Получение одноатомных спиртов
- •Физические свойства первичных спиртов
- •Химические свойства одноатомных спиртов
- •Отдельные представители
- •Предельные многоатомные спирты
- •Получение двухатомных спиртов
- •Получение трехатомных спиртов
- •Физические свойства многоатомных спиртов
- •Химические свойства многоатомных спиртов
- •Экологическая характеристика
- •Задачи по теме
- •Предельные оксосоединения
- •Альдегиды
- •Получение альдегидов
- •Физические свойства альдегидов
- •Химические свойства альдегидов
- •Отдельные представители
- •Экологическая характеристика
- •Получение кетонов
- •Химические свойства кетонов
- •Отдельные представители
- •Задачи по теме
- •Карбоновые кислоты
- •Электронное строение карбоксильной группы
- •Предельные карбоновые кислоты
- •Физические свойства кислот
- •Получение карбоновых кислот
- •Химические свойства карбоновых кислот
- •Свойства отдельных представителей гомологического ряда
- •Задачи по теме
- •Азотсодержащие органические соединения
- •Нитросоединения
- •Нитрилы и изоцианиды
- •Алифатические амины
- •Физические свойства аминов
- •Получение аминов
- •Химические свойства аминов
- •Отдельные представители
- •Экологическая характеристика
- •Задачи по теме
- •Аминокислоты
- •Физические свойства α-аминокислот
- •Способы получения -аминокислот
- •Способы получения -аминокислот
- •Химические свойства аминокислот
- •Отдельные представители
- •Простые и сложные эфиры Простые эфиры
- •Способы получения простых эфиров
- •Физические свойства простых эфиров
- •Химические свойства простых эфиров
- •Отдельные представители
- •Сложные эфиры карбоновых кислот Получение сложных эфиров карбоновых кислот
- •Химические свойства эфиров карбоновых кислот
- •Физические свойства жиров
- •Химические свойства жиров
- •Сложные липиды
- •Ароматические углеводороды, арены Бензол и его производные
- •Методы получения бензола и его гомологов
- •Получение гомологов бензола
- •Физические свойства аренов
- •Химические свойства
- •Экологиченские характеристики
- •Ароматические оксосоединения Фенолы
- •Некоторые физические и термодинамические характеристики ряда фенолов
- •Получение фенола
- •Некоторые химические свойства фенола
- •Задачи по теме
- •Гетероциклические соединения
- •Пятичленные гетероциклы с одним гетероатомом
- •Химические свойства пиридина
- •Диоксины
- •Физико-химические свойства ксенобиотиков типа диоксинов
- •Источники ксенобиотиков
- •Пестициды
- •Фуллерены. Синтез и свойства соединений на их основе
- •Методы получения гидридов фуллеренов
- •Кислотность фуллеренов
- •Применение фуллеренов
- •Высокомолекулярные соединения
- •Свойства высокомолекулярных соединений
- •Основные химические реакции высокомолекулярных соединений
- •Часть II основы химической термодинамики
- •Понятия и термины химической термодинамики
- •Внутренняя энергия
- •Первое началотермодинамики
- •Следствия из первого начала термодинамики
- •Теплоемкость при постоянном объеме, сv
- •Теплоемкость при постоянном давлении
- •Равновесные процессы. Максимальная работа
- •Термохимия
- •Закон Гесса
- •Следствия из закона Гесса
- •И окончательно
- •Связь h и u химических реакций
- •Зависимость тепловых эффектов от температуры. Закон Кирхгофа
- •Совершенно очевидно, что разности Сi можно выразить через уравнение
- •Средняя теплоемкость
- •Работа тепловой машины. Теорема и цикл Карно
- •Второе начало термодинамики
- •Энтропия как критерий самопроизвольного течения процесса
- •Следовательно, если такой процесс протекает в изолированной системе, то
- •Расчет энтропии
- •Расчет изменения энтропии идеального газа
- •Задачи для самостоятельного решения
- •Принцип локального равновесия
- •Важно найти функции, определяющие зависимость deSиdiSот экспериментально измеряемых величин.
- •Статистическая интерпретация энтропии
- •Химический потенциал и химическое сродство
- •Химический потенциал
- •Химическое сродство
- •Уравнение Клапейрона-Клаузиуса
- •Термодинамические потенциалы
- •Свободная энергия Гиббса
- •Для чистого вещества
- •Условия самопроизвольного протекания процесса
- •Уравнение Гиббса-Гельмгольца
- •Тепловая теорема Нернста. Третий закон термодинамики
- •Некоторые аспекты, связанные с достижением химического равновесия
- •Изотерма химической реакции
- •Изобара химической реакции
- •Задачи для самостоятельного решения
- •Задача 7.Для реакции
- •Задача 8.Для реакции
- •Задача 10.Для реакции
- •Задача 11. Для реакции
- •Литература Основная литература
- •Дополнительная литература
Задачи по теме
Задача 1.При получении 1,3-бутадиена по методу С.В. Лебедева израсходовано 9,2 кг этилового спирта и образовалось 2,52 кг водяного пара. Рассчитать массу полученного бутадиена.
Запишем уравнение реакции.
2СН3СН2ОН![]() Н2С=СНСН=СН2+ 2Н2О + Н2,
Н2С=СНСН=СН2+ 2Н2О + Н2,
из которого следует:
n(СН3СН2ОН) =n(Н2О).
При количественном протекании процесса масса образованной воды равна:
m(Н2О) =n(Н2О)M(Н2О) =n(СН3СН2ОН)M(Н2О) =
![]() (молярная масса
взята в кг/моль).
(молярная масса
взята в кг/моль).
Полнота протекания реакции (одновременно и выход продуктов реакции) равна:
![]()
Из уравнения реакции следует:
n(C4H6) = 1/2n(СН3СН2ОН);
m(C4H6) = 0,7n(C4H6)M(C4H6) = 0,71/2n(СН3СН2ОН)M(С2Н6) =
= 0,7 0,50,254 = 3,78 кг.
Задача 2.При дегидрировании бутана массой 5,8 кг до бутадиена выделилось 0,3 кг водорода. Какова масса полученных углеводородов, если образование бутенов прошло количественно?
Первая стадия дегидрирования имеет вид:
С4Н10![]() С4Н8+ Н2. (1)
С4Н8+ Н2. (1)
Бутены С4Н8представлены двумя соединениями: 1-бутен и 2-бутен. Если процесс остановится на стадии (1), то возможно два варианта:
n(С4Н10) =n(H2) илиn(С4Н10) >n(H2).
В первом случае реакция (1) протекает количественно, во втором дегидрируется не весь бутан. Реально, исходя из условий задачи, получаем:
n(С4Н10)
=n1(С4Н8)
=n1(H2)![]() кмоль;
кмоль;
n(H2)![]() кмоль.
кмоль.
Исходя из данных задачи, n(H2) >n(С4Н10),n(H2) >n1(Н2). Следовательно, имеет место еще один процесс, являющийся источником молекулярного водорода. В соответствии с условиями задачи, таким процессом является дегидрирование бутенов:
С4Н8![]() С4Н6+ Н2. (2)
С4Н6+ Н2. (2)
Рассчитаем количество вещества водорода, полученное по реакции (2).
n2(H2) =n(H2) –n1(H2) = 0,15 – 0,10 = 0,05 кмоль.
Одновременно из уравнения реакции (2) следует:
n2(С4Н8) =n(С4Н6) =n2(H2);
m(С4Н6) =n(С4Н6)M(С4Н6) =n2(Н2)M(С4Н6) = 0,0554 = 2,7 кг (М(вещества) использована в кг/моль).
Рассчитаем суммарную массу непрореагировавших бутенов.
m(С4Н8) = [n1(С4Н8) – n2(С4Н8)]M(С4Н8) = (0,1 – 0,05)56 = 2,8 кг.
Алкины (ацетиленовые углеводороды)
Алкины содержат в молекуле тройную связь, состоящую из одной - и двух-связей. Формула гомологического рядаCnH2n-2. Простейший представитель – ацетилен С2Н2.
Атомы углерода тройной связи находятся в состоянии sp-гибридизации (2 орбитали). Такая связь прочнее двойной. Рассмотрим вопрос энергетики двойных и тройных связей более подробно. Обозначим черезUi– энергиюi-той связи.UС–С(алканы) = 331,8 кДж/моль,UС=С(олефины) = 587,9 кДж/моль. Если принять, что связи аддитивны, то есть не оказывают влияния друг на друга, то из разностиUС=С–UС–Слегко получить величинуU-связи= 256,1 кДж/моль. Таким образом,-связь существенно слабее-связи, так как 331,8 >> 256,1.
В то же время, UСС(ацетиленовые) = 830,0 кДж/моль. Тогда из тех же соображенийU-связи= (830,0 – 331,8)/2 = 249,1 кДж/моль.
Следовательно, вторая -связь алкинов несколько ослабляет первую, хотя, в целом, конечно, они равноценны. Таким образом, усредненная величина энергии-связей в алкинах меньше и они менее прочны, чем в алкенах.
Свойства тройной связи:
– атомы углерода, связанные тройной связью, имеют электроотрицательность = 2,75;
– длина СС-связи = 0,120 нм;
– валентные углы в ацетилене на основании этой модели равны 180° и молекула имеет линейную конфигурацию, что делает невозможной цис-транс-изомерию при тройной связи;
– связь сильно поляризована, т.к. в sр- гибридной форме углеродный атом сильнее удерживает электроны, чем в sр2 и sр3 - гибридных формах; следовательно; электронная пара СН-связи в молекуле ацетилена ближе к ядру С, чем в случае этилена, атом Н более подвижен, обладает слабыми кислотными свойствами (в отличие от алканов и алкенов).
Электронное строение молекулы ацетилена, для которой характерна sp-гибридизация, показано на рис. 13.

Рис. 13. Электронное строение молекулы ацетилена.
Изомерия алкинов. Для алкинов возможны два вида структурной изомерии:
– изомерия строения углеродной цепи;
– изомерия положения тройной связи.
Первые два гомолога: НССН этин (ацетилен) и Н3СССН аллилен (пропилен, пропин) не имеют изомеров.
Д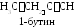 ля
С4Н6возможны два изомера
по положению тройной связи:
ля
С4Н6возможны два изомера
по положению тройной связи:
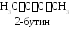
Пример изомерии строения углеродной цепи.
Н3ССНССН

СН3
3-метил-1-бутин
Номенклатура алкинов. По систематической номенклатуре алкины называют, заменяя в названии суффикс «ан» на «ин» (пропанпропин). Главная цепь должна обязательно включать тройную связь. Цепь нумеруют с конца, более близкого к тройной связи.
Н3ССССН32-бутин
н-С3Н7ССН 1-пентин
СН3ССС2Н52-пентин
