
- •В.И. Вигдорович, с.В. Романцова, н.В. Шель, и.В. Зарапина
- •Оглавление
- •Предисловие
- •Часть I. Основы органической химии
- •Структура органических соединений
- •Теория строения органических соединений а.М. Бутлерова
- •Изомерия органических соединений
- •Индуктивный и мезомерный эффекты
- •Понятие о мезомерном эффекте
- •Типы реакций органических соединений. Понятие о механизме реакции
- •Типы реакций в органической химии
- •Направление и селективность химической реакции
- •Предельные (насыщенные) углеводороды
- •Изомерия алканов.Для алканов характерен один из видов структурной изомерии – изомерия углеродной цепи (строения углеродного скелета). Приведем примеры таких изомеров:
- •Физические свойства алканов
- •Физические характеристики некоторых нормальных углеводородов
- •Влияние разветвления молекул алканов на их физические характеристики
- •Химические свойства алканов
- •Некоторые отдельные представители
- •Экологическая характеристика алканов
- •Задачи по теме
- •Циклоалканы
- •Физические свойства циклоалканов
- •Получение циклоалканов
- •Химические свойства малых циклов
- •Применение циклоалканов
- •Экологическая оценка
- •Непредельные углеводороды Алкены (олефины)
- •Физические свойства олефинов
- •Получение олефиновых углеводородов
- •Химические свойства олефинов
- •Отдельные представители олефинов
- •Экологические характеристики
- •Задачи по теме
- •Алкадиены (диеновые углеводороды)
- •Методы получение диенов
- •Химические свойства диенов
- •Каучуки
- •Экологическая характеристика
- •Задачи по теме
- •Алкины (ацетиленовые углеводороды)
- •Методы получения алкинов
- •Физические свойства алкинов
- •Химические свойства алкинов
- •Экологическая характеристика
- •Задачи по теме
- •Предельные спирты
- •Предельные одноатомные спирты
- •Получение одноатомных спиртов
- •Физические свойства первичных спиртов
- •Химические свойства одноатомных спиртов
- •Отдельные представители
- •Предельные многоатомные спирты
- •Получение двухатомных спиртов
- •Получение трехатомных спиртов
- •Физические свойства многоатомных спиртов
- •Химические свойства многоатомных спиртов
- •Экологическая характеристика
- •Задачи по теме
- •Предельные оксосоединения
- •Альдегиды
- •Получение альдегидов
- •Физические свойства альдегидов
- •Химические свойства альдегидов
- •Отдельные представители
- •Экологическая характеристика
- •Получение кетонов
- •Химические свойства кетонов
- •Отдельные представители
- •Задачи по теме
- •Карбоновые кислоты
- •Электронное строение карбоксильной группы
- •Предельные карбоновые кислоты
- •Физические свойства кислот
- •Получение карбоновых кислот
- •Химические свойства карбоновых кислот
- •Свойства отдельных представителей гомологического ряда
- •Задачи по теме
- •Азотсодержащие органические соединения
- •Нитросоединения
- •Нитрилы и изоцианиды
- •Алифатические амины
- •Физические свойства аминов
- •Получение аминов
- •Химические свойства аминов
- •Отдельные представители
- •Экологическая характеристика
- •Задачи по теме
- •Аминокислоты
- •Физические свойства α-аминокислот
- •Способы получения -аминокислот
- •Способы получения -аминокислот
- •Химические свойства аминокислот
- •Отдельные представители
- •Простые и сложные эфиры Простые эфиры
- •Способы получения простых эфиров
- •Физические свойства простых эфиров
- •Химические свойства простых эфиров
- •Отдельные представители
- •Сложные эфиры карбоновых кислот Получение сложных эфиров карбоновых кислот
- •Химические свойства эфиров карбоновых кислот
- •Физические свойства жиров
- •Химические свойства жиров
- •Сложные липиды
- •Ароматические углеводороды, арены Бензол и его производные
- •Методы получения бензола и его гомологов
- •Получение гомологов бензола
- •Физические свойства аренов
- •Химические свойства
- •Экологиченские характеристики
- •Ароматические оксосоединения Фенолы
- •Некоторые физические и термодинамические характеристики ряда фенолов
- •Получение фенола
- •Некоторые химические свойства фенола
- •Задачи по теме
- •Гетероциклические соединения
- •Пятичленные гетероциклы с одним гетероатомом
- •Химические свойства пиридина
- •Диоксины
- •Физико-химические свойства ксенобиотиков типа диоксинов
- •Источники ксенобиотиков
- •Пестициды
- •Фуллерены. Синтез и свойства соединений на их основе
- •Методы получения гидридов фуллеренов
- •Кислотность фуллеренов
- •Применение фуллеренов
- •Высокомолекулярные соединения
- •Свойства высокомолекулярных соединений
- •Основные химические реакции высокомолекулярных соединений
- •Часть II основы химической термодинамики
- •Понятия и термины химической термодинамики
- •Внутренняя энергия
- •Первое началотермодинамики
- •Следствия из первого начала термодинамики
- •Теплоемкость при постоянном объеме, сv
- •Теплоемкость при постоянном давлении
- •Равновесные процессы. Максимальная работа
- •Термохимия
- •Закон Гесса
- •Следствия из закона Гесса
- •И окончательно
- •Связь h и u химических реакций
- •Зависимость тепловых эффектов от температуры. Закон Кирхгофа
- •Совершенно очевидно, что разности Сi можно выразить через уравнение
- •Средняя теплоемкость
- •Работа тепловой машины. Теорема и цикл Карно
- •Второе начало термодинамики
- •Энтропия как критерий самопроизвольного течения процесса
- •Следовательно, если такой процесс протекает в изолированной системе, то
- •Расчет энтропии
- •Расчет изменения энтропии идеального газа
- •Задачи для самостоятельного решения
- •Принцип локального равновесия
- •Важно найти функции, определяющие зависимость deSиdiSот экспериментально измеряемых величин.
- •Статистическая интерпретация энтропии
- •Химический потенциал и химическое сродство
- •Химический потенциал
- •Химическое сродство
- •Уравнение Клапейрона-Клаузиуса
- •Термодинамические потенциалы
- •Свободная энергия Гиббса
- •Для чистого вещества
- •Условия самопроизвольного протекания процесса
- •Уравнение Гиббса-Гельмгольца
- •Тепловая теорема Нернста. Третий закон термодинамики
- •Некоторые аспекты, связанные с достижением химического равновесия
- •Изотерма химической реакции
- •Изобара химической реакции
- •Задачи для самостоятельного решения
- •Задача 7.Для реакции
- •Задача 8.Для реакции
- •Задача 10.Для реакции
- •Задача 11. Для реакции
- •Литература Основная литература
- •Дополнительная литература
Получение карбоновых кислот
Основные методы следующие.
1. Окисление первичных спиртов.
1-я стадия – образование альдегидов.
СН3СН2ОН![]() CН3СНО
CН3СНО
2-я стадия – получение целевого продукта.
CН3СНО![]() CН3СООН
CН3СООН
2. Гидролиз нитрилов.
R–CN + 2HOH R–COOH + NH3
3. Оксосинтез из непредельных углеводородов.
СН3СН=СН2+ СО + Н2О![]() CН3СН2СН2СООН
CН3СН2СН2СООН
В процессе оксосинтеза чаще всего молекулы получающихся продуктов содержат на один атом углерода больше, чем исходных веществ.
Химические свойства карбоновых кислот
1. Реакции с участиием водорода карбоксильной группы.
1.1. Некоторые кислоты существенно диссоциируют с отщеплением катиона Н+.
Н–СООН⇄НСОО+ Н+
Как отмечалось ранее, для карбоновых кислот характерны относительно высокие константы диссоциации. Для муравьиной кислоты имеем:
![]() ,
,
откуда
![]()
НСООформиат-ион; СН3СООацетат-ион.
1.2. Взаимодействие с металлами
2RCOOH + Mg (RCOO)2 Mg + H2
1.3. Взаимодействие со щелочами.
RCOOH + NaOH RCOONa + H2O
1.4. Взаимодействие с основными оксидами.
2СН3СООН +MgO(СН3СОО)2Mg+ Н2О
1.5. Взаимодействие с солями более слабых (близких по силе) кислот.
2СН3СООН + Na2CO3 2СН3СООNa + H2CO3
2. Реакции с участием карбоксильной группы.
2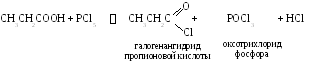 .1.
Реакции с галогенидами фосфора.
.1.
Реакции с галогенидами фосфора.
2.2. Реакции с аммиаком. При смешивании кислоты и аммиака вначале образуется соль аммония, которую затем подвергают сухой перегонке:
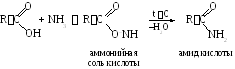
Частный случай.
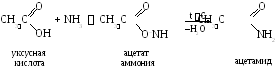
2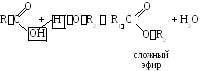 .3.
Реакции со спиртами
.3.
Реакции со спиртами
2.4. Димеризация с образованием ангидридов кислот.
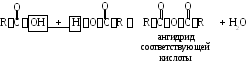
Ч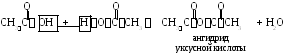 астный
случай:
астный
случай:
3. Реакции с участием водорода -углеродного атома.
3.1. Галогенирование.
Хлорирование, как частный случай галогенирования.
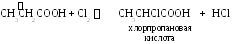
4. Реакции окисления.
НСООН + [O] HOCOOH H2O + CO2
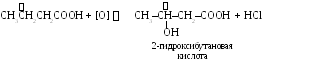
Свойства отдельных представителей гомологического ряда
Муравьиная кислота НСООН содержится в хвое, крапиве, в выделениях муравьев. Это – бесцветная жидкость с резким неприятным запахом. Вызывает ожог кожи, смешивается с водой, эфирами, спиртами в любых отношениях. d= 1,21 г/см3.
Уксусная (этановая, метилкарбоновая) кислота СН3СООН. При обычной температуре – бесцветная жидкость с резким запахом. Смешивается с водой, этанолом, диэтиловым и диметиловым эфирами, бензолом в любых отношениях. Нерастворима вCS2. Уксусная эссенция – 70–80 %-ный раствор СН3СООН. Пищевой уксус – 5 %-ный раствор. Тпл= 17С, Ткип= 118,1С,d= 1,05 г/см3. Применяется при крашении, в кожевенной промышленности, в пищевой промышленности, для получения сложных эфиров (ацетатов).
Уксусный ангидрид. Тпл=73,1С, Ткип= 139,5С. Обладает резким запахом, растворим в бензоле, диметиловом эфире, хлороформе. Дипольный момент2,82D,H2O1,84D. В больших масштабах используется для получения ацетата целлюлозы, фармацевтических препаратов.
Задачи по теме
Задача 1.Рассчитать массовую долю соли в растворе одноосновной предельной карбоновой кислоты с его исходной массой 200 г и массовой долей водорода в кислоте 8,1 %, если соль получена при поглощении раствором 5,6 л аммиака (условия нормальные).
Запишем уравнение реакции.
СkH2k+1COOH + NH3 = СkH2k+1COONH4. (1)
Установим молекулярную формулу кислоты.
![]() ;
; ![]() ;
;
200k+ 200 = 113,4k+ 372,6;![]() .
.
Уточненное уравнение реакции имеет вид:
С2H5COOH+NH3= С2H5COONH4,
из которого следует:
n(NH3) =n(С2H5COONH4);
m(С2H5COONH4) = n(С2H5COONH4) M(С2H5COONH4) =
= n(NH3) M(С2H5COONH4) =
![]() г.
г.
m(NH3) = n(NH3) M(NH3) =
![]() г.
г.
m2(раствора) =m1(раствора) +m(NH3);
m2(раствора) = 200 + 4,25 = 204,25 г.
![]() .
.
Задача 2.При взаимодействии смеси одноосновных карбоновых кислот общей массой 50 г с избытком оксида серебра выделилось 16,8 л газа (условия нормальные). Затем через полученный раствор пропустили избыток аммиака. Найти массу образовавшейся соли, если приведенная массовая доля кислорода в эквимолярной смеси кислот равна 60,4 %.
Запишем уравнение реакции взаимодействия исходных веществ с оксидом серебра, учтя, что из предельных одноосновных карбоновых кислот с ним реагирует только муравьиная кислота.
НСООН + Ag2O = CO2 + H2O + 2Ag (1)
Для остальных
СkH2k+1COOH+Ag2Oреакция не идет. (2)
С использованием уравнения реакции (1) найдем массу муравьиной кислоты:
n(НСООН) =n(CO2);m(НСООН) =n(НСООН)M(НСООН) =
= n(CO2)M(НСООН) =
![]() г.
г.
Найдем молекулярную формулу неизвестной карбоновой кислоты.
![]() ;
; ![]() ;
;
6400 = 845,6k+ 5556,8;![]() .
.
Молекулярная формула кислоты СН3СООН.
В результате взаимодействия НСООН с оксидом серебра в растворе остается только уксусная кислота, которая при взаимодействии с избытком аммиака и образует соль по уравнению реакции:
СН3СООН+NH3= СH3COONH4. (3)
m(СН3СООН) =m(смеси) –m(HCOOH) = 50 – 34,5 = 15,5 г.
Из уравнения реакции (3) имеем:
n(СН3СООН) =n(СH3COONH4);
m(СH3COONH4) = n(СH3COONH4) M(СH3COONH4) =
![]() г.
г.
