
- •В.И. Вигдорович, с.В. Романцова, н.В. Шель, и.В. Зарапина
- •Оглавление
- •Предисловие
- •Часть I. Основы органической химии
- •Структура органических соединений
- •Теория строения органических соединений а.М. Бутлерова
- •Изомерия органических соединений
- •Индуктивный и мезомерный эффекты
- •Понятие о мезомерном эффекте
- •Типы реакций органических соединений. Понятие о механизме реакции
- •Типы реакций в органической химии
- •Направление и селективность химической реакции
- •Предельные (насыщенные) углеводороды
- •Изомерия алканов.Для алканов характерен один из видов структурной изомерии – изомерия углеродной цепи (строения углеродного скелета). Приведем примеры таких изомеров:
- •Физические свойства алканов
- •Физические характеристики некоторых нормальных углеводородов
- •Влияние разветвления молекул алканов на их физические характеристики
- •Химические свойства алканов
- •Некоторые отдельные представители
- •Экологическая характеристика алканов
- •Задачи по теме
- •Циклоалканы
- •Физические свойства циклоалканов
- •Получение циклоалканов
- •Химические свойства малых циклов
- •Применение циклоалканов
- •Экологическая оценка
- •Непредельные углеводороды Алкены (олефины)
- •Физические свойства олефинов
- •Получение олефиновых углеводородов
- •Химические свойства олефинов
- •Отдельные представители олефинов
- •Экологические характеристики
- •Задачи по теме
- •Алкадиены (диеновые углеводороды)
- •Методы получение диенов
- •Химические свойства диенов
- •Каучуки
- •Экологическая характеристика
- •Задачи по теме
- •Алкины (ацетиленовые углеводороды)
- •Методы получения алкинов
- •Физические свойства алкинов
- •Химические свойства алкинов
- •Экологическая характеристика
- •Задачи по теме
- •Предельные спирты
- •Предельные одноатомные спирты
- •Получение одноатомных спиртов
- •Физические свойства первичных спиртов
- •Химические свойства одноатомных спиртов
- •Отдельные представители
- •Предельные многоатомные спирты
- •Получение двухатомных спиртов
- •Получение трехатомных спиртов
- •Физические свойства многоатомных спиртов
- •Химические свойства многоатомных спиртов
- •Экологическая характеристика
- •Задачи по теме
- •Предельные оксосоединения
- •Альдегиды
- •Получение альдегидов
- •Физические свойства альдегидов
- •Химические свойства альдегидов
- •Отдельные представители
- •Экологическая характеристика
- •Получение кетонов
- •Химические свойства кетонов
- •Отдельные представители
- •Задачи по теме
- •Карбоновые кислоты
- •Электронное строение карбоксильной группы
- •Предельные карбоновые кислоты
- •Физические свойства кислот
- •Получение карбоновых кислот
- •Химические свойства карбоновых кислот
- •Свойства отдельных представителей гомологического ряда
- •Задачи по теме
- •Азотсодержащие органические соединения
- •Нитросоединения
- •Нитрилы и изоцианиды
- •Алифатические амины
- •Физические свойства аминов
- •Получение аминов
- •Химические свойства аминов
- •Отдельные представители
- •Экологическая характеристика
- •Задачи по теме
- •Аминокислоты
- •Физические свойства α-аминокислот
- •Способы получения -аминокислот
- •Способы получения -аминокислот
- •Химические свойства аминокислот
- •Отдельные представители
- •Простые и сложные эфиры Простые эфиры
- •Способы получения простых эфиров
- •Физические свойства простых эфиров
- •Химические свойства простых эфиров
- •Отдельные представители
- •Сложные эфиры карбоновых кислот Получение сложных эфиров карбоновых кислот
- •Химические свойства эфиров карбоновых кислот
- •Физические свойства жиров
- •Химические свойства жиров
- •Сложные липиды
- •Ароматические углеводороды, арены Бензол и его производные
- •Методы получения бензола и его гомологов
- •Получение гомологов бензола
- •Физические свойства аренов
- •Химические свойства
- •Экологиченские характеристики
- •Ароматические оксосоединения Фенолы
- •Некоторые физические и термодинамические характеристики ряда фенолов
- •Получение фенола
- •Некоторые химические свойства фенола
- •Задачи по теме
- •Гетероциклические соединения
- •Пятичленные гетероциклы с одним гетероатомом
- •Химические свойства пиридина
- •Диоксины
- •Физико-химические свойства ксенобиотиков типа диоксинов
- •Источники ксенобиотиков
- •Пестициды
- •Фуллерены. Синтез и свойства соединений на их основе
- •Методы получения гидридов фуллеренов
- •Кислотность фуллеренов
- •Применение фуллеренов
- •Высокомолекулярные соединения
- •Свойства высокомолекулярных соединений
- •Основные химические реакции высокомолекулярных соединений
- •Часть II основы химической термодинамики
- •Понятия и термины химической термодинамики
- •Внутренняя энергия
- •Первое началотермодинамики
- •Следствия из первого начала термодинамики
- •Теплоемкость при постоянном объеме, сv
- •Теплоемкость при постоянном давлении
- •Равновесные процессы. Максимальная работа
- •Термохимия
- •Закон Гесса
- •Следствия из закона Гесса
- •И окончательно
- •Связь h и u химических реакций
- •Зависимость тепловых эффектов от температуры. Закон Кирхгофа
- •Совершенно очевидно, что разности Сi можно выразить через уравнение
- •Средняя теплоемкость
- •Работа тепловой машины. Теорема и цикл Карно
- •Второе начало термодинамики
- •Энтропия как критерий самопроизвольного течения процесса
- •Следовательно, если такой процесс протекает в изолированной системе, то
- •Расчет энтропии
- •Расчет изменения энтропии идеального газа
- •Задачи для самостоятельного решения
- •Принцип локального равновесия
- •Важно найти функции, определяющие зависимость deSиdiSот экспериментально измеряемых величин.
- •Статистическая интерпретация энтропии
- •Химический потенциал и химическое сродство
- •Химический потенциал
- •Химическое сродство
- •Уравнение Клапейрона-Клаузиуса
- •Термодинамические потенциалы
- •Свободная энергия Гиббса
- •Для чистого вещества
- •Условия самопроизвольного протекания процесса
- •Уравнение Гиббса-Гельмгольца
- •Тепловая теорема Нернста. Третий закон термодинамики
- •Некоторые аспекты, связанные с достижением химического равновесия
- •Изотерма химической реакции
- •Изобара химической реакции
- •Задачи для самостоятельного решения
- •Задача 7.Для реакции
- •Задача 8.Для реакции
- •Задача 10.Для реакции
- •Задача 11. Для реакции
- •Литература Основная литература
- •Дополнительная литература
Экологиченские характеристики
Загрязнение атмосферы городов летучими ароматическими соединениями связано преимущественно с автотранспортом, с переработкой нефти. Разрушаются они в атмосфере в результате биохимического окисления, в почве и воде – микроорганизмами. Быстро испаряются за счет высокого давления насыщенного пара, в результате чего для них характерен короткий период токсического действия (в частности, нефти). Эти соединения обладают сильным местным раздражающим действием, эффект снижается с ростом числа алкильных радикалов и их удлинением, но возрастает с разветвлением.
Бензол и его гомологи в условиях острого отравления поражают центральнуюб нервную систему, вызывая наркотическое действие, при значительных концентрациях – судороги и кому.
Бензол. Период его полуиспарения из водоемов 37 минут (25 С), концентрируется в пшенице, свекле. В воде подавляет жизнедеятельность позвоночных, в меньшей мере – водорослей. При С 20 мг/л гибнет рыба. У человека вызывает рост артериального давления, судороги. Основной путь поступления С6Н6 в организм человека – ингаляционный, но возможен и с питьевой водой и продуктами питания.
ПДКр.з. = 15,5 мг/м3; ПДКм.р. = 1,5 мг/м3, ПДКс.с. = 0,1 мг/м3.
Толуол. Период полуиспарения из водоемов 30 минут (25 С), в атмосфере окисляется на 50 % за 48 часов. Яд общетоксического действия, вызывает острые и хронические отравления, у него более, чем у бензола выражены наркотизирующий и раздражающий эффекты. С в табачном дыме от 40 до 400 мкг/м3, в одной сигарете – от 46 до 164 мкг толуола. ПДКр.з. = = 0,5 мг/м3; ПДКм.р. = 0,04 мг/м3, ПДКс.с. = 0,002 мг/м3, ПДКр.х. = 0,1 мг/л. Класс опасности – 3.
Ксилолы. При С > 0,87 мг/л за 3…5 минут вызывают раздражение слизистой оболочки глаз, носа. При острых отравлениях – головокружение, сердцебиение, анемия конечностей, одышка. Жидкие продукты вызывают экземы. ПДКр.з. всех ксилолов 50 мг/м3;
Ароматические оксосоединения Фенолы
Современное графическое изображение формул фенолов как вообще и всех ароматических соединений сформировалось после предложенной в 1866 г Ф. Кекуле формулы структуры молекулы бензола (показанная ранее форма I), имеющей циклическое строение. Затем с учетом представлений, связанных с обобщением -связей в его молекуле, появился вид, приведенный на рис. 15.
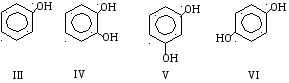
Графическая формула простейшего фенола – гидроксибензола (III). По числу гидроксильных групп в молекуле различают одно-, двух- (IV – орто, V – мета, VI – пара) и многоатомные фенолы.
Термин «фенол» происходит от старинного названия бензола «phen», введенного Лораном (1837 г), и обозначает ароматическое вещество, содержащее гидроксил, связанный непосредственно с углеродом ароматического ядра.
Некоторые его физические и термодинамические характеристики приведены в таблице 14.
Таблица 14
Некоторые физические и термодинамические характеристики ряда фенолов
|
Вещество |
Тпл, С |
Ткип, С |
d |
H |
G кДж/моль |
S |
|
Фенол |
40,9 |
181,7 |
1,057 |
164,8 (т) |
50,2 (т) |
144,0 (т) |
|
о-Крезол |
30,9 |
190,6 |
1,048 |
128,4 (г) |
37,1 (г) |
357,6 (г) |
|
м-Крезол |
72,0 |
202,1 |
1,034 |
132,2 (г) |
40,5 (г) |
356,8 (г) |
|
п-Крезол |
34,7 |
201,5 |
1,035 |
125,5 (г) |
39,1 (г) |
347,6 (г) |
|
2,3-диметилфенол |
75,0 |
218,0 |
0,932 |
157,3 (г) |
|
|
|
2,4-диметилфенол |
72,0 |
211,5 |
1,026 |
163,2 (г) |
|
|
|
2,5-диметилфенол |
74,5 |
211,5 |
1,026 |
161,9 (г) |
|
|
