
- •В.И. Вигдорович, с.В. Романцова, н.В. Шель, и.В. Зарапина
- •Оглавление
- •Предисловие
- •Часть I. Основы органической химии
- •Структура органических соединений
- •Теория строения органических соединений а.М. Бутлерова
- •Изомерия органических соединений
- •Индуктивный и мезомерный эффекты
- •Понятие о мезомерном эффекте
- •Типы реакций органических соединений. Понятие о механизме реакции
- •Типы реакций в органической химии
- •Направление и селективность химической реакции
- •Предельные (насыщенные) углеводороды
- •Изомерия алканов.Для алканов характерен один из видов структурной изомерии – изомерия углеродной цепи (строения углеродного скелета). Приведем примеры таких изомеров:
- •Физические свойства алканов
- •Физические характеристики некоторых нормальных углеводородов
- •Влияние разветвления молекул алканов на их физические характеристики
- •Химические свойства алканов
- •Некоторые отдельные представители
- •Экологическая характеристика алканов
- •Задачи по теме
- •Циклоалканы
- •Физические свойства циклоалканов
- •Получение циклоалканов
- •Химические свойства малых циклов
- •Применение циклоалканов
- •Экологическая оценка
- •Непредельные углеводороды Алкены (олефины)
- •Физические свойства олефинов
- •Получение олефиновых углеводородов
- •Химические свойства олефинов
- •Отдельные представители олефинов
- •Экологические характеристики
- •Задачи по теме
- •Алкадиены (диеновые углеводороды)
- •Методы получение диенов
- •Химические свойства диенов
- •Каучуки
- •Экологическая характеристика
- •Задачи по теме
- •Алкины (ацетиленовые углеводороды)
- •Методы получения алкинов
- •Физические свойства алкинов
- •Химические свойства алкинов
- •Экологическая характеристика
- •Задачи по теме
- •Предельные спирты
- •Предельные одноатомные спирты
- •Получение одноатомных спиртов
- •Физические свойства первичных спиртов
- •Химические свойства одноатомных спиртов
- •Отдельные представители
- •Предельные многоатомные спирты
- •Получение двухатомных спиртов
- •Получение трехатомных спиртов
- •Физические свойства многоатомных спиртов
- •Химические свойства многоатомных спиртов
- •Экологическая характеристика
- •Задачи по теме
- •Предельные оксосоединения
- •Альдегиды
- •Получение альдегидов
- •Физические свойства альдегидов
- •Химические свойства альдегидов
- •Отдельные представители
- •Экологическая характеристика
- •Получение кетонов
- •Химические свойства кетонов
- •Отдельные представители
- •Задачи по теме
- •Карбоновые кислоты
- •Электронное строение карбоксильной группы
- •Предельные карбоновые кислоты
- •Физические свойства кислот
- •Получение карбоновых кислот
- •Химические свойства карбоновых кислот
- •Свойства отдельных представителей гомологического ряда
- •Задачи по теме
- •Азотсодержащие органические соединения
- •Нитросоединения
- •Нитрилы и изоцианиды
- •Алифатические амины
- •Физические свойства аминов
- •Получение аминов
- •Химические свойства аминов
- •Отдельные представители
- •Экологическая характеристика
- •Задачи по теме
- •Аминокислоты
- •Физические свойства α-аминокислот
- •Способы получения -аминокислот
- •Способы получения -аминокислот
- •Химические свойства аминокислот
- •Отдельные представители
- •Простые и сложные эфиры Простые эфиры
- •Способы получения простых эфиров
- •Физические свойства простых эфиров
- •Химические свойства простых эфиров
- •Отдельные представители
- •Сложные эфиры карбоновых кислот Получение сложных эфиров карбоновых кислот
- •Химические свойства эфиров карбоновых кислот
- •Физические свойства жиров
- •Химические свойства жиров
- •Сложные липиды
- •Ароматические углеводороды, арены Бензол и его производные
- •Методы получения бензола и его гомологов
- •Получение гомологов бензола
- •Физические свойства аренов
- •Химические свойства
- •Экологиченские характеристики
- •Ароматические оксосоединения Фенолы
- •Некоторые физические и термодинамические характеристики ряда фенолов
- •Получение фенола
- •Некоторые химические свойства фенола
- •Задачи по теме
- •Гетероциклические соединения
- •Пятичленные гетероциклы с одним гетероатомом
- •Химические свойства пиридина
- •Диоксины
- •Физико-химические свойства ксенобиотиков типа диоксинов
- •Источники ксенобиотиков
- •Пестициды
- •Фуллерены. Синтез и свойства соединений на их основе
- •Методы получения гидридов фуллеренов
- •Кислотность фуллеренов
- •Применение фуллеренов
- •Высокомолекулярные соединения
- •Свойства высокомолекулярных соединений
- •Основные химические реакции высокомолекулярных соединений
- •Часть II основы химической термодинамики
- •Понятия и термины химической термодинамики
- •Внутренняя энергия
- •Первое началотермодинамики
- •Следствия из первого начала термодинамики
- •Теплоемкость при постоянном объеме, сv
- •Теплоемкость при постоянном давлении
- •Равновесные процессы. Максимальная работа
- •Термохимия
- •Закон Гесса
- •Следствия из закона Гесса
- •И окончательно
- •Связь h и u химических реакций
- •Зависимость тепловых эффектов от температуры. Закон Кирхгофа
- •Совершенно очевидно, что разности Сi можно выразить через уравнение
- •Средняя теплоемкость
- •Работа тепловой машины. Теорема и цикл Карно
- •Второе начало термодинамики
- •Энтропия как критерий самопроизвольного течения процесса
- •Следовательно, если такой процесс протекает в изолированной системе, то
- •Расчет энтропии
- •Расчет изменения энтропии идеального газа
- •Задачи для самостоятельного решения
- •Принцип локального равновесия
- •Важно найти функции, определяющие зависимость deSиdiSот экспериментально измеряемых величин.
- •Статистическая интерпретация энтропии
- •Химический потенциал и химическое сродство
- •Химический потенциал
- •Химическое сродство
- •Уравнение Клапейрона-Клаузиуса
- •Термодинамические потенциалы
- •Свободная энергия Гиббса
- •Для чистого вещества
- •Условия самопроизвольного протекания процесса
- •Уравнение Гиббса-Гельмгольца
- •Тепловая теорема Нернста. Третий закон термодинамики
- •Некоторые аспекты, связанные с достижением химического равновесия
- •Изотерма химической реакции
- •Изобара химической реакции
- •Задачи для самостоятельного решения
- •Задача 7.Для реакции
- •Задача 8.Для реакции
- •Задача 10.Для реакции
- •Задача 11. Для реакции
- •Литература Основная литература
- •Дополнительная литература
Методы получения алкинов
1. Действие спиртового раствора щелочи на дигалогенпроизводные и галогенпроизводные.
1.1. СН2BrCH2Br CHCH + 2HBr
1.2. СН3СН2СНCl2СН3ССН + 2HCl
2. Присоединение алкила к ацетилениду натрия или магния.
Первая стадия.
НССН +NaNH2HCCNa+NH3
амид натрия ацетиленид натрия
Вторая стадия.
HCCNa + CH3I CHCCH3 + NaI
Частные реакции.
3. Высокотемпературный крекинг метана.
2СН4CHCH+ 3Н2(14000С)
4. Гидролиз карбида кальция.
CaC2 + 2H2O CHCH + Ca(OH)2
Физические свойства алкинов
Соединения С2С4– газы, С5– С15– жидкости, С16и тяжелее – твердые вещества при стандартных условиях. Первый член гомологического ряда С2Н2– газ без запаха, цвета и вкуса, плохо растворим в воде (1,15 объема в 1 объеме Н2О). Взрывается при нагревании до 500С и одновременном повышении давления до 2 атм. Смеси с воздухом с содержанием 2,3 об. % (нижний предел) – 80,7 об. % (верхний предел) взрывоопасны (внесение искры). Применяется для получения бутандиола-1,4, тетрагидрофурана С4Н8О, бутадиена, при проведении сварочных работ (кислородно-ацетиленовая сварка). Обладает наркотическим действием.
Некоторые физические свойства ряда алкинов приведены в таблице 6.
Таблица 6
Некоторые физические свойства ряда алкинов
|
Формула |
Название |
Тпл,С |
Ткип,С |
Плотность | |
|
тривиальное |
по ИЮПАКноменклатуре | ||||
|
HCCH |
ацетилен |
этин |
81,8 |
83,6(возгоняется) |
0,620
( |
|
Н3СССН |
аллилен |
пропин |
104,7 |
23,3 |
0,678
( |
|
Н5С2ССН |
кротонилен |
1-бутин |
130,0 |
8,6 |
0,668
( |
|
Н3ССССН3 |
кротонилен |
2-бутин |
|
27,2 |
0,688( |
|
н-Н7С3СНССН |
валерилен |
1-пентин |
95 |
40 |
0,688
( |
Химические свойства алкинов
1. Реакции присоединения.
1.1. Гидрирование.
Н3СССН
+ Н2![]() Н3ССН=СН2.
Н3ССН=СН2.
Далее
Н3ССН=СН2+ Н2Н3ССН2СН3
1.2. Галогенирование.
Н3СССН +Br2Н3ССBr=СНBr
1,2-дибром-1-пропен
Н3ССBr=СНBr+ Br2Н3ССBr2СНBr2
1,1,2,2-тетрабромпропан
1.3. Взаимодействие с галогеноводородами.
HCCH + HBr H2C=CHBr
бромэтен
H2C=CHBr+HBrH3CCHBr2(по правилу Марковникова)
1.4. Гидратация.
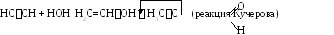
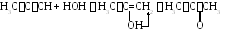
1.5. Взаимодействие со спиртами.
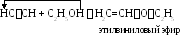
1.6. Присоединение карбоновых кислот
О
HCCH
+ СН3СООН
Н2С=СНОССН3




винилацетат
1.7. Димеризация.
HCCH + HCCH HCCCН=CH2
винилацетилен
Тримеризация.
3HCCHС6Н6
1.8. Образование ацетиленидов металлов.
2HCCH + 2Na 2HCCNa + H2
HCCH + NaNH2 HCCNa + NH3
HCCH
+ Ag2O
![]() AgCCAg
+ H2O
AgCCAg
+ H2O
1.9. Взаимодействие с кетонами.
СН3 СН3

HCCH
+ О=ССН3
HCCCСН3


ОН
2. Горение (полное окисление).
2С2Н2+ 5О24СО2+ 2Н2О
Экологическая характеристика
В организм человека алкины поступают через легкие, оказывая наркотическое действие, нарастающее с увеличением молярной массы соединений. Длительные контакты с ацетиленом в производственных условиях вызывают функциональные нарушения центральной нервной системы. При высоких концентрациях С2Н2и пониженном содержании кислорода наблюдается потеря дыхания и отек легких. Величины ПДКiв нормативных документах отсутствуют.
