
- •В.И. Вигдорович, с.В. Романцова, н.В. Шель, и.В. Зарапина
- •Оглавление
- •Предисловие
- •Часть I. Основы органической химии
- •Структура органических соединений
- •Теория строения органических соединений а.М. Бутлерова
- •Изомерия органических соединений
- •Индуктивный и мезомерный эффекты
- •Понятие о мезомерном эффекте
- •Типы реакций органических соединений. Понятие о механизме реакции
- •Типы реакций в органической химии
- •Направление и селективность химической реакции
- •Предельные (насыщенные) углеводороды
- •Изомерия алканов.Для алканов характерен один из видов структурной изомерии – изомерия углеродной цепи (строения углеродного скелета). Приведем примеры таких изомеров:
- •Физические свойства алканов
- •Физические характеристики некоторых нормальных углеводородов
- •Влияние разветвления молекул алканов на их физические характеристики
- •Химические свойства алканов
- •Некоторые отдельные представители
- •Экологическая характеристика алканов
- •Задачи по теме
- •Циклоалканы
- •Физические свойства циклоалканов
- •Получение циклоалканов
- •Химические свойства малых циклов
- •Применение циклоалканов
- •Экологическая оценка
- •Непредельные углеводороды Алкены (олефины)
- •Физические свойства олефинов
- •Получение олефиновых углеводородов
- •Химические свойства олефинов
- •Отдельные представители олефинов
- •Экологические характеристики
- •Задачи по теме
- •Алкадиены (диеновые углеводороды)
- •Методы получение диенов
- •Химические свойства диенов
- •Каучуки
- •Экологическая характеристика
- •Задачи по теме
- •Алкины (ацетиленовые углеводороды)
- •Методы получения алкинов
- •Физические свойства алкинов
- •Химические свойства алкинов
- •Экологическая характеристика
- •Задачи по теме
- •Предельные спирты
- •Предельные одноатомные спирты
- •Получение одноатомных спиртов
- •Физические свойства первичных спиртов
- •Химические свойства одноатомных спиртов
- •Отдельные представители
- •Предельные многоатомные спирты
- •Получение двухатомных спиртов
- •Получение трехатомных спиртов
- •Физические свойства многоатомных спиртов
- •Химические свойства многоатомных спиртов
- •Экологическая характеристика
- •Задачи по теме
- •Предельные оксосоединения
- •Альдегиды
- •Получение альдегидов
- •Физические свойства альдегидов
- •Химические свойства альдегидов
- •Отдельные представители
- •Экологическая характеристика
- •Получение кетонов
- •Химические свойства кетонов
- •Отдельные представители
- •Задачи по теме
- •Карбоновые кислоты
- •Электронное строение карбоксильной группы
- •Предельные карбоновые кислоты
- •Физические свойства кислот
- •Получение карбоновых кислот
- •Химические свойства карбоновых кислот
- •Свойства отдельных представителей гомологического ряда
- •Задачи по теме
- •Азотсодержащие органические соединения
- •Нитросоединения
- •Нитрилы и изоцианиды
- •Алифатические амины
- •Физические свойства аминов
- •Получение аминов
- •Химические свойства аминов
- •Отдельные представители
- •Экологическая характеристика
- •Задачи по теме
- •Аминокислоты
- •Физические свойства α-аминокислот
- •Способы получения -аминокислот
- •Способы получения -аминокислот
- •Химические свойства аминокислот
- •Отдельные представители
- •Простые и сложные эфиры Простые эфиры
- •Способы получения простых эфиров
- •Физические свойства простых эфиров
- •Химические свойства простых эфиров
- •Отдельные представители
- •Сложные эфиры карбоновых кислот Получение сложных эфиров карбоновых кислот
- •Химические свойства эфиров карбоновых кислот
- •Физические свойства жиров
- •Химические свойства жиров
- •Сложные липиды
- •Ароматические углеводороды, арены Бензол и его производные
- •Методы получения бензола и его гомологов
- •Получение гомологов бензола
- •Физические свойства аренов
- •Химические свойства
- •Экологиченские характеристики
- •Ароматические оксосоединения Фенолы
- •Некоторые физические и термодинамические характеристики ряда фенолов
- •Получение фенола
- •Некоторые химические свойства фенола
- •Задачи по теме
- •Гетероциклические соединения
- •Пятичленные гетероциклы с одним гетероатомом
- •Химические свойства пиридина
- •Диоксины
- •Физико-химические свойства ксенобиотиков типа диоксинов
- •Источники ксенобиотиков
- •Пестициды
- •Фуллерены. Синтез и свойства соединений на их основе
- •Методы получения гидридов фуллеренов
- •Кислотность фуллеренов
- •Применение фуллеренов
- •Высокомолекулярные соединения
- •Свойства высокомолекулярных соединений
- •Основные химические реакции высокомолекулярных соединений
- •Часть II основы химической термодинамики
- •Понятия и термины химической термодинамики
- •Внутренняя энергия
- •Первое началотермодинамики
- •Следствия из первого начала термодинамики
- •Теплоемкость при постоянном объеме, сv
- •Теплоемкость при постоянном давлении
- •Равновесные процессы. Максимальная работа
- •Термохимия
- •Закон Гесса
- •Следствия из закона Гесса
- •И окончательно
- •Связь h и u химических реакций
- •Зависимость тепловых эффектов от температуры. Закон Кирхгофа
- •Совершенно очевидно, что разности Сi можно выразить через уравнение
- •Средняя теплоемкость
- •Работа тепловой машины. Теорема и цикл Карно
- •Второе начало термодинамики
- •Энтропия как критерий самопроизвольного течения процесса
- •Следовательно, если такой процесс протекает в изолированной системе, то
- •Расчет энтропии
- •Расчет изменения энтропии идеального газа
- •Задачи для самостоятельного решения
- •Принцип локального равновесия
- •Важно найти функции, определяющие зависимость deSиdiSот экспериментально измеряемых величин.
- •Статистическая интерпретация энтропии
- •Химический потенциал и химическое сродство
- •Химический потенциал
- •Химическое сродство
- •Уравнение Клапейрона-Клаузиуса
- •Термодинамические потенциалы
- •Свободная энергия Гиббса
- •Для чистого вещества
- •Условия самопроизвольного протекания процесса
- •Уравнение Гиббса-Гельмгольца
- •Тепловая теорема Нернста. Третий закон термодинамики
- •Некоторые аспекты, связанные с достижением химического равновесия
- •Изотерма химической реакции
- •Изобара химической реакции
- •Задачи для самостоятельного решения
- •Задача 7.Для реакции
- •Задача 8.Для реакции
- •Задача 10.Для реакции
- •Задача 11. Для реакции
- •Литература Основная литература
- •Дополнительная литература
Химическое сродство
Пусть протекает химическая реакция
Х + У ⇄ 2Z
–dnX = –dnУ = 2dnZd
– полнота протекания реакции. d – изменение степени полноты протекания реакции. Учитывая уравнения (35) и (36), запишем:
![]() ,
,
где
![]() .
.
Для принятой или любой другой химической реакции подобного ттипа
X + У – 2ZА,
где А – химическое сродство, которое и является движущей силой химической реакции.
Если химическое сродство не равно нулю, то система находится вне термодинамического равновесия и реакция протекает до А = 0.
![]()
![]() –термодинамическая
сила,
–термодинамическая
сила,
![]() – термодинамический поток.
– термодинамический поток.
В состоянии равновесия А = 0.
Для химической реакции, записанной в наиболее общем виде
а1А1 + а2А2 + а3А3 + … + аjАj = b1B1 + b2B2 + b3B3 + … + bkBk
–a1dn(A1) = –a2dn(A2) = –a3dn(A3) = –ajdn(Aj) =
= b1dn(B1) = b2dn(B2) = b3dn(B3) = bkdn(Bk),
а химическое сродство А равно
![]() .
.
Уравнение Клапейрона-Клаузиуса
Любое индивидуальное соединение в зависимости от условий существования (температура, давление) может находиться в любом из трех агрегатных состояний (газообразное, жидкое, твердое (кристаллическое)). Мольные объемы вещества во всех фазах различны. Напомним, что мольным называется объем одного моля вещества при определенных условиях. При постоянстве давления устойчивому агрегатному состоянию (фазы) соответствует определенный температурный интервал. Причем фазе, устойчивый при более высоком интервале температур, чаще всего, но не всегда, соответствует больший мольный объем. Таким образом, хотя из этого правила имеются исключения, определяемые как аномалии. Например, объем льда больше ( на 10 %) объема жидкой воды. Но при переходе к парообразному состоянию Н2О все встает на свои места, то есть указанная аномалия исчезает.
Пусть некоторое вещество находится в замкнутом пространстве с постоянным объемом и существует в двух фазах, находящихся в равновесии (1 = 2). Такими бинарными системами могут быть:
– жидкость и ее насыщенный пар (Ж/П);
– жидкость и кристаллическая (твердая) фаза (Ж/Т);
– кристаллы и пар (Т/П).
При нагревании подобных систем внутри них повышается давление. В случае системы Ж/Т и Т/Ж это связано со стремлением одной фазы перейти в другую, повышая при этом свой молярный или удельный (в расчете на 1 г) объем. Естественно при V = const это вызывает рост р.
Зависимость p = f(T) подобных систем описывается уравнением Клаузиуса-Клайперона.
![]() ,
,
– теплота фазового перехода, Т – его температура, V1 и V2 – объемы исходной и конечной фаз (мольный или удельный, в зависимости от типа ). В небольших температурных интервалах можно принять, что величины , V1 и V2 не зависят от температуры, тогда можно записать:
![]() , (37)
, (37)
получив уравнение, используемое для расчетов. Приведем пример подобного рода.
Задача 1. Найти давление, развиваемое водой при переходе ее в лед в замкнутом объеме (например, трубе), если Т = –2, = 334 Дж г–1, Vуд(ж) = 1 см3, Vуд(льда) = 1,1 см3.
Учтем, что температура фазового перехода в рассматриваемом случае равна 273 К, Т = –2С. Для р действительна зависимость
![]() ;
; ![]() ;р
= 24 МПа;
;р
= 24 МПа;
10–6 – коэффициент перехода от см3 к м3.
В том случае, когда
рассматривается равновесие в системе
Ж/П или Т/П, в уравнении (37) V1
можно пренебречь, так как V2
>> V1.
Примем вновь, что
не зависит от Т. Заменяя
![]() на
на![]() ,
так как иные переменные, кроме объема
не рассматриваются, получим
,
так как иные переменные, кроме объема
не рассматриваются, получим
![]() ,
,
– соответствующая теплота испарения при температуре кипения Т.
Введем еще одно уравнение. Примем, что пар подчиняется уравнению Менделеева-Клапейрона. Тогда V = RT/p и
![]()
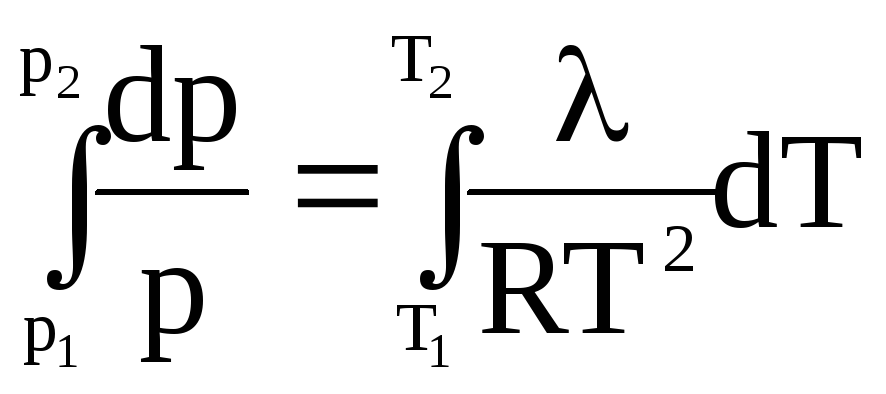
![]()
или
![]() . (38)
. (38)
В расчетах по последнему уравнению следует использовать температурный интервал не более 20 .
Задача 2. Вычислить теплоту испарения озона, если давление его насыщенного пара при 104 К составляет 640,3 Па, а при 120 К равно 4535,6 Па.
Используем уравнение (38).
![]() ;
;
![]() ;
;
= 14702 Дж/моль.
