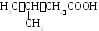- •В.И. Вигдорович, с.В. Романцова, н.В. Шель, и.В. Зарапина
- •Оглавление
- •Предисловие
- •Часть I. Основы органической химии
- •Структура органических соединений
- •Теория строения органических соединений а.М. Бутлерова
- •Изомерия органических соединений
- •Индуктивный и мезомерный эффекты
- •Понятие о мезомерном эффекте
- •Типы реакций органических соединений. Понятие о механизме реакции
- •Типы реакций в органической химии
- •Направление и селективность химической реакции
- •Предельные (насыщенные) углеводороды
- •Изомерия алканов.Для алканов характерен один из видов структурной изомерии – изомерия углеродной цепи (строения углеродного скелета). Приведем примеры таких изомеров:
- •Физические свойства алканов
- •Физические характеристики некоторых нормальных углеводородов
- •Влияние разветвления молекул алканов на их физические характеристики
- •Химические свойства алканов
- •Некоторые отдельные представители
- •Экологическая характеристика алканов
- •Задачи по теме
- •Циклоалканы
- •Физические свойства циклоалканов
- •Получение циклоалканов
- •Химические свойства малых циклов
- •Применение циклоалканов
- •Экологическая оценка
- •Непредельные углеводороды Алкены (олефины)
- •Физические свойства олефинов
- •Получение олефиновых углеводородов
- •Химические свойства олефинов
- •Отдельные представители олефинов
- •Экологические характеристики
- •Задачи по теме
- •Алкадиены (диеновые углеводороды)
- •Методы получение диенов
- •Химические свойства диенов
- •Каучуки
- •Экологическая характеристика
- •Задачи по теме
- •Алкины (ацетиленовые углеводороды)
- •Методы получения алкинов
- •Физические свойства алкинов
- •Химические свойства алкинов
- •Экологическая характеристика
- •Задачи по теме
- •Предельные спирты
- •Предельные одноатомные спирты
- •Получение одноатомных спиртов
- •Физические свойства первичных спиртов
- •Химические свойства одноатомных спиртов
- •Отдельные представители
- •Предельные многоатомные спирты
- •Получение двухатомных спиртов
- •Получение трехатомных спиртов
- •Физические свойства многоатомных спиртов
- •Химические свойства многоатомных спиртов
- •Экологическая характеристика
- •Задачи по теме
- •Предельные оксосоединения
- •Альдегиды
- •Получение альдегидов
- •Физические свойства альдегидов
- •Химические свойства альдегидов
- •Отдельные представители
- •Экологическая характеристика
- •Получение кетонов
- •Химические свойства кетонов
- •Отдельные представители
- •Задачи по теме
- •Карбоновые кислоты
- •Электронное строение карбоксильной группы
- •Предельные карбоновые кислоты
- •Физические свойства кислот
- •Получение карбоновых кислот
- •Химические свойства карбоновых кислот
- •Свойства отдельных представителей гомологического ряда
- •Задачи по теме
- •Азотсодержащие органические соединения
- •Нитросоединения
- •Нитрилы и изоцианиды
- •Алифатические амины
- •Физические свойства аминов
- •Получение аминов
- •Химические свойства аминов
- •Отдельные представители
- •Экологическая характеристика
- •Задачи по теме
- •Аминокислоты
- •Физические свойства α-аминокислот
- •Способы получения -аминокислот
- •Способы получения -аминокислот
- •Химические свойства аминокислот
- •Отдельные представители
- •Простые и сложные эфиры Простые эфиры
- •Способы получения простых эфиров
- •Физические свойства простых эфиров
- •Химические свойства простых эфиров
- •Отдельные представители
- •Сложные эфиры карбоновых кислот Получение сложных эфиров карбоновых кислот
- •Химические свойства эфиров карбоновых кислот
- •Физические свойства жиров
- •Химические свойства жиров
- •Сложные липиды
- •Ароматические углеводороды, арены Бензол и его производные
- •Методы получения бензола и его гомологов
- •Получение гомологов бензола
- •Физические свойства аренов
- •Химические свойства
- •Экологиченские характеристики
- •Ароматические оксосоединения Фенолы
- •Некоторые физические и термодинамические характеристики ряда фенолов
- •Получение фенола
- •Некоторые химические свойства фенола
- •Задачи по теме
- •Гетероциклические соединения
- •Пятичленные гетероциклы с одним гетероатомом
- •Химические свойства пиридина
- •Диоксины
- •Физико-химические свойства ксенобиотиков типа диоксинов
- •Источники ксенобиотиков
- •Пестициды
- •Фуллерены. Синтез и свойства соединений на их основе
- •Методы получения гидридов фуллеренов
- •Кислотность фуллеренов
- •Применение фуллеренов
- •Высокомолекулярные соединения
- •Свойства высокомолекулярных соединений
- •Основные химические реакции высокомолекулярных соединений
- •Часть II основы химической термодинамики
- •Понятия и термины химической термодинамики
- •Внутренняя энергия
- •Первое началотермодинамики
- •Следствия из первого начала термодинамики
- •Теплоемкость при постоянном объеме, сv
- •Теплоемкость при постоянном давлении
- •Равновесные процессы. Максимальная работа
- •Термохимия
- •Закон Гесса
- •Следствия из закона Гесса
- •И окончательно
- •Связь h и u химических реакций
- •Зависимость тепловых эффектов от температуры. Закон Кирхгофа
- •Совершенно очевидно, что разности Сi можно выразить через уравнение
- •Средняя теплоемкость
- •Работа тепловой машины. Теорема и цикл Карно
- •Второе начало термодинамики
- •Энтропия как критерий самопроизвольного течения процесса
- •Следовательно, если такой процесс протекает в изолированной системе, то
- •Расчет энтропии
- •Расчет изменения энтропии идеального газа
- •Задачи для самостоятельного решения
- •Принцип локального равновесия
- •Важно найти функции, определяющие зависимость deSиdiSот экспериментально измеряемых величин.
- •Статистическая интерпретация энтропии
- •Химический потенциал и химическое сродство
- •Химический потенциал
- •Химическое сродство
- •Уравнение Клапейрона-Клаузиуса
- •Термодинамические потенциалы
- •Свободная энергия Гиббса
- •Для чистого вещества
- •Условия самопроизвольного протекания процесса
- •Уравнение Гиббса-Гельмгольца
- •Тепловая теорема Нернста. Третий закон термодинамики
- •Некоторые аспекты, связанные с достижением химического равновесия
- •Изотерма химической реакции
- •Изобара химической реакции
- •Задачи для самостоятельного решения
- •Задача 7.Для реакции
- •Задача 8.Для реакции
- •Задача 10.Для реакции
- •Задача 11. Для реакции
- •Литература Основная литература
- •Дополнительная литература
Карбоновые кислоты
К арбоновые
кислоты характеризуются наличием одной
(одноосновные) или нескольких
(многоосновные) функциональных
карбоксильных групп.
арбоновые
кислоты характеризуются наличием одной
(одноосновные) или нескольких
(многоосновные) функциональных
карбоксильных групп.
Они могут быть предельными (насыщенными) – функциональная группа связана с алкилом и непредельные (ненасыщенные) – соответствующая группа связана с непредельным радикалом. Общая формула насыщенных кислот СnH2n+2-m(COOH)m.
Если m= 1, имеет место одноосновная кислота, СnH2n+1(COOH),m= 2двухосновная СnH2n(COOH)2и т. д. Если в углеводородном радикале имеетсяkдвойных связей, то общая формула карбоновых кислот будет иметь вид СnH2n+2-2k-m(COOH)m.
Электронное строение карбоксильной группы
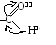
– дробный заряд в единицах заряда электрона.
В силу сдвига электронной пары с ростом + ослабляется связьОН, повышается подвижность атома водорода гидроксильной группы и сила кислоты (ее константа электролитической диссоциации, которую часто называют константой кислотности Ка).
Ка(НСООН) = 1,77104;
Ка(СН3СООН) = 1,8105;
Ка(СН3СН2СООН) = 1,34105;
Ка(СН3(СН2)2СООН) = 1,52105.
Таким образом, величина + на карбоксильном углероде имеет тенденцию к снижению по мере возрастания длины углеводородного радикала в результате влияния положительного индуктивного эффекта алкильного радикала.
Предельные карбоновые кислоты
Номенклатура предельных карбоновых кислот. По номенклатуре ИЮПАК:
1. Карбоксильная группа обозначается суффиксом «-овая».
2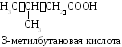 .
Атом углерода карбоксильной группы
включают в основную цепь и с него
начинается нумерация.
.
Атом углерода карбоксильной группы
включают в основную цепь и с него
начинается нумерация.
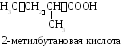
Изомерия одноосновных предельных карбоновых кислот. Для карбоновых кислот возможны все виды изомерии. Кислоты С1– С3не имеют изомеров по строению углеродного радикала. Изомерия по положению карбоксильной группы невозможна для моно- и дикарбоновых кислот. Для всех кислот, кроме муравьиной, характерна изомерия по функциональной группе (межклассовым изомером являются сложные эфиры).
Физические свойства кислот
Рассмотрим некоторые
физические свойства ряда СnH2n+1COOH.
Низшие представители – подвижные
жидкости (обычные условия). Далее, начиная
с С5– маслянистые жидкости, высшие
кислоты – твердые вещества
(с С16– пальмитиновая или гексадекановая).
П ростейшие
представители (НСООН, СН3СООН)
хорошо растворимы в воде, смешиваются
с ней в любых отношениях, высшие в Н2О
не растворяются, первые члены
гомологического ряда – обладают резким
запахом. Молекулы кислот образуют
ассоциаты за счет Н-связей, которые
более прочны, чем у спиртов.
ростейшие
представители (НСООН, СН3СООН)
хорошо растворимы в воде, смешиваются
с ней в любых отношениях, высшие в Н2О
не растворяются, первые члены
гомологического ряда – обладают резким
запахом. Молекулы кислот образуют
ассоциаты за счет Н-связей, которые
более прочны, чем у спиртов.
Физические свойства ряда одноосновных кислот приведены ниже (таблица 10).
Таблица 10
Физические свойства ряда одноосновных карбоновых кислот
|
Формула |
Название |
Тпл,С |
Ткип,С |
Ка | |
|
по систематической номенклатуре |
по тривиальной номенклатуре | ||||
|
НСООН |
метановая |
муравьиная |
8,4 |
100,7 |
1,77 104 |
|
СН3СООН |
этановая |
уксусная |
16,6 |
118,1 |
1,76 105 |
|
СН3СН2СООН |
пропановая |
пропионовая |
22,0 |
141,1 |
1,34 105 |
|
СН3СН2СН2СООН |
бутановая |
масляная |
7,9 |
163,5 |
1,54 105 |
|
|
2-метилпропановая |
масляная |
47 |
154,4 |
1,44 105 |
|
СН3СН2СН2СН2СООН |
пентановая |
валериановая |
59 |
187,0 |
1,51 105 |
|
|
3-метилбутановая |
валериановая |
37,6 |
176,7 |
1,70 105 |