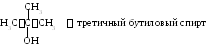- •В.И. Вигдорович, с.В. Романцова, н.В. Шель, и.В. Зарапина
- •Оглавление
- •Предисловие
- •Часть I. Основы органической химии
- •Структура органических соединений
- •Теория строения органических соединений а.М. Бутлерова
- •Изомерия органических соединений
- •Индуктивный и мезомерный эффекты
- •Понятие о мезомерном эффекте
- •Типы реакций органических соединений. Понятие о механизме реакции
- •Типы реакций в органической химии
- •Направление и селективность химической реакции
- •Предельные (насыщенные) углеводороды
- •Изомерия алканов.Для алканов характерен один из видов структурной изомерии – изомерия углеродной цепи (строения углеродного скелета). Приведем примеры таких изомеров:
- •Физические свойства алканов
- •Физические характеристики некоторых нормальных углеводородов
- •Влияние разветвления молекул алканов на их физические характеристики
- •Химические свойства алканов
- •Некоторые отдельные представители
- •Экологическая характеристика алканов
- •Задачи по теме
- •Циклоалканы
- •Физические свойства циклоалканов
- •Получение циклоалканов
- •Химические свойства малых циклов
- •Применение циклоалканов
- •Экологическая оценка
- •Непредельные углеводороды Алкены (олефины)
- •Физические свойства олефинов
- •Получение олефиновых углеводородов
- •Химические свойства олефинов
- •Отдельные представители олефинов
- •Экологические характеристики
- •Задачи по теме
- •Алкадиены (диеновые углеводороды)
- •Методы получение диенов
- •Химические свойства диенов
- •Каучуки
- •Экологическая характеристика
- •Задачи по теме
- •Алкины (ацетиленовые углеводороды)
- •Методы получения алкинов
- •Физические свойства алкинов
- •Химические свойства алкинов
- •Экологическая характеристика
- •Задачи по теме
- •Предельные спирты
- •Предельные одноатомные спирты
- •Получение одноатомных спиртов
- •Физические свойства первичных спиртов
- •Химические свойства одноатомных спиртов
- •Отдельные представители
- •Предельные многоатомные спирты
- •Получение двухатомных спиртов
- •Получение трехатомных спиртов
- •Физические свойства многоатомных спиртов
- •Химические свойства многоатомных спиртов
- •Экологическая характеристика
- •Задачи по теме
- •Предельные оксосоединения
- •Альдегиды
- •Получение альдегидов
- •Физические свойства альдегидов
- •Химические свойства альдегидов
- •Отдельные представители
- •Экологическая характеристика
- •Получение кетонов
- •Химические свойства кетонов
- •Отдельные представители
- •Задачи по теме
- •Карбоновые кислоты
- •Электронное строение карбоксильной группы
- •Предельные карбоновые кислоты
- •Физические свойства кислот
- •Получение карбоновых кислот
- •Химические свойства карбоновых кислот
- •Свойства отдельных представителей гомологического ряда
- •Задачи по теме
- •Азотсодержащие органические соединения
- •Нитросоединения
- •Нитрилы и изоцианиды
- •Алифатические амины
- •Физические свойства аминов
- •Получение аминов
- •Химические свойства аминов
- •Отдельные представители
- •Экологическая характеристика
- •Задачи по теме
- •Аминокислоты
- •Физические свойства α-аминокислот
- •Способы получения -аминокислот
- •Способы получения -аминокислот
- •Химические свойства аминокислот
- •Отдельные представители
- •Простые и сложные эфиры Простые эфиры
- •Способы получения простых эфиров
- •Физические свойства простых эфиров
- •Химические свойства простых эфиров
- •Отдельные представители
- •Сложные эфиры карбоновых кислот Получение сложных эфиров карбоновых кислот
- •Химические свойства эфиров карбоновых кислот
- •Физические свойства жиров
- •Химические свойства жиров
- •Сложные липиды
- •Ароматические углеводороды, арены Бензол и его производные
- •Методы получения бензола и его гомологов
- •Получение гомологов бензола
- •Физические свойства аренов
- •Химические свойства
- •Экологиченские характеристики
- •Ароматические оксосоединения Фенолы
- •Некоторые физические и термодинамические характеристики ряда фенолов
- •Получение фенола
- •Некоторые химические свойства фенола
- •Задачи по теме
- •Гетероциклические соединения
- •Пятичленные гетероциклы с одним гетероатомом
- •Химические свойства пиридина
- •Диоксины
- •Физико-химические свойства ксенобиотиков типа диоксинов
- •Источники ксенобиотиков
- •Пестициды
- •Фуллерены. Синтез и свойства соединений на их основе
- •Методы получения гидридов фуллеренов
- •Кислотность фуллеренов
- •Применение фуллеренов
- •Высокомолекулярные соединения
- •Свойства высокомолекулярных соединений
- •Основные химические реакции высокомолекулярных соединений
- •Часть II основы химической термодинамики
- •Понятия и термины химической термодинамики
- •Внутренняя энергия
- •Первое началотермодинамики
- •Следствия из первого начала термодинамики
- •Теплоемкость при постоянном объеме, сv
- •Теплоемкость при постоянном давлении
- •Равновесные процессы. Максимальная работа
- •Термохимия
- •Закон Гесса
- •Следствия из закона Гесса
- •И окончательно
- •Связь h и u химических реакций
- •Зависимость тепловых эффектов от температуры. Закон Кирхгофа
- •Совершенно очевидно, что разности Сi можно выразить через уравнение
- •Средняя теплоемкость
- •Работа тепловой машины. Теорема и цикл Карно
- •Второе начало термодинамики
- •Энтропия как критерий самопроизвольного течения процесса
- •Следовательно, если такой процесс протекает в изолированной системе, то
- •Расчет энтропии
- •Расчет изменения энтропии идеального газа
- •Задачи для самостоятельного решения
- •Принцип локального равновесия
- •Важно найти функции, определяющие зависимость deSиdiSот экспериментально измеряемых величин.
- •Статистическая интерпретация энтропии
- •Химический потенциал и химическое сродство
- •Химический потенциал
- •Химическое сродство
- •Уравнение Клапейрона-Клаузиуса
- •Термодинамические потенциалы
- •Свободная энергия Гиббса
- •Для чистого вещества
- •Условия самопроизвольного протекания процесса
- •Уравнение Гиббса-Гельмгольца
- •Тепловая теорема Нернста. Третий закон термодинамики
- •Некоторые аспекты, связанные с достижением химического равновесия
- •Изотерма химической реакции
- •Изобара химической реакции
- •Задачи для самостоятельного решения
- •Задача 7.Для реакции
- •Задача 8.Для реакции
- •Задача 10.Для реакции
- •Задача 11. Для реакции
- •Литература Основная литература
- •Дополнительная литература
Задачи по теме
Задача 1.При количественном гидрировании 13 г ацетилена общая масса продуктов взаимодействия увеличилась на 1,3 г. Какие вещества и в каком количестве образовались в процессе гидрирования?
Гидрирование ацетилена протекает в две стадии с последовательным образованием этилена (1-я стадия) и этана.
Запишем уравнения реакций:
С2Н2+
Н2![]() С2Н4(1)
С2Н4(1)
С2Н4+
Н2![]() С2Н6(2)
С2Н6(2)
Рассчитаем количества веществ исходных соединений, принявших участие в суммарном процессе:
![]() моль;
моль;
![]() моль.
моль.
По отношению к
реакции (1) имеем:
![]() и, следовательно, молекулярный водород
находится в избытке. Ацетилен полностью
прореагирует в реакции (1). Это позволяет
оценить количество вещества
прореагировавшего водорода и полученного
этилена.
и, следовательно, молекулярный водород
находится в избытке. Ацетилен полностью
прореагирует в реакции (1). Это позволяет
оценить количество вещества
прореагировавшего водорода и полученного
этилена.
n1(H2) = n(C2H2) = n1(C2H4) = 0,5 моль.
Непрореагировавшее количество вещества водорода, которое примет участие в реакции (2), равно:
n2(H2) =n(H2) –n1(H2) = 0,65 – 0,50 = 0,15 моль.
Для реакции (2) действительно неравенство:
![]() .
.
Следовательно, этилен находится в избытке. Водород прореагирует полностью. Количество вещества оставшегося этилена и образовавшегося этана равны:
n2(С2H4) =n1(С2H4) –n2(H2) = 0,50 – 0,15 = 0,35 моль.
Одновременно
n(С2H6) =n2(H2).
Теперь не трудно найти массы этилена и этана, окончательно образовавшихся в процессе протекания последовательных реакций (1) и (2).
m(С2H4) =n2(С2H4)M(С2H4) = 0,3528 = 9,8 г.
m(С2H6) =n(С2H6)M(С2H6) =n2(H2)M(С2H6) = 0,1530 = 4,5 г.
Задача 2.Для получения ацетилена израсходовано 100 л метана. Найти объем полученного ацетилена и суммарный объем (при неизменных условиях протекания реакции) образовавшейся газовой смеси, если метан прореагировал количественно.
Запишем уравнение реакции:
2СН4![]() С2Н2+ 3Н2,
С2Н2+ 3Н2,
согласно которого из двух объемов метана образуется один объем ацетилена и четыре объема газовой смеси. Следовательно, имеем:
![]() л,
л,
V(С2Н2+H2) = 2V(СН4) = 2100 = 200 л.
Задача 3.Для получения ацетилена использовано 100 л метана, глубина превращения которого составила 80 %. Определить объемы полученного ацетилена и образовавшейся газовой смеси, приняв неизменными давление и температуру до и после реакции.
Запишем уравнение реакции:
2СН4![]() С2Н2+ 3Н2.
С2Н2+ 3Н2.
Объем метана, претерпевший превращение, равен:
V1(СН4) = 0,8V(СН4) = 0,8100 = 80 л.
Согласно уравнения реакции, из двух объемов СН4образуется один объем С2Н2и три объема Н2, следовательно:
V(С2Н2) = 1/2V1(СН4) = 1/280 = 40 л.
V(H2) = 3/2V1(СН4) = 3/280 = 120 л.
Общий объем конечной смеси равен
V1(смеси) = 20 л + 40 л + 120 л = 180 л.
Предельные спирты
Спирты (алкоголи) – органические соединения, которые содержат в молекуле одну или несколько гидроксильных групп, связанных непосредственно с углеводородным радикалом. Ранее отмечалось, что их нужно рассматривать как производные алканов, в которых атомы водорода заменены группами ОН. Общая формула гомологического ряда подобных предельных одноатомных спиртов – СnH2n+1OH, многоатомных – СnH2n+2m(OH)m, гдеm– атомность спирта. Спирты, в том числе и одноатомные, делятся на первичные, вторичные и третичные. Из приведенных ниже примеров легко понять основы такой классификации.
Н3ССН2СН2СН2ОНпервичный бутиловый спирт, в котором гидроксильная группа связана с первичным углеродным атомом.