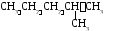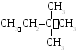- •В.И. Вигдорович, с.В. Романцова, н.В. Шель, и.В. Зарапина
- •Оглавление
- •Предисловие
- •Часть I. Основы органической химии
- •Структура органических соединений
- •Теория строения органических соединений а.М. Бутлерова
- •Изомерия органических соединений
- •Индуктивный и мезомерный эффекты
- •Понятие о мезомерном эффекте
- •Типы реакций органических соединений. Понятие о механизме реакции
- •Типы реакций в органической химии
- •Направление и селективность химической реакции
- •Предельные (насыщенные) углеводороды
- •Изомерия алканов.Для алканов характерен один из видов структурной изомерии – изомерия углеродной цепи (строения углеродного скелета). Приведем примеры таких изомеров:
- •Физические свойства алканов
- •Физические характеристики некоторых нормальных углеводородов
- •Влияние разветвления молекул алканов на их физические характеристики
- •Химические свойства алканов
- •Некоторые отдельные представители
- •Экологическая характеристика алканов
- •Задачи по теме
- •Циклоалканы
- •Физические свойства циклоалканов
- •Получение циклоалканов
- •Химические свойства малых циклов
- •Применение циклоалканов
- •Экологическая оценка
- •Непредельные углеводороды Алкены (олефины)
- •Физические свойства олефинов
- •Получение олефиновых углеводородов
- •Химические свойства олефинов
- •Отдельные представители олефинов
- •Экологические характеристики
- •Задачи по теме
- •Алкадиены (диеновые углеводороды)
- •Методы получение диенов
- •Химические свойства диенов
- •Каучуки
- •Экологическая характеристика
- •Задачи по теме
- •Алкины (ацетиленовые углеводороды)
- •Методы получения алкинов
- •Физические свойства алкинов
- •Химические свойства алкинов
- •Экологическая характеристика
- •Задачи по теме
- •Предельные спирты
- •Предельные одноатомные спирты
- •Получение одноатомных спиртов
- •Физические свойства первичных спиртов
- •Химические свойства одноатомных спиртов
- •Отдельные представители
- •Предельные многоатомные спирты
- •Получение двухатомных спиртов
- •Получение трехатомных спиртов
- •Физические свойства многоатомных спиртов
- •Химические свойства многоатомных спиртов
- •Экологическая характеристика
- •Задачи по теме
- •Предельные оксосоединения
- •Альдегиды
- •Получение альдегидов
- •Физические свойства альдегидов
- •Химические свойства альдегидов
- •Отдельные представители
- •Экологическая характеристика
- •Получение кетонов
- •Химические свойства кетонов
- •Отдельные представители
- •Задачи по теме
- •Карбоновые кислоты
- •Электронное строение карбоксильной группы
- •Предельные карбоновые кислоты
- •Физические свойства кислот
- •Получение карбоновых кислот
- •Химические свойства карбоновых кислот
- •Свойства отдельных представителей гомологического ряда
- •Задачи по теме
- •Азотсодержащие органические соединения
- •Нитросоединения
- •Нитрилы и изоцианиды
- •Алифатические амины
- •Физические свойства аминов
- •Получение аминов
- •Химические свойства аминов
- •Отдельные представители
- •Экологическая характеристика
- •Задачи по теме
- •Аминокислоты
- •Физические свойства α-аминокислот
- •Способы получения -аминокислот
- •Способы получения -аминокислот
- •Химические свойства аминокислот
- •Отдельные представители
- •Простые и сложные эфиры Простые эфиры
- •Способы получения простых эфиров
- •Физические свойства простых эфиров
- •Химические свойства простых эфиров
- •Отдельные представители
- •Сложные эфиры карбоновых кислот Получение сложных эфиров карбоновых кислот
- •Химические свойства эфиров карбоновых кислот
- •Физические свойства жиров
- •Химические свойства жиров
- •Сложные липиды
- •Ароматические углеводороды, арены Бензол и его производные
- •Методы получения бензола и его гомологов
- •Получение гомологов бензола
- •Физические свойства аренов
- •Химические свойства
- •Экологиченские характеристики
- •Ароматические оксосоединения Фенолы
- •Некоторые физические и термодинамические характеристики ряда фенолов
- •Получение фенола
- •Некоторые химические свойства фенола
- •Задачи по теме
- •Гетероциклические соединения
- •Пятичленные гетероциклы с одним гетероатомом
- •Химические свойства пиридина
- •Диоксины
- •Физико-химические свойства ксенобиотиков типа диоксинов
- •Источники ксенобиотиков
- •Пестициды
- •Фуллерены. Синтез и свойства соединений на их основе
- •Методы получения гидридов фуллеренов
- •Кислотность фуллеренов
- •Применение фуллеренов
- •Высокомолекулярные соединения
- •Свойства высокомолекулярных соединений
- •Основные химические реакции высокомолекулярных соединений
- •Часть II основы химической термодинамики
- •Понятия и термины химической термодинамики
- •Внутренняя энергия
- •Первое началотермодинамики
- •Следствия из первого начала термодинамики
- •Теплоемкость при постоянном объеме, сv
- •Теплоемкость при постоянном давлении
- •Равновесные процессы. Максимальная работа
- •Термохимия
- •Закон Гесса
- •Следствия из закона Гесса
- •И окончательно
- •Связь h и u химических реакций
- •Зависимость тепловых эффектов от температуры. Закон Кирхгофа
- •Совершенно очевидно, что разности Сi можно выразить через уравнение
- •Средняя теплоемкость
- •Работа тепловой машины. Теорема и цикл Карно
- •Второе начало термодинамики
- •Энтропия как критерий самопроизвольного течения процесса
- •Следовательно, если такой процесс протекает в изолированной системе, то
- •Расчет энтропии
- •Расчет изменения энтропии идеального газа
- •Задачи для самостоятельного решения
- •Принцип локального равновесия
- •Важно найти функции, определяющие зависимость deSиdiSот экспериментально измеряемых величин.
- •Статистическая интерпретация энтропии
- •Химический потенциал и химическое сродство
- •Химический потенциал
- •Химическое сродство
- •Уравнение Клапейрона-Клаузиуса
- •Термодинамические потенциалы
- •Свободная энергия Гиббса
- •Для чистого вещества
- •Условия самопроизвольного протекания процесса
- •Уравнение Гиббса-Гельмгольца
- •Тепловая теорема Нернста. Третий закон термодинамики
- •Некоторые аспекты, связанные с достижением химического равновесия
- •Изотерма химической реакции
- •Изобара химической реакции
- •Задачи для самостоятельного решения
- •Задача 7.Для реакции
- •Задача 8.Для реакции
- •Задача 10.Для реакции
- •Задача 11. Для реакции
- •Литература Основная литература
- •Дополнительная литература
Влияние разветвления молекул алканов на их физические характеристики
|
Формула |
Название |
Тпл, С |
Ткип, С |
Плотность,
d |
|
Н3ССН2СН2СН3 |
н-бутан |
135,0 |
0,6…0,3 |
0,60 (0 С) |
|
(СН3)2СНСН3 |
изобутан |
145,0 |
10,2 |
0,6030 (19 С) |
|
Н3ССН2СН2СН2СН3 |
н-пентан |
131,6 |
36,2 |
0,6260 |
|
(СН3)2СНСН2СН3 |
изопентан |
160,5 |
28,0 |
0,6197 |
|
Н3С(СН2)4СН3 |
н-гексан |
94,3 |
69,0 |
0,6603 |
|
|
2-метилпентан |
|
60,0 |
0,6540 |
|
|
3-метилпентан |
|
64,0 |
0,6760 (15 С) |
|
|
2,2-диметил-бутан |
98,2 |
49,7 |
0,6487 |
|
|
2,3-диметил-бутан |
135,1 |
58,1 |
0,6680 (17 С) |
Химические свойства алканов
1. Алкановые углеводороды, как и все вообще органические соединения, способны сгорать при взаимодействии с кислородом с образованием оксида углерода (IV) и воды
СН4 + 2О2 СО2 + 2Н2О – Н1
2С2Н6 + 7О2 4СО2 + 6Н2О – Н2
Конечно, величина теплового эффекта определяется природой алкана, то есть в расчете на 1 моль сгорающего вещества Н1 Н2.
2. Эти вещества участвуют в каталитическом окислении, давая промежуточные продукты (неполное окисление). Таким образом, можно получать, например, жирные (карбоновые) кислоты
R–H
![]() R1–COOH
+ R2–COOH
+ R3–COOH
+…
R1–COOH
+ R2–COOH
+ R3–COOH
+…
Символ t означает протекание процесса при повышенных температурах, Ri – углеводородный радикал.
3. Алканы участвуют в процессе крекинга. Крекинг – деструкция молекул по С–С-связи при t 1000 С без доступа воздуха с образованием более легких алканов из подобных веществ с большей молярной массой.
3.1. СnH2n+2
![]() СmH2m+2
+ СpH2p,
СmH2m+2
+ СpH2p,
при n > m и n > p.
3.2. Алканы подвергаются каталитическому пиролизу без доступа воздуха с доведением деструкции до элементарных продуктов
СН4
![]() C
+ 2H2
C
+ 2H2
2СН4
![]() C2H2
+ 3H2
C2H2
+ 3H2
4. Дегидрирование (отщепление Н2)
СnH2n+2
![]() СnH2n
+ H2
СnH2n
+ H2
5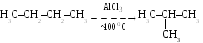 .
Изомеризация
.
Изомеризация
AlCl3 – кислота Льюиса, имеющая свободные орбитали для приема электронной пары.
6. Реакции радикального замещения
6а. Галогенирование
С2Н6 + 6F2 C2F6 + 6HF
6б. Сульфирование
R–H + H2SO4(дымящая) R–SO3H + H2O
6в. Нитрование
R–H + HONO2 R–NO2 + H2O
Механизм радикальных реакций рассмотрим на примере галогенирования алканов.
Хлор реагирует с предельными углеводородами только под влиянием света, нагревания (300 °С) или в присутствии катализаторов, причем последовательно замещаются хлором все атомы водорода:
СН4 + С12 СН3С1 + НС1
СН3С1 + С12 СН2С12 + НС1
СН2С12 + С12 CHC13 + HC1
СНС13 + С12 СС14 + НС1
Реакция протекает по цепному радикальному механизму.
С12 2С1 зарождение цепи
СН3–Н + C1 CH3 + HC1 развитие цепи
СН3 + С12 СН3С1 + C1 развитие цепи
2С1 С12 обрыв цепи
СН3 + С1 СН3С1 обрыв цепи
СН3 + СН3 СН3–СН3 обрыв цепи
Любая радикальная реакция включает три этапа: зарождение, рост и обрыв радикальной цепи. Стадия, где образуются радикалы, даёт начало данному процессу. При этом возникает естественный вопрос: почему такому расщеплению подвергаются в первую очередь молекулы хлора, а не другого участника реакции – метана? Причина такой избирательности – в различной прочности связей С–Н и С1–С1, энергии разрыва которых равны 435 и 242 кДж/моль соответственно. Таким образом, молекулы хлора легче образуют свободные радикалы.
На втором этапе обсуждаемой реакции – стадии развития цепи – возможно либо образование метильного радикала (схема 1), либо радикала водорода Н (схема 2).
Схема 1
СН3–Н + C1 CH3 + HC1 Н = +2 кДж/моль
СН3 + С1–С1 СН3С1 + C1 Н = –106 кДж/моль
Схема 2
СН3–Н + C1 CH3C1 + H Н = +85 кДж/моль
Н + С1–С1 Н–С1 + C1 Н = –189 кДж/моль
Как видно из величин и знака Н, схема 2 – энергетически неприемлема. Реакция, в которой образуется радикал Н, высокоэндотермична и требует для своего осуществления большой энергии активации (если использовать принцип Бертло). Проведенные расчеты показали, что если бы этот процесс в самом деле имел место, то константа скорости образования метилхлорида была бы исчезающе малой и равной 10–12 моль/лс. Время полупревращения такой реакции огромно – 3 000 лет, что не согласуется с экспериментом: смеси алканов с хлором на свету со взрывом (за миллисекунды).
На стадии обрыва цепи наряду с рекомбинацией радикалов возможны и другие пути исчезновения радикальных частиц, например, реакция радикального диспропорционирования, которая имеет место, например, при высокотемпературном крекинге алканов:
СН3СН2 + СН3СН2 СН3–СН3 + СН2=СН2
Введение ингибиторов (от латинского inhibere – сдерживать, останавливать) также тормозит радикальные процессы. В качестве таких радикальных «ловушек» могут выступать гидрохинон, йод, оксид азота, трифениламин ((С6Н5)3С–NH2) и др.
Характер реакции галогенирования алканов в существенной степени определяется природой галогена. Реакция с йодом в целом эндотермична (Н = 4 – 50 кДж/моль), поэтому практически она протекает в обратном направлении:
RI + HI RH + I2
Этот процесс используют для синтеза предельных углеводородов. Реакция прямого фторирования – неконтролируемый процесс (Н = –481 кДж/моль), ведущий к деструкции исходного алкана. При непосредственном фторировании реагенты сильно разбавляют инертным газом, выполняющим роль «теплоотвода» (энергоотвода).
Если в молекуле углеводорода имеются неравноценные атомы углерода (первичные, вторичные или третичные), то и замещение водородных атомов, связанных с ними, будет происходить с различной скоростью. Относительная реакционная способность связей С–Н не остается постоянной: при фторировании их химическое поведение почти ничем не отличается, а вот уже при бромировании различие в реакционной способности достигает нескольких порядков (по константам скоростей). Ниже представлены значения относительных скоростей галогенирования (С) предельных углеводородов, содержащих первичные, вторичные и третичные атомы углерода:
|
Галоген |
Т, С |
Сперв |
Свтор |
Стрет |
Нперв |
Нвтор |
Нтрет. |
|
F Cl Br |
23 25 150 |
1* 1 1 |
1 4 60 |
2 7 1600 |
–150 –20 +46 |
–166 –35 +31 |
–182 –51 +15 |
* Условно принят за 1
Высокая реакционная способность атома фтора обуславливает его низкую избирательность (селективность). Из приведенных значений относительных скоростей галогенирования видно, что бромирование наиболее избирательно. Это связано с низкой реакционной способностью атома брома. Активность радикала по отношению к данному конкретному соединению тем выше, чем больше выигрыш энергии при образовании новой связи галоген–Н, который определяется как разность энергии образования «новой» связи галоген–Н и «старой» С–Н – связи. Относительная реакционная способность ряда радикалов приведена ниже:
F > ОН > Сl > СН > Вr > ROO
Преимущественная атака по третичному углеродному атому вызвана тем, что Нобр (R–Н –связи) в этом случае несколько ниже вследствие большей стабильности третичного радикала. Кроме того, прочность и энергия связи С–Н возрастает от третичного атома к первичному.
7. Частные реакции на примере метана.
7.1. Конверсия метана
СН4
+ Н2О
![]() CO
+ 3H2
CO
+ 3H2
2СН4
+ 2Н2О
![]() 2CO
+ 6H2
2CO
+ 6H2