
- •В.И. Вигдорович, с.В. Романцова, н.В. Шель, и.В. Зарапина
- •Оглавление
- •Предисловие
- •Часть I. Основы органической химии
- •Структура органических соединений
- •Теория строения органических соединений а.М. Бутлерова
- •Изомерия органических соединений
- •Индуктивный и мезомерный эффекты
- •Понятие о мезомерном эффекте
- •Типы реакций органических соединений. Понятие о механизме реакции
- •Типы реакций в органической химии
- •Направление и селективность химической реакции
- •Предельные (насыщенные) углеводороды
- •Изомерия алканов.Для алканов характерен один из видов структурной изомерии – изомерия углеродной цепи (строения углеродного скелета). Приведем примеры таких изомеров:
- •Физические свойства алканов
- •Физические характеристики некоторых нормальных углеводородов
- •Влияние разветвления молекул алканов на их физические характеристики
- •Химические свойства алканов
- •Некоторые отдельные представители
- •Экологическая характеристика алканов
- •Задачи по теме
- •Циклоалканы
- •Физические свойства циклоалканов
- •Получение циклоалканов
- •Химические свойства малых циклов
- •Применение циклоалканов
- •Экологическая оценка
- •Непредельные углеводороды Алкены (олефины)
- •Физические свойства олефинов
- •Получение олефиновых углеводородов
- •Химические свойства олефинов
- •Отдельные представители олефинов
- •Экологические характеристики
- •Задачи по теме
- •Алкадиены (диеновые углеводороды)
- •Методы получение диенов
- •Химические свойства диенов
- •Каучуки
- •Экологическая характеристика
- •Задачи по теме
- •Алкины (ацетиленовые углеводороды)
- •Методы получения алкинов
- •Физические свойства алкинов
- •Химические свойства алкинов
- •Экологическая характеристика
- •Задачи по теме
- •Предельные спирты
- •Предельные одноатомные спирты
- •Получение одноатомных спиртов
- •Физические свойства первичных спиртов
- •Химические свойства одноатомных спиртов
- •Отдельные представители
- •Предельные многоатомные спирты
- •Получение двухатомных спиртов
- •Получение трехатомных спиртов
- •Физические свойства многоатомных спиртов
- •Химические свойства многоатомных спиртов
- •Экологическая характеристика
- •Задачи по теме
- •Предельные оксосоединения
- •Альдегиды
- •Получение альдегидов
- •Физические свойства альдегидов
- •Химические свойства альдегидов
- •Отдельные представители
- •Экологическая характеристика
- •Получение кетонов
- •Химические свойства кетонов
- •Отдельные представители
- •Задачи по теме
- •Карбоновые кислоты
- •Электронное строение карбоксильной группы
- •Предельные карбоновые кислоты
- •Физические свойства кислот
- •Получение карбоновых кислот
- •Химические свойства карбоновых кислот
- •Свойства отдельных представителей гомологического ряда
- •Задачи по теме
- •Азотсодержащие органические соединения
- •Нитросоединения
- •Нитрилы и изоцианиды
- •Алифатические амины
- •Физические свойства аминов
- •Получение аминов
- •Химические свойства аминов
- •Отдельные представители
- •Экологическая характеристика
- •Задачи по теме
- •Аминокислоты
- •Физические свойства α-аминокислот
- •Способы получения -аминокислот
- •Способы получения -аминокислот
- •Химические свойства аминокислот
- •Отдельные представители
- •Простые и сложные эфиры Простые эфиры
- •Способы получения простых эфиров
- •Физические свойства простых эфиров
- •Химические свойства простых эфиров
- •Отдельные представители
- •Сложные эфиры карбоновых кислот Получение сложных эфиров карбоновых кислот
- •Химические свойства эфиров карбоновых кислот
- •Физические свойства жиров
- •Химические свойства жиров
- •Сложные липиды
- •Ароматические углеводороды, арены Бензол и его производные
- •Методы получения бензола и его гомологов
- •Получение гомологов бензола
- •Физические свойства аренов
- •Химические свойства
- •Экологиченские характеристики
- •Ароматические оксосоединения Фенолы
- •Некоторые физические и термодинамические характеристики ряда фенолов
- •Получение фенола
- •Некоторые химические свойства фенола
- •Задачи по теме
- •Гетероциклические соединения
- •Пятичленные гетероциклы с одним гетероатомом
- •Химические свойства пиридина
- •Диоксины
- •Физико-химические свойства ксенобиотиков типа диоксинов
- •Источники ксенобиотиков
- •Пестициды
- •Фуллерены. Синтез и свойства соединений на их основе
- •Методы получения гидридов фуллеренов
- •Кислотность фуллеренов
- •Применение фуллеренов
- •Высокомолекулярные соединения
- •Свойства высокомолекулярных соединений
- •Основные химические реакции высокомолекулярных соединений
- •Часть II основы химической термодинамики
- •Понятия и термины химической термодинамики
- •Внутренняя энергия
- •Первое началотермодинамики
- •Следствия из первого начала термодинамики
- •Теплоемкость при постоянном объеме, сv
- •Теплоемкость при постоянном давлении
- •Равновесные процессы. Максимальная работа
- •Термохимия
- •Закон Гесса
- •Следствия из закона Гесса
- •И окончательно
- •Связь h и u химических реакций
- •Зависимость тепловых эффектов от температуры. Закон Кирхгофа
- •Совершенно очевидно, что разности Сi можно выразить через уравнение
- •Средняя теплоемкость
- •Работа тепловой машины. Теорема и цикл Карно
- •Второе начало термодинамики
- •Энтропия как критерий самопроизвольного течения процесса
- •Следовательно, если такой процесс протекает в изолированной системе, то
- •Расчет энтропии
- •Расчет изменения энтропии идеального газа
- •Задачи для самостоятельного решения
- •Принцип локального равновесия
- •Важно найти функции, определяющие зависимость deSиdiSот экспериментально измеряемых величин.
- •Статистическая интерпретация энтропии
- •Химический потенциал и химическое сродство
- •Химический потенциал
- •Химическое сродство
- •Уравнение Клапейрона-Клаузиуса
- •Термодинамические потенциалы
- •Свободная энергия Гиббса
- •Для чистого вещества
- •Условия самопроизвольного протекания процесса
- •Уравнение Гиббса-Гельмгольца
- •Тепловая теорема Нернста. Третий закон термодинамики
- •Некоторые аспекты, связанные с достижением химического равновесия
- •Изотерма химической реакции
- •Изобара химической реакции
- •Задачи для самостоятельного решения
- •Задача 7.Для реакции
- •Задача 8.Для реакции
- •Задача 10.Для реакции
- •Задача 11. Для реакции
- •Литература Основная литература
- •Дополнительная литература
Основные химические реакции высокомолекулярных соединений
1. Образование химических связей между макромолекулами (сшивка, вулканизация каучуков).
2. Распад макромолекулярных цепей на более короткие (деструкция).
3. Взаимодействие боковых цепей с низкомолекулярными веществами.
4. Внутримолекулярные реакции, протекающие между функциональными группами одной макромолекулы (например, внутримолекулярная циклизация). Подробнее строение, свойства и применение высокомолекулярных соединений будут рассмотрены в 3-й части настоящего пособия, где им будет отвендена отдельная глава.
Часть II основы химической термодинамики
Термодинамика, представляющая собой на первый взгляд, сугубо теоретическую, а подчас даже и абстрактную, отрасль человеческого знания, возникла из запросов практики в первой половине XIX века. Это было связано с необходимостью разработки теоретических представлений, связанных с созданием паровой машины, в частности установлением связи между теплотой и работой. В дальнейшем потребности практики привели к значительному расширению предмета ее исследования, в результате чего положения термодинамики начинают широко использоваться в различных областях науки и техники.
Применение термодинамики к химическим процессам составляет предмет химической термодинамики. Химическая термодинамика изучает соотношение между химической и другими формами энергии, устанавливает критерии, характеризующие направление и пределы самопроизвольного течения процессов и условия достижения равновесия химических реакций.
Понятия и термины химической термодинамики
Система – это одно из базовых понятий. Под ним в термодинамике понимается тело или группа тел, находящихся во взаимодействии и мысленно обособленных от окружающей среды.
Требование, предъявляемое термодинамикой к системе, состоит в том, что она должна состоять из большого числа образующих ее частиц, хотя их минимальное количество и не определено. Иначе говоря, система должна быть макроскопической. Таким образом, одна молекула не может представлять собой систему, это обязательно большая совокупность молекул.
Такой подход ставит целью ряд вопросов:
1. В частности, может ли наночастица, состоящая из определенного числа атомов и молекул рассматриваться как термодинамическая система, к которой применимы положения термодинамики?
2. Может ли отдельный кластер, как совокупность образующих его атомов, молекул или каких-либо еще ассоциатов, представлять собой термодинамическую систему?
По-видимому, в том и в другом случае ответ должен быть отрицательным. Но если система состоит из большой совокупности наночастиц и кластеров, то она, безусловно, как любая макроскопическая система, подчиняется положениям термодинамики.
Если вводится понятие системы, то такое образование должно существовать не само по себе, а внутри некой окружающей среды, с которой, впрочем, оно может взаимодействовать определенным образом. Причем отсутствие взаимодействия следует рассматривать частным случаем его наличия. Исходя из этих соображений, можно представить три варианта термодинамических систем:
1. Открытая.
2. Закрытая.
3. Изолированная.
Под открытой понимается система, которая способна обмениваться с окружающей средой веществом и энергией. Представим себе некоторый объем теплой жидкой воды, который находится в открытом сосуде. Из жизненного опыта людей следует, что такая система будет обмениваться веществом и энергией с окружающей средой. Масса воды во времени будет уменьшаться в результате испарения, а температура – понижаться за счет передачи энергии в форме теплоты окружающей более холодной среде. Меняя условия существования системы, можно направить эти обмены в обратном направлении.
Закрытая система не обменивается с окружающей средой веществом, но обменивается энергией. Этот случай легко представить себе в виде абсолютно герметичной емкости, стенки которой не пропускают жидкую воду и ее пары, но обладают хотя бы малой теплопроводностью. Это определяет наличие обмена такой системой энергией с окружающей средой.
Изолированная (от окружающей среды) система (хотя и находится в ней) не способна обмениваться, как, вероятно, уже догадался заинтересованный читатель, не способна к обмену ни веществом, ни энергией. Этот случай будет иметь место применительно к рассматриваемой нами системе, если вода будет находиться в герметичном сосуде, стенки которого образованы некоторым идеализированным материалом с нулевым коэффициентом теплопроводности.
По другой классификации система может быть:
1. Гомогенной.
2. Гетерогенной.
Гомогенная система состоит из одной фазы (например, пары воды в герметичном сосуде) и естественно не имеет границы раздела фаз. Совершенно очевидно, что одна фаза не может иметь внутри системы границы раздела. В этом случае такая граница существует только между системой и окружающей средой.
Гетерогенная система состоит из нескольких фаз, отделенных одна от другой границей раздела. Например, если герметичный сосуд заполнен лишь частично жидкой водой, то над жидкой фазой обязательно находится паровая фаза (пары воды, то есть газ). Совершенно очевидно, что между этими фазами в такой однокомпонентной (Н2О) гетерогенной системе имеется граница раздела. В частности, на ней непрерывно протекают процессы испарения и конденсации.
Любая система всегда находится в определенном состоянии. Причем, очевидно, что одна и та же система отличается чем-то, находясь, например, в состоянии I от ее же в состоянии II. Если таких различий не будет, то невозможны и два разные состояния единой системы. Следовательно, должны быть совершенно конкретными свойства системы. Термодинамические свойства системы должны быть взаимосвязаны. То есть при изменении одного из них претерпевают изменения и другие.
Для полного описания состояния системы необходим минимальный набор термодинамических свойств. В термодинамике состояние системы описывается в терминах макроскопических переменных состояний. К ним относят:
1. Давление, р.
2. Объем, V.
3. Температура, Т.
4. Число моль компонентов системы, n.
Термодинамической система называется в том случае, если ее состояние описывается посредством термодинамических параметров состояния. В свою очередь, термодинамические параметры состояния связаны между собой уравнением состояния. Для указанных выше параметров при ni = const, принимая систему однокомпонентной, уравнение состояния в самой общей форме имеет вид
f(p, V, T) = 0.
Для частного случая идеального газа уравнение состояния представляет собой уравнение Менделеева-Клапейрона, которое для одного моля любого газа имеет вид
pV = RT
для n молей одного компонента системы выражение несколько усложняется
pV = nRT.
И, наконец, для многокомпонентной системы с i-числом веществ оно записывается в следующем виде
![]() .
.
Термодинамические свойства системы являются функциями состояния, то есть их изменение определяется исходным и конечным состоянием и не зависит от пути перехода из одного состояния в другое.
Термодинамические переменные, в свою очередь делятся на два типа:
1. Интенсивные.
2. Экстенсивные.
Интенсивные переменные, а к ним относятся температура и давление, не зависят от размеров системы. Они в равновесном состоянии системы одинаковы во всех ее точках. Так, если температура в разных точках системы различна, то теплота будет перетекать между ними до тех пор, пока этот параметр не выровняется, а система достигнет теплового равновесия. Забегая несколько вперед, отметим, что в состоянии теплового равновесия внутренняя энергия (U) и энтропия (S) однокомпонентной системы определяются полностью значениями Т, V и n, то есть
U = U(T, V, n); S = S(T, V, n).
Экстенсивные переменные зависят от размеров системы и пропорциональны ее массе. К ним относятся, внутренняя энергия системы, ее объем, энтропия, теплоемкость. Например, если систему разделить на несколько частей независимо от их размеров, то для ее внутренней энергии можно записать
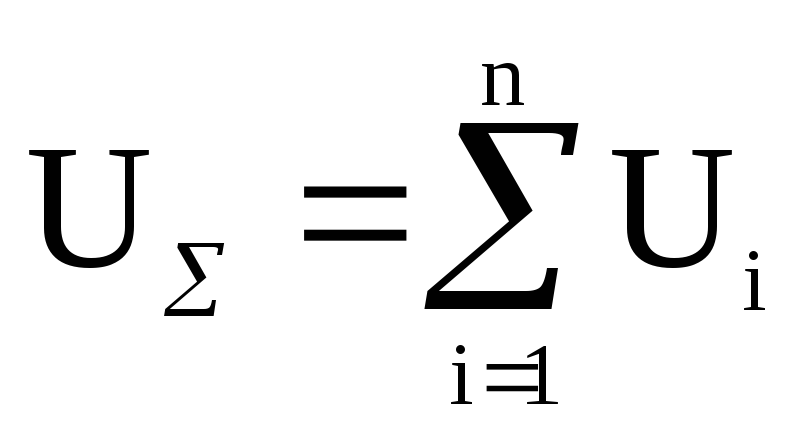 .
.
Экстенсивные переменные U, S могут быть функциями других экстенсивных переменных
U = U(S, V, n); S = S(U, V, n).
Ниже будет показано, что интенсивные переменные могут быть представлены как производные одной экстенсивной переменной по другой, так T = (U/S)V,n.
Рассмотрим еще одну классификацию систем, по которой их также делят на два типа.
1. Равновесные системы.
2. Неравновесные системы.
В случае изолированной системы ее состояние определяется макроскопическими переменными р, T и ni, которые во времени необратимо изменяются до достижения неизменного состояния. По его достижении далее в системе не наблюдается никаких физических и химических изменений. Система в этом случае достигает состояния термодинамического равновесия. Причем эволюция любого исходного состояния системы до равновесного происходит в результате необратимых процессов, которые с достижением равновесия прекращаются.
Нулевое начало термодинамики. Пусть система А находится в равновесии с системой В. А система В в свою очередь с системой С. Тогда можно утверждать, что система А находится в равновесии с системой С. Этот вариант называют нулевым началом термодинамики.
Заключая, отметим, что в случае равновесных систем имеет место равномерное распределение (постоянство) температуры. И для них имеются функции состояния – U и S.
Для неравновесных систем, температура которых T = const, но локально, тем не менее, определена, согласно Л. Пригожина и Д. Кондепуди, можно предложить иной подход. Для них следует ввести плотности термодинамических величин U и S. Обозначим их теми же прописными буквами. Тогда плотность энергии
u(T, ni(х)) = внутренняя энергия на единицу объема.
ni(х) – молярная плотность – число молей на единицу объема.
Тогда имеем
![]()
![]()
![]()
Термодинамические процессы. Физические или химические процессы, в которых участвует система, могут протекать при различных условиях. В соответствии с этим они классифицируются следующим образом.
1. Объем системы при протекании такого или таких процессов остается постоянным, то есть V = 0, а сам процесс называется изохорическим.
2. Постоянным во времени остается давление, то есть р = 0. Имеет место изобарический (изобарный) процесс.
3. Постоянной во времени остается температура, Т = 0. Процесс называется изотермическим.
4. Система не обменивается теплотой с окружающей средой, то есть Q = 0. Такой процесс называется адиабатным (адиабатическим).
