
- •В.И. Вигдорович, с.В. Романцова, н.В. Шель, и.В. Зарапина
- •Оглавление
- •Предисловие
- •Часть I. Основы органической химии
- •Структура органических соединений
- •Теория строения органических соединений а.М. Бутлерова
- •Изомерия органических соединений
- •Индуктивный и мезомерный эффекты
- •Понятие о мезомерном эффекте
- •Типы реакций органических соединений. Понятие о механизме реакции
- •Типы реакций в органической химии
- •Направление и селективность химической реакции
- •Предельные (насыщенные) углеводороды
- •Изомерия алканов.Для алканов характерен один из видов структурной изомерии – изомерия углеродной цепи (строения углеродного скелета). Приведем примеры таких изомеров:
- •Физические свойства алканов
- •Физические характеристики некоторых нормальных углеводородов
- •Влияние разветвления молекул алканов на их физические характеристики
- •Химические свойства алканов
- •Некоторые отдельные представители
- •Экологическая характеристика алканов
- •Задачи по теме
- •Циклоалканы
- •Физические свойства циклоалканов
- •Получение циклоалканов
- •Химические свойства малых циклов
- •Применение циклоалканов
- •Экологическая оценка
- •Непредельные углеводороды Алкены (олефины)
- •Физические свойства олефинов
- •Получение олефиновых углеводородов
- •Химические свойства олефинов
- •Отдельные представители олефинов
- •Экологические характеристики
- •Задачи по теме
- •Алкадиены (диеновые углеводороды)
- •Методы получение диенов
- •Химические свойства диенов
- •Каучуки
- •Экологическая характеристика
- •Задачи по теме
- •Алкины (ацетиленовые углеводороды)
- •Методы получения алкинов
- •Физические свойства алкинов
- •Химические свойства алкинов
- •Экологическая характеристика
- •Задачи по теме
- •Предельные спирты
- •Предельные одноатомные спирты
- •Получение одноатомных спиртов
- •Физические свойства первичных спиртов
- •Химические свойства одноатомных спиртов
- •Отдельные представители
- •Предельные многоатомные спирты
- •Получение двухатомных спиртов
- •Получение трехатомных спиртов
- •Физические свойства многоатомных спиртов
- •Химические свойства многоатомных спиртов
- •Экологическая характеристика
- •Задачи по теме
- •Предельные оксосоединения
- •Альдегиды
- •Получение альдегидов
- •Физические свойства альдегидов
- •Химические свойства альдегидов
- •Отдельные представители
- •Экологическая характеристика
- •Получение кетонов
- •Химические свойства кетонов
- •Отдельные представители
- •Задачи по теме
- •Карбоновые кислоты
- •Электронное строение карбоксильной группы
- •Предельные карбоновые кислоты
- •Физические свойства кислот
- •Получение карбоновых кислот
- •Химические свойства карбоновых кислот
- •Свойства отдельных представителей гомологического ряда
- •Задачи по теме
- •Азотсодержащие органические соединения
- •Нитросоединения
- •Нитрилы и изоцианиды
- •Алифатические амины
- •Физические свойства аминов
- •Получение аминов
- •Химические свойства аминов
- •Отдельные представители
- •Экологическая характеристика
- •Задачи по теме
- •Аминокислоты
- •Физические свойства α-аминокислот
- •Способы получения -аминокислот
- •Способы получения -аминокислот
- •Химические свойства аминокислот
- •Отдельные представители
- •Простые и сложные эфиры Простые эфиры
- •Способы получения простых эфиров
- •Физические свойства простых эфиров
- •Химические свойства простых эфиров
- •Отдельные представители
- •Сложные эфиры карбоновых кислот Получение сложных эфиров карбоновых кислот
- •Химические свойства эфиров карбоновых кислот
- •Физические свойства жиров
- •Химические свойства жиров
- •Сложные липиды
- •Ароматические углеводороды, арены Бензол и его производные
- •Методы получения бензола и его гомологов
- •Получение гомологов бензола
- •Физические свойства аренов
- •Химические свойства
- •Экологиченские характеристики
- •Ароматические оксосоединения Фенолы
- •Некоторые физические и термодинамические характеристики ряда фенолов
- •Получение фенола
- •Некоторые химические свойства фенола
- •Задачи по теме
- •Гетероциклические соединения
- •Пятичленные гетероциклы с одним гетероатомом
- •Химические свойства пиридина
- •Диоксины
- •Физико-химические свойства ксенобиотиков типа диоксинов
- •Источники ксенобиотиков
- •Пестициды
- •Фуллерены. Синтез и свойства соединений на их основе
- •Методы получения гидридов фуллеренов
- •Кислотность фуллеренов
- •Применение фуллеренов
- •Высокомолекулярные соединения
- •Свойства высокомолекулярных соединений
- •Основные химические реакции высокомолекулярных соединений
- •Часть II основы химической термодинамики
- •Понятия и термины химической термодинамики
- •Внутренняя энергия
- •Первое началотермодинамики
- •Следствия из первого начала термодинамики
- •Теплоемкость при постоянном объеме, сv
- •Теплоемкость при постоянном давлении
- •Равновесные процессы. Максимальная работа
- •Термохимия
- •Закон Гесса
- •Следствия из закона Гесса
- •И окончательно
- •Связь h и u химических реакций
- •Зависимость тепловых эффектов от температуры. Закон Кирхгофа
- •Совершенно очевидно, что разности Сi можно выразить через уравнение
- •Средняя теплоемкость
- •Работа тепловой машины. Теорема и цикл Карно
- •Второе начало термодинамики
- •Энтропия как критерий самопроизвольного течения процесса
- •Следовательно, если такой процесс протекает в изолированной системе, то
- •Расчет энтропии
- •Расчет изменения энтропии идеального газа
- •Задачи для самостоятельного решения
- •Принцип локального равновесия
- •Важно найти функции, определяющие зависимость deSиdiSот экспериментально измеряемых величин.
- •Статистическая интерпретация энтропии
- •Химический потенциал и химическое сродство
- •Химический потенциал
- •Химическое сродство
- •Уравнение Клапейрона-Клаузиуса
- •Термодинамические потенциалы
- •Свободная энергия Гиббса
- •Для чистого вещества
- •Условия самопроизвольного протекания процесса
- •Уравнение Гиббса-Гельмгольца
- •Тепловая теорема Нернста. Третий закон термодинамики
- •Некоторые аспекты, связанные с достижением химического равновесия
- •Изотерма химической реакции
- •Изобара химической реакции
- •Задачи для самостоятельного решения
- •Задача 7.Для реакции
- •Задача 8.Для реакции
- •Задача 10.Для реакции
- •Задача 11. Для реакции
- •Литература Основная литература
- •Дополнительная литература
Следовательно, если такой процесс протекает в изолированной системе, то
q = 0
и
![]() ; S2
– S1
> 0 и
S
> 0.
; S2
– S1
> 0 и
S
> 0.
Таким образом, необратимый процесс в изолированной системе приводит к возрастанию энтропии. Отсюда следует вывод, что в изолированной системе самопроизвольно могут протекать только процессы, которые сопровождаются возрастанием энтропии. И идти такие процессы самопроизвольно могут только до такого состояния, при котором энтропия системы максимальна для конкретных рассматриваемых условий (рис. 22).
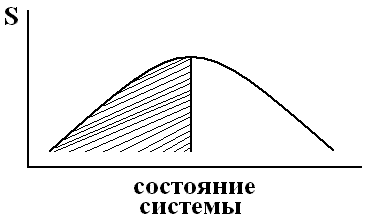
Рис. 22. Влияние характера изменения энтропии системы на возможность самопроизвольного течения процессов.
Под кривой рис. 22 заштрихована область самопроизвольного протекания процессов.
Расчет энтропии
Так как энтропия является экстенсивной величиной, то при наличии нескольких частей единой системы имеет место равенство
![]() .
.
Кроме того, отметим,
что, если процесс протекает при T
= const,
то
![]() .
Иначе говоря, расчет изменения энтропии
в этом случае предельно прост. Рассмотрим.
Рассмотрим пример.
.
Иначе говоря, расчет изменения энтропии
в этом случае предельно прост. Рассмотрим.
Рассмотрим пример.
Задача. Система состоит из двух кусков металла, практически не меняющих свою температуру при передаче некоторого количества теплоты Q от первой его части ко второй. Оценить возможность передачи тепла в следующих случаях:
T1 > T2; T1 = T2; T1 < T2.
1.
![]() ;
;
T1
> T2; ![]()
![]() ;
процесс возможен.
;
процесс возможен.
2. T1 = T2
![]()
![]() ;
достигнуто равновесие.
;
достигнуто равновесие.
3. T1 < T2
![]()
![]() ;
процесс передачи теплоты невозможен.
;
процесс передачи теплоты невозможен.
Если при протекании процесса в системе наблюдается изменение температуры, то S находят интегрированием уравнения
![]() .
.
Расчет изменения энтропии идеального газа
Рассмотрим переход системы из идеального газа из одного состояния в другое.
Из самых общих соображений в отсутствии химических изменений в системе можно записать (для 1-го моля газа):
![]() ;
;
![]() ;
;
![]() ;
;
pV = RT
и, следовательно,
![]() ;
;
![]() .
.
Окончательно получаем:
![]() ; (при
CV
f(T)).
; (при
CV
f(T)).
Для n молей газа уравнение будет иметь вид:
![]() .
.
Учтем, что для идеального газа
![]() .
.
Откуда
![]() ;
;
![]() ;
;
![]() ;
;
![]() ;
;
![]() .
.
В случае изотермического процесса имеем:
![]() и
и
![]() .
.
Расчет изменения энтропии реальных газов и конденсированных веществ при p=const
В этом случае следует исходить из уравнения
![]() .
.
Учтем, как было указано ранее, зависимость Ср от температуры может быть выражена степенными рядами, в частности, в соответствии с уравнениями (22а) и (22б).
Тогда можно записать для первого случая
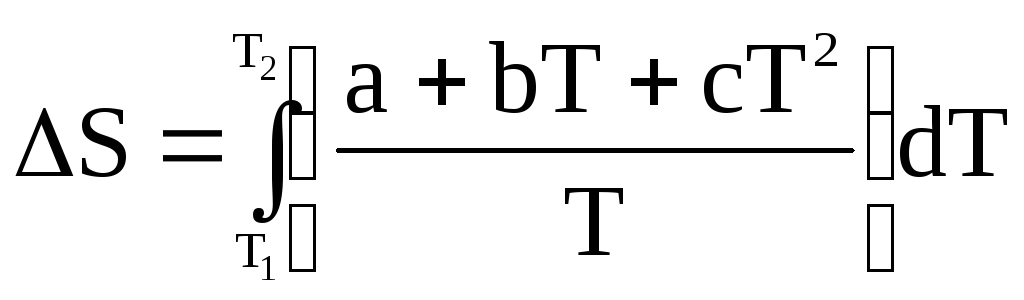 ;
;
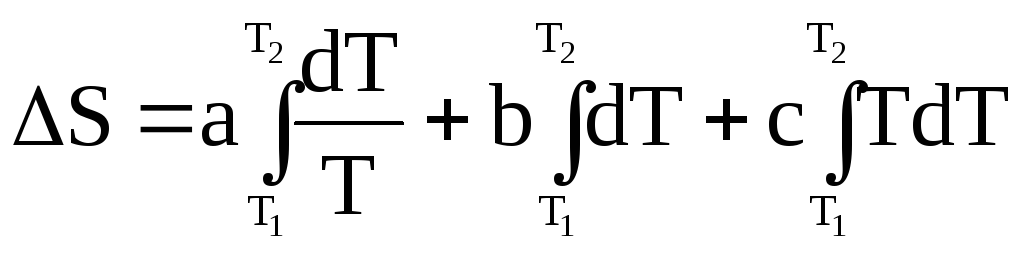 ;
;
![]() .
.
В случае n молей конденсированного вещества или реального газа будем иметь:
![]() .
.
В широком интервале температур возможны агрегатные превращения вещества. Тогда до и после агрегатного превращения меняется вид зависимости Ср вещества от температуры, то есть коэффициенты степенных рядов. Собственно фазовый переход происходит при постоянной температуре, иначе говоря:
![]() ; (27)
; (27)
![]() . (28)
. (28)
В общем виде в отсутствие химического превращения вещества уравнение для расчета имеет вид:
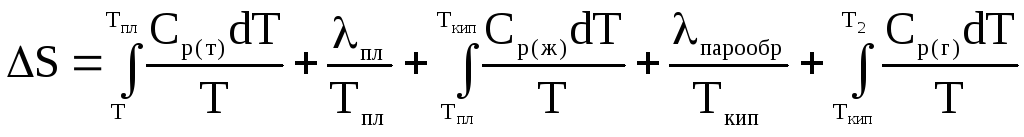 ,
,
i в расчете на 1 моль – мольная теплота фазового перехода
Приведем пример решения задач, связанных с расчетом изменения энтропии, а также несколько задач для самостоятельного решения (все задачи заимствованы в книге: Картушинская А.И, Лельчук Х.А., Стромберг А.Г. Сборник задач по химической термодинамике. М.: Высшая школа. 1973. 224 с.)
Задача 1. Определить изменение энтропии при превращении 2 г воды в пар при изменении температуры от 0 до 150С и давлении в 1,013 105 Н/м2, если скрытая удельная теплота парообразования воды Н = 2,255 кДж/г, а мольная теплоемкость пара при постоянном давлении
Ср = 30,13 + 11,3 103 Т Дж/моль град.
Ср жидкой воды = 75,30 Дж/моль град.
Считать, что в первом приближении, теплоемкость жидкой воды постоянна.
Указанный процесс состоит из трех стадий:
1) нагрева жидкой воды от 0 до 100 С,
2) перехода жидкой воды в пар при 100 С,
3) нагрева водяного пара от 100 до 150 С.
1. Изменение энтропии в стадии 1 рассчитывается по формуле
![]() , (29)
, (29)
учитывая, что Сp = const,
![]() Дж/град.
Дж/град.
2. Изменение энтропии в стадии 2 определяется по формуле (28) с учетом количества вещества воды
![]() Дж/град.
Дж/град.
3. Изменение энтропии в стадии 3 рассчитывается по формуле (29)
![]() Дж/град.
Дж/град.
Общий прирост энтропии составит
S = S1 + S2 + S3 = 2,61 + 12,09 + 0,49 = 15,19 Дж/град.
Задача 2. В одном из сосудов емкостью 0,1 м3 находится кислород, в другом емкостью 0,4 м3 – азот. В обоих сосудах температура 17 С и давление 1,013 105 Н/м2. найти изменение энтропии при взаимной диффузии газов из одного сосуда в другой при р и Т = const. Считать оба газа идеальными.
Изменение энтропии определяем по формулам:
![]()
или
![]() ,
,
так как объем Vпропорционален количеству вещества идеального газаn.
Число молей каждого газа находим из уравнения Менделеева-Клапейрона.
![]() моль,
моль,
![]() моль,
моль,
![]() Дж/град.
Дж/град.
Задача 3. Вычислить изменение энтропии в процессе изотермического расширения 2 моль метана от р1 = 101,3 105 Н/м2 до р2 = 1,013 105 Н/м2. Газ считать идеальным.
По формуле
![]()
при Т = const находим
![]() Дж/град.
Дж/град.
