
- •В.И. Вигдорович, с.В. Романцова, н.В. Шель, и.В. Зарапина
- •Оглавление
- •Предисловие
- •Часть I. Основы органической химии
- •Структура органических соединений
- •Теория строения органических соединений а.М. Бутлерова
- •Изомерия органических соединений
- •Индуктивный и мезомерный эффекты
- •Понятие о мезомерном эффекте
- •Типы реакций органических соединений. Понятие о механизме реакции
- •Типы реакций в органической химии
- •Направление и селективность химической реакции
- •Предельные (насыщенные) углеводороды
- •Изомерия алканов.Для алканов характерен один из видов структурной изомерии – изомерия углеродной цепи (строения углеродного скелета). Приведем примеры таких изомеров:
- •Физические свойства алканов
- •Физические характеристики некоторых нормальных углеводородов
- •Влияние разветвления молекул алканов на их физические характеристики
- •Химические свойства алканов
- •Некоторые отдельные представители
- •Экологическая характеристика алканов
- •Задачи по теме
- •Циклоалканы
- •Физические свойства циклоалканов
- •Получение циклоалканов
- •Химические свойства малых циклов
- •Применение циклоалканов
- •Экологическая оценка
- •Непредельные углеводороды Алкены (олефины)
- •Физические свойства олефинов
- •Получение олефиновых углеводородов
- •Химические свойства олефинов
- •Отдельные представители олефинов
- •Экологические характеристики
- •Задачи по теме
- •Алкадиены (диеновые углеводороды)
- •Методы получение диенов
- •Химические свойства диенов
- •Каучуки
- •Экологическая характеристика
- •Задачи по теме
- •Алкины (ацетиленовые углеводороды)
- •Методы получения алкинов
- •Физические свойства алкинов
- •Химические свойства алкинов
- •Экологическая характеристика
- •Задачи по теме
- •Предельные спирты
- •Предельные одноатомные спирты
- •Получение одноатомных спиртов
- •Физические свойства первичных спиртов
- •Химические свойства одноатомных спиртов
- •Отдельные представители
- •Предельные многоатомные спирты
- •Получение двухатомных спиртов
- •Получение трехатомных спиртов
- •Физические свойства многоатомных спиртов
- •Химические свойства многоатомных спиртов
- •Экологическая характеристика
- •Задачи по теме
- •Предельные оксосоединения
- •Альдегиды
- •Получение альдегидов
- •Физические свойства альдегидов
- •Химические свойства альдегидов
- •Отдельные представители
- •Экологическая характеристика
- •Получение кетонов
- •Химические свойства кетонов
- •Отдельные представители
- •Задачи по теме
- •Карбоновые кислоты
- •Электронное строение карбоксильной группы
- •Предельные карбоновые кислоты
- •Физические свойства кислот
- •Получение карбоновых кислот
- •Химические свойства карбоновых кислот
- •Свойства отдельных представителей гомологического ряда
- •Задачи по теме
- •Азотсодержащие органические соединения
- •Нитросоединения
- •Нитрилы и изоцианиды
- •Алифатические амины
- •Физические свойства аминов
- •Получение аминов
- •Химические свойства аминов
- •Отдельные представители
- •Экологическая характеристика
- •Задачи по теме
- •Аминокислоты
- •Физические свойства α-аминокислот
- •Способы получения -аминокислот
- •Способы получения -аминокислот
- •Химические свойства аминокислот
- •Отдельные представители
- •Простые и сложные эфиры Простые эфиры
- •Способы получения простых эфиров
- •Физические свойства простых эфиров
- •Химические свойства простых эфиров
- •Отдельные представители
- •Сложные эфиры карбоновых кислот Получение сложных эфиров карбоновых кислот
- •Химические свойства эфиров карбоновых кислот
- •Физические свойства жиров
- •Химические свойства жиров
- •Сложные липиды
- •Ароматические углеводороды, арены Бензол и его производные
- •Методы получения бензола и его гомологов
- •Получение гомологов бензола
- •Физические свойства аренов
- •Химические свойства
- •Экологиченские характеристики
- •Ароматические оксосоединения Фенолы
- •Некоторые физические и термодинамические характеристики ряда фенолов
- •Получение фенола
- •Некоторые химические свойства фенола
- •Задачи по теме
- •Гетероциклические соединения
- •Пятичленные гетероциклы с одним гетероатомом
- •Химические свойства пиридина
- •Диоксины
- •Физико-химические свойства ксенобиотиков типа диоксинов
- •Источники ксенобиотиков
- •Пестициды
- •Фуллерены. Синтез и свойства соединений на их основе
- •Методы получения гидридов фуллеренов
- •Кислотность фуллеренов
- •Применение фуллеренов
- •Высокомолекулярные соединения
- •Свойства высокомолекулярных соединений
- •Основные химические реакции высокомолекулярных соединений
- •Часть II основы химической термодинамики
- •Понятия и термины химической термодинамики
- •Внутренняя энергия
- •Первое началотермодинамики
- •Следствия из первого начала термодинамики
- •Теплоемкость при постоянном объеме, сv
- •Теплоемкость при постоянном давлении
- •Равновесные процессы. Максимальная работа
- •Термохимия
- •Закон Гесса
- •Следствия из закона Гесса
- •И окончательно
- •Связь h и u химических реакций
- •Зависимость тепловых эффектов от температуры. Закон Кирхгофа
- •Совершенно очевидно, что разности Сi можно выразить через уравнение
- •Средняя теплоемкость
- •Работа тепловой машины. Теорема и цикл Карно
- •Второе начало термодинамики
- •Энтропия как критерий самопроизвольного течения процесса
- •Следовательно, если такой процесс протекает в изолированной системе, то
- •Расчет энтропии
- •Расчет изменения энтропии идеального газа
- •Задачи для самостоятельного решения
- •Принцип локального равновесия
- •Важно найти функции, определяющие зависимость deSиdiSот экспериментально измеряемых величин.
- •Статистическая интерпретация энтропии
- •Химический потенциал и химическое сродство
- •Химический потенциал
- •Химическое сродство
- •Уравнение Клапейрона-Клаузиуса
- •Термодинамические потенциалы
- •Свободная энергия Гиббса
- •Для чистого вещества
- •Условия самопроизвольного протекания процесса
- •Уравнение Гиббса-Гельмгольца
- •Тепловая теорема Нернста. Третий закон термодинамики
- •Некоторые аспекты, связанные с достижением химического равновесия
- •Изотерма химической реакции
- •Изобара химической реакции
- •Задачи для самостоятельного решения
- •Задача 7.Для реакции
- •Задача 8.Для реакции
- •Задача 10.Для реакции
- •Задача 11. Для реакции
- •Литература Основная литература
- •Дополнительная литература
Получение кетонов
1 .
Пиролиз паров кислот и их смесей над
оксидами.
.
Пиролиз паров кислот и их смесей над
оксидами.
2 .
Гидратация гомологов ацетилена.
.
Гидратация гомологов ацетилена.
3. Окисление вторичных спиртов.
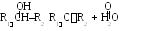
4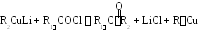 .
С хорошим выходом кетоны получают
взаимодействием хлорангидридов кислот
(R1COCl)
с литийдиалкилкупратами.
.
С хорошим выходом кетоны получают
взаимодействием хлорангидридов кислот
(R1COCl)
с литийдиалкилкупратами.
Химические свойства кетонов
1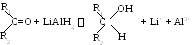 .
Восстановление кетонов
.
Восстановление кетонов
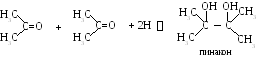
2. Присоединение синильной кислоты (нуклеофильное присоединение):
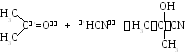
3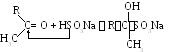 .
Взаимодействие с гидросульфитом натрия.
.
Взаимодействие с гидросульфитом натрия.
4 Взаимодействие с гидразином.
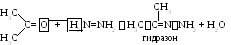
Отдельные представители
Простейший кетон – ацетон (СН3СОСН3). Смешивается с водой в любых отношениях. Пределы взрываемости в смеси с воздухом – 2,55 (нижний) – 12,8 об. % (верхний). Ионное произведение20,3, диэлектрическая проницаемость – 20,7. Ценный растворитель, но легковоспламеняющаяся жидкость, малотоксичен, сырье для синтеза изопрена, кетена.
Задачи по теме
Задача 1.Усредненная массовая доля кислорода в эквимолярной смеси двух альдегидов, соседних членов гомологического ряда, равна 31,37 %. Написать уравнение реакции «серебряного зеркала» с более легким из них.
Запишем молекулярные формулы альдегидов следующим образом.
CkH2k+1CHO Ck+1H2(k+1)+1CHO
Из условия задачи следует:
![]()
![]() ;
; ![]() ;
;
![]() .
.
Уравнение реакции имеет вид:
СН3СНО +Ag2O
![]() СН3СOOH+ 2Ag.
СН3СOOH+ 2Ag.
Задача 2.К раствору, содержащему 2,9 г альдегида, прилили избыток аммиачного раствора оксида серебра, в результате чего образовался осадок массой 10,8 г. Определить массу этого альдегида, которую нужно сжечь для получения оксида углерода (IV) количеством вещества 1 моль.
Запишем уравнение реакции «серебряного зеркала»:
CkH2k+1CHO + Ag2O = CkH2k+1COOH + 2Ag, (1)
из которого следует:
n(CkH2k+1CHO)
= 1/2n(Ag) =
![]() моль.
моль.
Следовательно, имеем:
![]() ;
; ![]() ; 2,9
= 0,7k+ 1,5;
; 2,9
= 0,7k+ 1,5;
![]() .
.
Уравнение реакции горения альдегида имеет вид:
С2Н5СНО + 3О2= 2СО2+ 3Н2О.
n(С2Н5СНО) = 1/2n(CO2). Еслиn(CO2) =1 моль, тоn(С2Н5СНО)=0,5 моль.
m(С2Н5СНО) =n(С2Н5СНО)M(С2Н5СНО) = 0,558 = 29 г.
Задача 3.При количественном окислении 15,2 г смеси паров двух предельных одноатомных спиртов, разность молярных масс которых составляет 28 г/моль, оксидом меди (II) получили соответствующие альдегиды и медь массой 19,2 г. Плотность более тяжелого альдегида по воздуху равна 2. Написать уравнения реакций окисления спиртов и рассчитать количество вещества спиртов в смеси паров.
Запишем молекулярные формулы более тяжелого из спиртов и соответствующего ему альдегида в следующем виде:
Спирт: CkH2k+1ОH
Альдегид: CрH2р+1CHO.
Очевидно, что k–p= 1.
М(CрH2р+1CHO) = 2М(воздуха).
Приведенная молярная масса воздуха равна 29 г/моль. Следовательно,
М(альдегида) = 2 29 = 58 г/моль.
14р +1 +29 = 58; р = 2; k= 2 + 1 = 3.
Молекулярные формулы более тяжелого спирта и соответствующего ему альдегида имеют вид:
СН3СН2СН2ОН и СН3СН2СНО.
Гомологическая разность равна СН2. Тогда имеем:
а М(СН2) = 28; а = 28/14 = 2.
Следовательно, в молекуле более легкого спирта на две группы СН2меньше. Молекулярные формулы этого спирта и соответствующего ему альдегида имеют вид:
СН3ОН и НСНО.
Запишем уравнения реакций окисления спиртов:
СН3ОН +CuO=HCHO+H2O+Cu(1)
С3Н7ОН +CuO=C2H5CHO+H2O+Cu. (2)
Пусть количество вещества метанола равно х, а пропилового спирта – у (структуру молекулы пропилового спирта уточнять нет необходимости).
Тогда их массы в смеси равны:
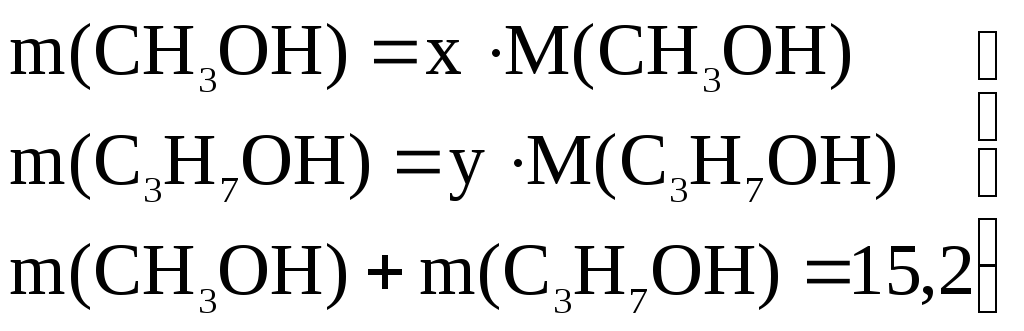 (3)
(3)
Из уравнений реакции следует:
n(спирта) = n(Cu).
Массы меди, выделившиеся по уравнениям реакций (1) и (2), равны:
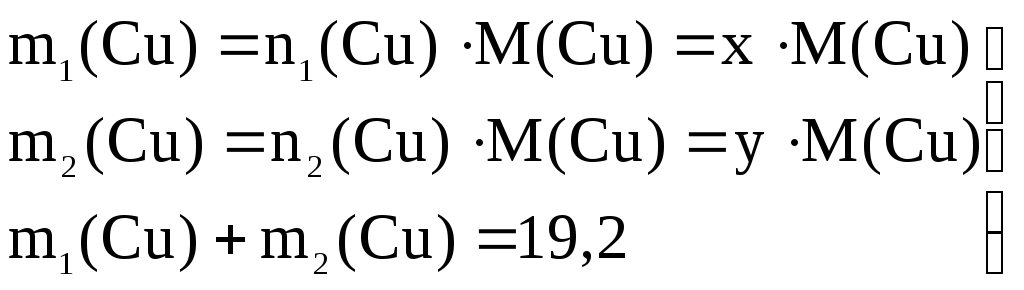 (4)
(4)
Из условий (3) и (4) составим систему из двух уравнений с двумя неизвестными:
32х + 60у = 15,2 (5)
64х + 64у = 19,2. (6)
Умножим левую и правую части уравнения (5) на 2 и вычтем из него уравнение (6).
120у – 64у = 30,4 – 19,2; 56у = 11,2.
у = n(С3Н7ОН) = 0,2 моль.
32х + 12 = 15,2; 32х = 3,2;
х = n(СН3ОН) = 0,1 моль.
