
- •В.И. Вигдорович, с.В. Романцова, н.В. Шель, и.В. Зарапина
- •Оглавление
- •Предисловие
- •Часть I. Основы органической химии
- •Структура органических соединений
- •Теория строения органических соединений а.М. Бутлерова
- •Изомерия органических соединений
- •Индуктивный и мезомерный эффекты
- •Понятие о мезомерном эффекте
- •Типы реакций органических соединений. Понятие о механизме реакции
- •Типы реакций в органической химии
- •Направление и селективность химической реакции
- •Предельные (насыщенные) углеводороды
- •Изомерия алканов.Для алканов характерен один из видов структурной изомерии – изомерия углеродной цепи (строения углеродного скелета). Приведем примеры таких изомеров:
- •Физические свойства алканов
- •Физические характеристики некоторых нормальных углеводородов
- •Влияние разветвления молекул алканов на их физические характеристики
- •Химические свойства алканов
- •Некоторые отдельные представители
- •Экологическая характеристика алканов
- •Задачи по теме
- •Циклоалканы
- •Физические свойства циклоалканов
- •Получение циклоалканов
- •Химические свойства малых циклов
- •Применение циклоалканов
- •Экологическая оценка
- •Непредельные углеводороды Алкены (олефины)
- •Физические свойства олефинов
- •Получение олефиновых углеводородов
- •Химические свойства олефинов
- •Отдельные представители олефинов
- •Экологические характеристики
- •Задачи по теме
- •Алкадиены (диеновые углеводороды)
- •Методы получение диенов
- •Химические свойства диенов
- •Каучуки
- •Экологическая характеристика
- •Задачи по теме
- •Алкины (ацетиленовые углеводороды)
- •Методы получения алкинов
- •Физические свойства алкинов
- •Химические свойства алкинов
- •Экологическая характеристика
- •Задачи по теме
- •Предельные спирты
- •Предельные одноатомные спирты
- •Получение одноатомных спиртов
- •Физические свойства первичных спиртов
- •Химические свойства одноатомных спиртов
- •Отдельные представители
- •Предельные многоатомные спирты
- •Получение двухатомных спиртов
- •Получение трехатомных спиртов
- •Физические свойства многоатомных спиртов
- •Химические свойства многоатомных спиртов
- •Экологическая характеристика
- •Задачи по теме
- •Предельные оксосоединения
- •Альдегиды
- •Получение альдегидов
- •Физические свойства альдегидов
- •Химические свойства альдегидов
- •Отдельные представители
- •Экологическая характеристика
- •Получение кетонов
- •Химические свойства кетонов
- •Отдельные представители
- •Задачи по теме
- •Карбоновые кислоты
- •Электронное строение карбоксильной группы
- •Предельные карбоновые кислоты
- •Физические свойства кислот
- •Получение карбоновых кислот
- •Химические свойства карбоновых кислот
- •Свойства отдельных представителей гомологического ряда
- •Задачи по теме
- •Азотсодержащие органические соединения
- •Нитросоединения
- •Нитрилы и изоцианиды
- •Алифатические амины
- •Физические свойства аминов
- •Получение аминов
- •Химические свойства аминов
- •Отдельные представители
- •Экологическая характеристика
- •Задачи по теме
- •Аминокислоты
- •Физические свойства α-аминокислот
- •Способы получения -аминокислот
- •Способы получения -аминокислот
- •Химические свойства аминокислот
- •Отдельные представители
- •Простые и сложные эфиры Простые эфиры
- •Способы получения простых эфиров
- •Физические свойства простых эфиров
- •Химические свойства простых эфиров
- •Отдельные представители
- •Сложные эфиры карбоновых кислот Получение сложных эфиров карбоновых кислот
- •Химические свойства эфиров карбоновых кислот
- •Физические свойства жиров
- •Химические свойства жиров
- •Сложные липиды
- •Ароматические углеводороды, арены Бензол и его производные
- •Методы получения бензола и его гомологов
- •Получение гомологов бензола
- •Физические свойства аренов
- •Химические свойства
- •Экологиченские характеристики
- •Ароматические оксосоединения Фенолы
- •Некоторые физические и термодинамические характеристики ряда фенолов
- •Получение фенола
- •Некоторые химические свойства фенола
- •Задачи по теме
- •Гетероциклические соединения
- •Пятичленные гетероциклы с одним гетероатомом
- •Химические свойства пиридина
- •Диоксины
- •Физико-химические свойства ксенобиотиков типа диоксинов
- •Источники ксенобиотиков
- •Пестициды
- •Фуллерены. Синтез и свойства соединений на их основе
- •Методы получения гидридов фуллеренов
- •Кислотность фуллеренов
- •Применение фуллеренов
- •Высокомолекулярные соединения
- •Свойства высокомолекулярных соединений
- •Основные химические реакции высокомолекулярных соединений
- •Часть II основы химической термодинамики
- •Понятия и термины химической термодинамики
- •Внутренняя энергия
- •Первое началотермодинамики
- •Следствия из первого начала термодинамики
- •Теплоемкость при постоянном объеме, сv
- •Теплоемкость при постоянном давлении
- •Равновесные процессы. Максимальная работа
- •Термохимия
- •Закон Гесса
- •Следствия из закона Гесса
- •И окончательно
- •Связь h и u химических реакций
- •Зависимость тепловых эффектов от температуры. Закон Кирхгофа
- •Совершенно очевидно, что разности Сi можно выразить через уравнение
- •Средняя теплоемкость
- •Работа тепловой машины. Теорема и цикл Карно
- •Второе начало термодинамики
- •Энтропия как критерий самопроизвольного течения процесса
- •Следовательно, если такой процесс протекает в изолированной системе, то
- •Расчет энтропии
- •Расчет изменения энтропии идеального газа
- •Задачи для самостоятельного решения
- •Принцип локального равновесия
- •Важно найти функции, определяющие зависимость deSиdiSот экспериментально измеряемых величин.
- •Статистическая интерпретация энтропии
- •Химический потенциал и химическое сродство
- •Химический потенциал
- •Химическое сродство
- •Уравнение Клапейрона-Клаузиуса
- •Термодинамические потенциалы
- •Свободная энергия Гиббса
- •Для чистого вещества
- •Условия самопроизвольного протекания процесса
- •Уравнение Гиббса-Гельмгольца
- •Тепловая теорема Нернста. Третий закон термодинамики
- •Некоторые аспекты, связанные с достижением химического равновесия
- •Изотерма химической реакции
- •Изобара химической реакции
- •Задачи для самостоятельного решения
- •Задача 7.Для реакции
- •Задача 8.Для реакции
- •Задача 10.Для реакции
- •Задача 11. Для реакции
- •Литература Основная литература
- •Дополнительная литература
Простые и сложные эфиры Простые эфиры
Простые эфиры (окиси алканов) можно представить как соединения, образованные замещением обоих атомов водорода молекулы воды двумя алкильными радикалами или замещением гидроксильного спирта алкильным радикалом.
Изомерия и номенклатура. Общая формула простых эфировROR(I) ((CnH2n+1)2O) илиCnH2n+1OCkH2k+1, гдеnk(R1OR2) (II). Последние часто называют смешанными эфирами, хотя (I) частный случай (II).
Простые эфиры изомерны спиртам (изомерия функциональной группы). Приведем примеры таких соединений:
Н3СОСН3диметиловый эфир; С2Н5ОН этиловый спирт;
Н5С2ОС2Н5диэтиловый эфир; С4Н9ОН бутиловый спирт;
Н5С2ОС3Н7этилпропиловый эфир; С5Н11ОН амиловый спирт.
Кроме того, для простых эфиров распространена изомерия углеродного скелета (метилпропиловый эфир и метилизопропиловый эфир). Оптически активные эфиры немногочисленны.
Способы получения простых эфиров
1. Взаимодействие галогенпроизводных с алкоголятами (реакция Вильямсона).
С2Н5ОNa+IC2H5Н5С2ОС2Н5+NaI
2. Дегидратация спиртов в присутствии ионов водорода как катализаторов.
2С2Н5ОH![]() Н5С2ОС2Н5
Н5С2ОС2Н5
3. Частная реакция получения диэтилового эфира.
П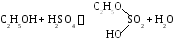 ервая
стадия:
ервая
стадия:
В торая
стадия:
торая
стадия:
Физические свойства простых эфиров
Два первых простейших представителя – диметиловый и метилэтиловый эфиры – при обычных условиях газы, все остальные – жидкости. Их Ткипмного ниже, чем соответствующих спиртов. Так, температура кипения этанола – 78,3С, а Н3СОСН3– 24С, соответственно (С2Н5)2О – 35,6С. Дело в том, что простые эфиры не способны к образованию молекулярных водородных связей, а, следовательно, и к ассоциации молекул.
Химические свойства простых эфиров
1. Взаимодействие с кислотами.
(С2Н5)2О +HCl[(С2Н5)2ОH+]Cl.
Эфир играет роль основания.
2. Ацидолиз – взаимодействие с сильными кислотами.
Н5С2ОС2Н5+ 2H2SO42С2Н5OSO3H
этилсерная кислота
Н5С2ОС2Н5+HIС2Н5OH+ С2Н5I
3. Взаимодействие со щелочными металлами.
Н5С2ОС2Н5+ 2NaС2Н5ONa+ С2Н5Na
Отдельные представители
Этиловый эфир (диэтиловый эфир) – бецветная прозрачная жидкость, малорастворимая в воде. С этиловым спиртом смешивается в любых отношениях. Тпл=116,3С, давление насыщенного пара 2,66104Па (2,2С) и 5,32104Па (17,9С). Криоскопическая константа 1,79, эбулиоскопическая –1,84. Температура воспламенения – 9,4С, образует с воздухом взрывоопасную смесь при 1,71 об. % (нижний предел) – 48,0 об. % (верхний предел). Вызывает набухание резин. Широко применяется в качестве растворителя, в медицине (ингаляционный наркоз), вызывает привыкание человека, ядовит.
Сложные эфиры карбоновых кислот Получение сложных эфиров карбоновых кислот
1. Этерификация кислот спиртами.

Гидроксил кислоты выделяется в составе воды, спирт же отдает лишь атом водорода. Реакция обратима, те же катионы катализируют и обратную реакцию.
2 .
Взаимодействие ангидридов кислот со
спиртами.
.
Взаимодействие ангидридов кислот со
спиртами.
3. Взаимодействие галогенангидридов со спиртами.
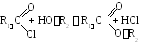
Некоторые физические свойства сложных эфиров приведены в табли- це 12.
Таблица 12
Некоторые физические свойства ряда сложных эфиров
|
Формула |
Строение радикала |
Название |
Тпл,С |
Ткип,С |
Плотность
|
|
HCOOR |
CH3 |
метилформиат |
99,0 |
31,5 |
0,975 |
|
C2H5 |
этилформиат |
80,5 |
54,3 |
0,917 | |
|
СН3СООR |
CH3 |
метилацетат |
98,1 |
57,1 |
0,924 |
|
C2H5 |
этилацетат |
83,6 |
77,1 |
0,901 | |
|
н-C3H7 |
н-пропилацетат |
92,5 |
101,6 |
0,887 | |
|
н-C4H9 |
н-бутилацетат |
76,8 |
126,5 |
0,882 |
Сложные эфиры низших карбоновых кислот и простейших спиртов – жидкости с освежающим фруктовым запахом. Употребляются как отдушки для приготовления напитков. Многие эфиры (уксусноэтиловый, уксуснобутиловый) широко применяются как растворители, особенно лаков.
