
- •На самоподготовку к занятиям по общей химии для студентов лечебного, педиатрического и медико-профилактического факультетов
- •Курск – 2003
- •I. Мотивация цели.
- •II. Цель самоподготовки.
- •III. Исходный уровень знаний.
- •IV. План изучения материала темы.
- •V. Литература.
- •VI. Вопросы для самоконтроля.
- •VII. Обязательные для выполнения задания. Индивидуальное задание № 1
- •Индивидуальное задание № 2
- •Индивидуальное задание № 3
- •Индивидуальное задание № 4
- •VIII. План работы на предстоящем занятии.
- •X мэкв. — 0,8 ммоль
- •12 Г с содержится в 44 г со2
- •300 Г с содержится в X г со2
- •Задание № 2 тема: способы выражения состава растворов. Решение задач.
- •I. Мотивация цели.
- •II. Цель самоподготовки.
- •III. Исходный уровень знаний.
- •IV. План изучения материала темы.
- •V. Литература.
- •VI. Вопросы для самоконтроля.
- •VII. Обязательные для выполнения задания. Вариант № 1
- •Вариант № 2
- •Вариант № 3
- •Вариант № 4
- •VIII. План работы на предстоящем занятии.
- •Задание № 3 тема: кислотно-основное титрование. Приготовление раствора кислоты заданной концентрации и стандартизация приготовленного раствора хлороводородной кислоты по тетраборату натрия.
- •I. Мотивация цели.
- •II. Цель самоподготовки.
- •III. Исходный уровень знаний.
- •IV. План изучения материала темы.
- •V. Литература.
- •VI. Вопросы для самоконтроля.
- •VII. Обязательные для выполнения задания. Вариант № 1
- •Вариант № 2
- •Вариант № 3
- •Вариант № 4
- •VIII. План работы на предстоящем занятии.
- •IX. Лабораторная работа.
- •Задание № 4 тема: ацидиметрическое определение щелочи в растворе.
- •I. Мотивация цели.
- •VI. Вопросы для самоконтроля.
- •VII. Обязательные для выполнения задания. Вариант № 1
- •Вариант № 2
- •Вариант № 3
- •Вариант № 4
- •VIII. План работы на предстоящем занятии.
- •Лабораторная работа ацидиметрическое определение щелочи в растворе
- •I. Мотивация цели.
- •II. Цель самоподготовки.
- •III. Исходный уровень знаний.
- •IV. План изучения материала темы.
- •V. Литература.
- •VI. Вопросы для самоконтроля.
- •VII. Обязательные для выполнения задания. Вариант № 1
- •Вариант № 2
- •Вариант № 3
- •Вариант № 4
- •VIII. План работы на предстоящем занятии.
- •Лабораторная работа
- •Задание № 6 тема: оксидиметрия. Йодометрическое определение пероксида водорода в растворе способом косвенного определения. Определение содержания свободного хлора в воде.
- •I. Мотивация цели.
- •II. Цель самоподготовки.
- •III. Исходный уровень знаний.
- •IV. Литература.
- •V. Вопросы для самоконтроля.
- •VI. Обязательные для выполнения задания. Вариант № 1
- •Вариант № 2
- •Вариант № 3
- •Вариант № 4
- •VII. План работы на предстоящем занятии.
- •Лабораторная работа определение содержания свободного хлора в воде
- •Задание № 7 тема: химическая термодинамика и биоэнергетика.
- •I. Мотивация цели.
- •II. Цель занятия.
- •III. Исходный уровень знаний.
- •IV. Цель самоподготовки.
- •V. План изучения материала темы.
- •VI. Литература.
- •VII. Вопросы для самоконтроля.
- •VIII. Обязательные для выполнения задания. Вариант № 1
- •Вариант № 2
- •Вариант № 3
- •Является ли эта реакция: г) экзотермической или д) эндотермической?
- •Вариант № 4
- •Iх. Лабораторная работа.
- •X. Примеры решения задач.
- •2‑Й способ расчёта dg - по уравнению Гиббса:
- •Задание № 8 тема: химическое равновесие. Катализ.
- •I. Мотивация цели.
- •II. Цель занятия.
- •III. Исходный уровень знаний.
- •IV. Цель самоподготовки.
- •V. План изучения материала темы.
- •VI. Литература.
- •VII. Вопросы для самоконтроля.
- •VIII. Обязательные для выполнения задания. Вариант № 1
- •Вариант № 2
- •Вариант № 3
- •Вариант № 4
- •IX. План работы на предстоящем занятии.
- •Лабораторная работа
- •Мотивация цели.
- •II. Цель самоподготовки.
- •III. Исходный уровень знаний.
- •IV. План изучения материала данной темы.
- •V. Литература.
- •VI. Вопросы для самоподготовки.
- •VII. Обязательные для выполнения задания.
- •VIII. План работы на предстоящем занятии.
- •Задание № 11 тема: кинетика сложных реакций, ферментативный катализ.
- •Мотивация цели.
- •II. Цель самоподготовки.
- •III. Исходный уровень знаний/
- •IV. План изучения материала данной темы.
- •V. Литература.
- •VI. Вопросы для самоконтроля.
- •Лабораторная работа
- •Опыт № 3. Влияние катализатора на скорость химической реакции.
- •VII. План работы на предстоящем занятии.
- •Задание № 12 тема: основы фармакокинетики.
- •I. Мотивация цели.
- •II. Цель самоподготовки.
- •VII. Обязательные для выполнения задания.
- •VIII. План работы на предстоящем занятии.
- •Задание № 13 тема: гетерогенное равновесие. Произведение растворимости.
- •I. Мотивация цели.
- •II. Цель самоподготовки.
- •VII. Обязательные для выполнения задания. Вариант № 1
- •Вариант № 2
- •Вариант № 3
- •Вариант № 4
- •Iх. План работы на предстоящем занятии.
- •Лабораторная работа
- •Задание № 14 тема: комплексные соединения.
- •I. Мотивация цели.
- •II. Цель занятия.
- •III. Исходный уровень знаний.
- •IV. Цель самоподготовки.
- •V. План изучения материала.
- •VI. Вопросы для самоконтроля.
- •VII. Обязательные для выполнения задания. Вариант № 1
- •Вариант № 2
- •Вариант № 3
- •Вариант № 4
- •VIII. Литература.
- •IX. Лабораторная работа.
- •X. Приложение. Примеры решения задачи.
- •Задание № 16 зачетное занятие
- •I. Мотивация цели.
- •II. Цель самоподготовки.
- •III. Исходный уровень знаний.
- •IV. План изучения материала данной темы.
- •V. Основная литература.
- •VI. Вопросы для самоподготовки.
- •VII. Обязательные для выполнения задания.
- •VIII. План работы на предстоящем занятии.
- •Задание № 18 тема: равновесные биохимические процессы. Водородный показатель. Определение рН растворов.
- •I. Мотивация цели.
- •II. Цель самоподготовки.
- •III. Исходный уровень знаний.
- •II. План изучения материала данной темы.
- •V. Основная литература.
- •VI. Вопросы для самоконтроля.
- •VII. Обязательные для выполнения задания.
- •VIII. План работы на предстоящем занятии.
- •Задание № 19 тема: гидролиз солей.
- •I. Мотивация цели.
- •II. Цель занятия.
- •III. Исходный уровень знаний.
- •IV. Цель самоподготовки.
- •V. План изучения материала темы.
- •VI. Литература.
- •VII. Вопросы для самоконтроля.
- •VIII. Обязательные для выполнения задания. Вариант № 1
- •Вариант № 2
- •Вариант № 3
- •Вариант № 4
- •IX. Лабораторная работа.
- •Задание № 20 тема: буферные растворы и их свойства. Буферные системы организма и кислотно-щелочное равновесие. Колориметрическое определение рН буферных растворов
- •I. Мотивация цели.
- •II. Цель самоподготовки.
- •III. Исходный уровень знаний.
- •IV. Основная литература.
- •VI. Вопросы для самоконтроля.
- •VII. Обязательные для выполнения задания. Вариант № 1
- •Вариант № 2
- •Вариант № 3
- •Вариант № 4
- •План работы на занятии.
- •Iх. Лабораторная работа.
- •Задание № 21 koнтрольная работа № 3 тема: коллигативные свойства растворов. PH. Гидролиз солей. Буферные растворы.
- •I. Мотивация цели.
- •II. Цель самоподготовки.
- •III. План подготовки, литература и вопросы для самоконтроля.
- •IV. Вариант билета.
- •Задание № 22 тема: химия элементов.
- •Мотивация цели.
- •II. Цель самоподготовки.
- •III. Исходный уровень знаний.
- •IV. План изучения материала данной темы.
- •V. Литература.
- •VI. Вопросы для самоподготовки.
- •VII. Обязательные для выполнения задания.
- •VIII. План работы на предстоящем занятии.
- •Задание № 23 тема: химия s-элементов.
- •Мотивация цели.
- •II. Цель самрподготовки.
- •III. Исходный уровень знаний.
- •IV. План изучения материала.
- •V. Литература.
- •VI. Вопросы для самоподготовки.
- •VII. Обязательные для выполнения задания.
- •VIII. План работы на предстоящем занятии.
- •Задание № 24 тема: химия р‑элементов.
- •I. Мотивация цели.
- •II. Цель самоподготовки.
- •III. Исходный уровень знаний.
- •IV. План изучения материала данной темы.
- •V. Литература.
- •VI. Вопросы для самоподготовки.
- •VII. Обязательные для выполнения задания.
- •VIII. План работы на предстоящем занятии.
- •Задание № 25 тема: химия d‑элементов.
- •I. Мотивация цели.
- •II. Цель самоподготовки.
- •III. План изучения материала.
- •IV. Литература.
- •V. Вопросы для самоконтроля.
- •VI. Обязательные для выполнения задания.
- •VII. План работы на предстоящем занятии.
- •Задание № 26 тема: окружающая среда. Биологическая роль химических элементов.
- •I. Мотивация цели.
- •VI. Вопросы для самоконтроля.
- •Задание № 27 тема: биологическая роль s-элементов.
- •I. Мотивация цели.
- •VI. Вопросы для самоконтроля.
- •VII. Проблемные и ситуационные задачи для самоконтроля.
- •VIII. План работы на предстоящем занятии.
- •Лабораторная работа
- •Растворимость солей s-элементов
- •Задание № 28 тема: биологическая роль р -элементов.
- •I. Motивация цели.
- •II. Цель самоподготовки.
- •III. Исходный уровень знаний.
- •IV. План изучения материала темы.
- •V. Литература.
- •VI. Вопросы для самоконтроля.
- •VII. Ситуационные и проблемные задачи.
- •VIII. План работы на предстоящем занятии.
- •Лабораторная работа
- •Задание № 29 тема: биологическая роль d-элементов.
- •I. Мотивация цели.
- •II. Цель самоподготовки.
- •III. Исходный уровень знаний.
- •IV. План изучения материала темы.
- •V. Литература.
- •VI. Вопросы для самоконтроля.
- •VII. Ситуационные и проблемные задачи.
- •VIII. План работы на предстоящем занятии.
- •Лабораторная работа
- •Задание № 30 тема: химические основы питания.
- •I. Мотивация цели.
- •II. Цель занятия.
- •III. Исходный уровень знаний.
- •IV. ЛитературА.
- •V. План изучения материала темы.
- •VI. Цель самоподготовки.
- •VII. Вопросы для самоконтроля.
- •Задание № 31 тема: физико-химия поверхностных явлений.
- •I. Мотивация цели.
- •II. Цель самоподготовки.
- •III. План изучения материала данной темы.
- •IV. Исходный уровень знаний.
- •V. Литература.
- •VI. Вопросы для самоконтроля.
- •Лабораторная работа
- •Задание № 32 тема: физико-химия дисперсных систем.
- •I. Мотивация цели.
- •II. Цель самоподготовки.
- •III. Исходный уровень знаний.
- •IV. План изучения материала данной темы.
- •V. Литература.
- •VI. Вопросы для самоподготовки.
- •VI. План работы на предстоящем занятии.
- •Задание № 33 тема: Физико-химия растворов вмс.
- •I. Мотивация цели.
- •II. Цель самоподготовки.
- •VI. План работы на предстоящем занятии.
- •Задание № 34 тема: электрохимия, электропроводность растворов и тканей организма.
- •I. Мотивация цели.
- •II. Цель самоподготовки.
- •VI. Обязательные для выполнения задания. Вариант 1
- •Вариант 2
- •Вариант 3
- •VIII. План работы на предстоящем занятии.
- •Лабораторная работа
- •Задание № 35 контрольная работа № 4
- •I. Цель самоподготовки.
- •Билет № 13
- •Задание № 36 Зачетное занятие
- •Содержание
- •305041, Г. Курск, ул. К. Маркса, 3.
- •305041, Г. Курск, ул. К. Маркса, 3. Заказ № 862.
Вариант № 2
1. Напишите выражения для констант равновесия реакций:
а) N2 + О2 Û 2 NО2 — Q ; б) СО2 + Н2 Û СО + Н2О + Q;
в) Fe2О3 + 3 Н2Û 2 Fe + 3 Н2О.
Примените к этим реакциям принцип Ле-Шателье и перечислите условия, приводящие к сдвигу равновесия вправо.
2. Какие эффекты возникают при регулярном приёме соляной кислоты в связи с низкой кислотностью желудочного сока? Что может произойти при резком прекращении приёма и как этого избежать?
Константа равновесия реакции (К):
2 NО (г) + Сl2 (г) Û 2 NОСl (г)
равна 0,42. Равновесные концентрации: [NО] = 0,4 моль/л; [Сl2] = 0,15 моль/л. Найдите концентрации исходных вещесв до реакции. Каковы степени превращения этих реагентов?
Вариант № 3
1. Напишите выражения для констант равновесия реакций:
а) Fe2O3 + 4Н2 Û 3Fe + 4Н2О (г) ; б) 2NО + Сl2 Û 2NОСl (г) ;
в) Н2СО3(р) Û Н2О(ж) + СО2(р).
Примените к ним принцип Ле-Шателье и перечислите условия, приводящие к сдвигу равновесия вправо.
2. Какие эффекты возникают при регулярном приёме соды при высокой кислотности желудочного сока? Что может произойти при резком прекращении её приёма и как этого можно избежать?
3. Константа равновесия реакции:
Н2(г) + J2 (г) Û 2НJ
равна 80, равновесная концентрация йода 0,1 моль/л. Найти исходные концентрации йода и водорода и степени превращения реагентов.
Вариант № 4
1. Напишите выражения для констант равновесия реакций:
а) СН3СООН(р) Û СН3СОО-(р) + Н+ (р); б) NН4ОН(р) Û NН4+ + ОН-;
в) N2 + 3Н2 Û 2NН3 + Q.
Равновесие которых реакций: а) сдвигается вправо при повышении температуры; б) не зависит от давления?
2. Как повлияют на потребность организма в воде: а) употребление селёдки; б) работа летом на солнце; в) купание в реке; г) принятие горячей ванны; д) употребление алкоголя? При каких условиях потребность организма в воде минимальна?
3. Равновесие в системе:
2NО + О2 Û 2NО2
установилось при следующих значениях равновесных концентраций:
[NО2] = 0,06 моль/л, [NО] = 0,024 моль/л. Найти константу равновесия и концентрации NО и О2 до начала реакции.
IX. План работы на предстоящем занятии.
1. Тест-эталонный контроль.
2. Решение задач, разбор теоретического материала.
3. Выполнение лабораторной работы «Влияние различных факторов на смещение химического равновесия». «Влияние катализатора на скорость химической реакции».
Лабораторная работа
Изучение влияния различных факторов на химическое равновесие
1. Смешайте в пробирке по 1 мл разбавленных растворов хлорида железа (III) и роданида калия, разбавьте полученную смесь дистиллированной водой, перемешайте и содержимое разлейте на четыре пробирки по 1 мл.
В одну пробирку добавьте концентрированный раствор роданида калия КСNS, в другую – концентрированный раствор хлорида железа (III), в третью – кристаллический КСl, а четвертую оставьте для сравнения. Считая, что интенсивность окраски пропорциональна концентрации получаемого по обменной реакции роданида железа (III), объясните наблюдаемые эффекты.
2. В две пробирки налить по 2 мл раствора крахмала и добавить по 2 капли 0,1 н. раствора йода. Окраску смеси даёт соединение между крахмалом и йодом (прямая реакция). Одну пробирку нагрейте на спиртовке и затем охладите водой, а другую оставьте для сравнения. Сделайте вывод о том, какая реакция (прямая или обратная) является экзотермической, а какая эндотермической?
3. В пробирку налейте 2 мл 10%-ного раствора пероксида водорода и поместите твердый оксид марганца (IV) на кончике микрошпателя. Какой газ выделяется? Определите с помощью тлеющей лучинки. Чем является MnO2 в данной реакции? Можете ли Вы сказать по изменению температуры, является ли реакция экзо- или эндотермической? Классифицируйте данный случай катализа. Влияет ли количество катализатора на скорость реакции? Если сомневаетесь, проделайте её ещё раз с цельным микрошпателем вещества. Объясните результат. Оформите уравнение данной каталитической реакции также и как термохимическое и укажите тепловой эффект, если
DН0обр(Н2Ож) = —286 кДж/моль.
4. Из проделанных реакций выберите обратимые. В каких из них в ходе опыта меняется значение константы равновесия? Напишите её выражение для первой реакции.
Х. ПРИЛОЖЕНИЕ.
ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
Пример № 1. В закрытом сосуде смешали SО2 и О2. Их исходные концентрации равны, соответственно, 4 и 2 моль/л. При нагревании смеси до 400°С наступило равновесие. Найти равновесные концентрации компонентов и константы равновесия КС и КР, если к моменту наступления равновесия прореагировало 80% SО2.
РЕШЕНИЕ:
1. В реакцию вступило 4 х 0,8 = 3,2 моль/л SО2.
2 SО2(г) + О2 (г) Û 2 SО3(г) Концентрации, моль/л
4 2 0 исходные
3,2 1,6 3,2 участвующие в реакции
0,8 0,4 3,2 равновесные
Цифры второй графы схемы пропорциональны стехиометрическим коэффициентам. При ходе реакции слева направо 3-я графа равна 1-я минус 2-я для исходных веществ и 1-я + 2-я - для продуктов. Схема применима для количеств молей любых веществ, а для молярных концентраций - только газообразных и растворенных.
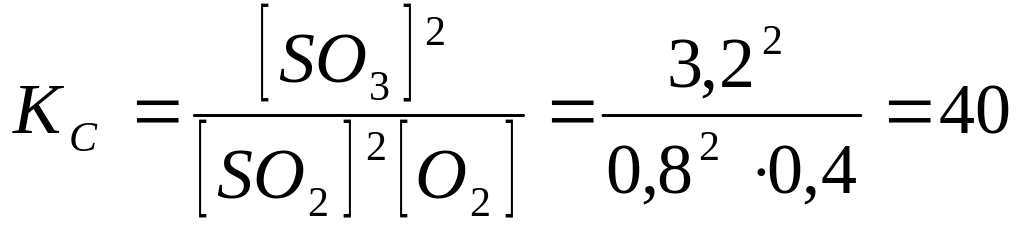
2. Для каждого компонента смеси по уравнению Клапейрона-Менделеева парциальное давление:
р = сR T.
При расчёте в атмосферах для равновесия.
p ( SО2 ) = 0,8 моль/л × 0,082 л×атм/моль × К × ( 400 + 273 ) К = 44,1 атм.
р ( О2 ) = 0,4 моль/л × 0,082 л × атм/моль × К × ( 400 + 273 ) К = 22,1 атм.
р ( SО3 ) = 3,2 моль/л × 0,082 л × атм/моль × К × ( 400 + 273 ) К = 176,4 атм.
![]()
Пример № 2. При некоторой температуре константа равновесия реакции синтеза НI К равна 50, а равновесные концентрации I2 - 0,1 моль/л, Н2 ‑ 5 моль/л. Найдите исходные концентрации веществ.
РЕШЕНИЕ: Найдем равновесную концентрацию НI :
![]() =
=
Схему заполняем в обратном порядке и производим действия, обратные действиям первой задачи. Исходную концентрацию продукта реакции НJ считаем равной нулю:
Н2(г) + I2 (г) <‑---> 2 НI (г) Концентрации, моль/л
7,5 2,6 0 Исходные
2,5 2,5 5 Участвующие в реакции
5 0,1 5 Равновесные
Пример № 3. Какие эффекты могут возникнуть при длительном назначении гормона (витамина, фермента, препарата) и как их предотвратить?
ОТВЕТ: При длительном назначении гормона равновесие реакции его синтеза организмом сдвигается влево, синтез замедляется и образующий его орган может утратить эту функцию. При резком прекращении приёма гормона возникает его острая нехватка. Поэтому при назначении гормона должны соблюдаться следующие условия:
а) строгое дозирование, возможны кратковременные перерывы;
б) параллельное лечение для устранения причины недостатка;
в) в конце срока приёма рекомендуется постепенное снижение дозы.
ЗАДАНИЕ № 9
КОНТРОЛЬНАЯ РАБОТА № 1
СПОСОБЫ ВЫРАЖЕНИЯ СОСТАВА РАСТВОРОВ.
РЕАКЦИИ ОКИСЛЕНИЯ-ВОССТАНОВЛЕНИЯ.
ТЕРМОДИНАМИКА. РАВНОВЕСИЕ.
Вопросы для самоконтроля и список литературы смотрите в приложениях № 1-8.
ЗАДАНИЕ № 10
ТЕМА: ХИМИЧЕСКАЯ КИНЕТИКА ПРОСТЫХ РЕАКЦИЙ.
