
- •Э.А. Гюннер, в.Ф. Шульгин общая химия
- •Введение Предмет и структура химии
- •1. Химическая атомистика
- •1.1. Основные положения и понятия химической атомистики
- •1.2. Стехиометрические законы химии
- •1.3. Методы определения молекулярных масс и атомных масс
- •Методы определения молекулярных масс.
- •1.3.2. Методы определения атомных масс.
- •2. Основы теории строения атома
- •2.1. Предпосылки возникновения квантово-механической теории
- •2.2. Постулаты квантово-механической теории
- •2.3. Волновая функция. Уравнение Шредингера
- •2.4. Атом водорода. Одноэлектронные атомарные ионы
- •2.5. Многоэлектронные атомы
- •3. Периодический закон д.И. Менделеева в свете квантово-механических представлений
- •3.1. Современная формулировка Периодического закона
- •3.2. Структура периодической системы элементов: периоды, группы, подгруппы элементов
- •3.3. Закономерности изменения свойств элементов в периодах и подгруппах периодической системы
- •3.3.1. Эффективный заряд ядра.
- •3.3.2. Атомные радиусы.
- •3.3.3. Энергия ионизации.
- •3.3.4. Сродство к электрону.
- •3.3.5. Электроотрицательность.
- •3.3.6. Степени окисления элементов.
- •3.4. Элементы-аналоги. Виды аналогии в периодической системе элементов
- •3.4.1. Групповая аналогия.
- •3.4.2. Типовая аналогия.
- •3.4.3. Электронная аналогия.
- •VI группа I группа
- •3.4.4. Слоевая аналогия.
- •3.4.5. Контракционная аналогия (шринк-аналогия).
- •3.4.6. Горизонтальная аналогия.
- •3.4.7. Диагональная аналогия.
- •4. Атомное ядро. Радиоактивность
- •4.1. Элементарные частицы
- •4.2. Теория строения атомных ядер
- •4.3. Ядерные реакции
- •4.4.Радиоактивность. Типы радиоактивного распада
- •4.5. Законы радиоактивного распада
- •4.6. Естественная радиоактивность. Радиоактивные ряды. Радиоактивное равновесие
- •4.7. Искусственная радиоактивность. Изотопная индикация
- •4.8. Новые химические элементы
- •4.9. Эволюция элементов во Вселенной
- •5. Химическая связь и строение молекул
- •5.1. Химическая связь. Параметры химической связи. Валентность
- •5.2. Метод валентных связей
- •5.2.1. Основные принципы метода валентных связей.
- •5.2.2. Насыщаемость ковалентной связи. Механизм образования двухцентровой связи.
- •5.2.3. Направленность ковалентной связи. Гибридизация электронных орбиталей.
- •5.2.4. Кратность ковалентной связи.
- •5.2.5. Делокализованные многоцентровые связи. Теория резонанса.
- •5.2.6. Предсказание геометрической формы молекул.
- •5.2.7. Неполярные и полярные связи. Типы ковалентных молекул.
- •5.2.8. Недостатки метода валентных связей.
- •5.3. Метод молекулярных орбиталей
- •5.3.1. Основные принципы метода молекулярных орбиталей.
- •5.3.2. Применение метода молекулярных орбиталей.
- •5.3.2.1. Двухатомные молекулы.
- •5.3.2.2. Молекулы, состоящие из трех и более атомов.
- •5.4. Ионная связь
- •5.4.1. Особенности ионной связи. Свойства ионных соединений.
- •5.4.2. Типы кристаллических решеток ионных соединений. Ионные радиусы.
- •5.3.3. Энергия ионной кристаллической решетки.
- •5.4.4. Поляризация ионов.
- •5.5. Металлическая связь. Зонная теория кристаллов
- •5.6. Межмолекулярное взаимодействие
- •5.7. Водородная связь
- •6. Координационные соединения
- •6.1. Координационные соединения. Основные положения координационной теории
- •6.2. Классификация координационных соединений
- •6.3. Номенклатура координационных соединений
- •6.4. Изомерия координационных соединений
- •6.5. Химическая связь в координационных соединениях
- •6.5.1. Метод валентных связей
- •6.2. Теория кристаллического поля
- •6.3. Метод молекулярных орбиталей
- •6.7. Реакции внешнесферного и внутрисферного замещения. Принцип транс-влияния
- •7. Агрегатные состояния вещества
- •7.1. Типы агрегатного состояния
- •7.2. Твердое состояние вещества
- •7.2.1. Кристаллическое состояние.
- •7.2.2. Аморфное состояние.
- •7.3. Жидкое состояние вещества
- •7.4. Газообразное состояние вещества
- •7.5. Плазма
- •8. Теория химических процессов
- •8.1. Предмет и основные понятия теории химических процессов
- •8.2. Основы химической термодинамики
- •8.2.1. Термодинамические функции. Внутренняя энергия и первый закон термодинамики. Энтальпия.
- •8.2.2. Термохимия. Закон Гесса.
- •8.2.3. Энтропия. Второй и третий законы термодинамики.
- •8.2.4. Свободная энергия Гиббса. Направление химического процесса.
- •8. Химическая кинетика
- •8.3.1. Предмет химической кинетики. Скорость химической реакции. Энергия активации.
- •8.3.2. Факторы, влияющие на скорость химической реакции. Катализаторы и катализ.
- •8.3.3. Кинетическая классификация реакций.Молекулярность и порядок реакции. Механизмы реакций.
- •8.3.4. Некоторые типы многостадийных реакций.
- •8.4. Химическое равновесие
- •8.4.1. Обратимые и необратимые реакции. Состояние химического равновесия.
- •8.4.2. Смещение химического равновесия.
- •9. Растворы
- •9.1. Общая характеристика растворов
- •9.2. Разбавленные растворы неэлектролитов. Коллигативные свойства растворов
- •9.3. Растворы электролитов
- •9.3.1. Электролиты. Теория электролитической диссоциации (ионизации).
- •9.3.2. Теория растворов слабых электролитов.
- •9.3.2.1. Степень ионизации слабых электролитов и методы ее определения.
- •9.3.2.2. Равновесия в растворах слабых электролитов.
- •6,5·10-4 Моль/л
- •9.3.3. Теория сильных электролитов.
- •9.3.4. Обменные реакции в растворах электролитов.
- •9.3.4.1. Типы обменных реакций в растворах электролитов.
- •9.3.4.2. Гидролиз солей.
- •9.3.5. Теории кислот и оснований.
- •9.3.6. Окислительно-восстановительные реакции в растворах.
- •9.3.6.1.Общая характеристика окислительно-восстановительных реакций.
- •9.3.6.2. Составление уравнений окислительно-восстановительных реакций.
- •9.3.6.3. Электродные потенциалы. Направление окислительно-восстановительных реакций. Гальванический элемент.
- •9.3.6.4. Электролиз.
- •9.4. Коллоидные растворы
- •9.4.1. Общая характеристика коллоидных растворов и методы их получения.
- •9.4.2. Строение коллоидных частиц.
- •9.5. Твердые растворы
- •Список рекомендуемой литературы
8.4.2. Смещение химического равновесия.
Если в системе установилось химическое равновесие, концентрации реагентов и продуктов реакции могут оставаться постоянными сколь угодно долго. Однако изменение условий, в которых находится система, может привести к нарушению равновесия. При этом равенство (8-62) будет нарушено в результате изменения либо концентраций участвующих во взаимодействии веществ, либо значения константы равновесия. В результате какое-то время одна из реакций (прямая или обратная) будет протекать со скоростью, превышающей скорость второй реакции; спустя некоторое время равновесие в системе восстановится, но уже при других значениях равновесных концентраций.
Изменение равновесных концентраций, обусловленное нарушением условий равновесия, называется смещением равновесия. Если при этом увеличиваются равновесные концентрации продуктов реакции, говорят о смещении равновесия в сторону прямой реакции, при увеличении концентраций реагентов - в сторону обратной реакции. Смещение равновесия может быть вызвано изменением концентраций, температуры и давления.
Пусть система с обратимой реакцией
aA + bB dD + eE (8-59)
находится в состоянии равновесия. Введем в систему некоторое количество вещества А. Тогда концентрации всех веществ перестанут быть равновесными и примут значения СА, СВ, СD и CE. Рассмотрим уравнение
 (8-68)
(8-68)
и сопоставим его с уравнением (8-62)
![]()
Поскольку СА > [A], константа равновесия К > X. Для того чтобы в системе вновь установилось равновесие, должно произойти смещение в сторону реакции, идущей с уменьшением концентраций веществ А и В, т.е. в сторону прямой реакции, сопровождающейся расходованием этих веществ. Аналогично, удаление из системы некоторого количества вещества В вызовет смещение равновесия в сторону процесса, при котором вещество В образуется, т.е. в сторону обратной реакции.
Влияние температуры на смещение равновесий рассмотрим на примере обратимой одностадийной реакции типа (8-59). В этом случае, как следует из уравнения (8-62), константа равновесия
![]()
где k1 и k2 - константы скорости прямой и обратной реакции. Повышение температуры увеличивает скорость как прямой, так и обратной реакции, но не в одинаковое число раз. В результате при изменении температуры значение константы равновесия будет изменяться, в выражении (8-62) правая часть перестанет равняться левой, и равновесие нарушится. Если значение К увеличится, равновесие сместится в сторону прямой реакции, так как уменьшение концентраций А и В приводит к увеличению правой части выражения (8-62). Уменьшение значения К вызовет смещение равновесия в сторону обратной реакции, сопровождающейся уменьшением концентраций D и Е.
В соответствии с (8-44) константы скорости прямой и обратной реакций выражаются уравнениями:
![]() ,
,
![]() ,
,
где
![]() и
и
![]() - энергии активации прямой и обратной
реакции. Отсюда
- энергии активации прямой и обратной
реакции. Отсюда
 ,
,
где
![]()
Но, согласно (8-37), разность энергий активации прямой и обратной реакций равна тепловому эффекту процесса ΔН, откуда
![]()
Пусть
прямая реакция для процесса (8-59)
экзотермична (ΔН<0). Тогда показатель
степени
![]() больше нуля, и повышение температуры
сопровождается уменьшением значения
К, что указывает на смещение равновесия
в сторону обратной реакции, идущей с
поглощением тепла и, следовательно, с
понижением температуры. Если прямая
реакция эндотермична (ΔН>0), то величина
отрицательна; в этом случае повышение
температуры приводит к увеличению
константы равновесия, то есть к смещению
равновесия в сторону прямой реакции,
при протекании которой теплота выделяется,
а температура системы повышается.
Например, для обратимой реакции
больше нуля, и повышение температуры
сопровождается уменьшением значения
К, что указывает на смещение равновесия
в сторону обратной реакции, идущей с
поглощением тепла и, следовательно, с
понижением температуры. Если прямая
реакция эндотермична (ΔН>0), то величина
отрицательна; в этом случае повышение
температуры приводит к увеличению
константы равновесия, то есть к смещению
равновесия в сторону прямой реакции,
при протекании которой теплота выделяется,
а температура системы повышается.
Например, для обратимой реакции
COCl2
CO +Cl2;
ΔН![]() =
108,97 кДж
=
108,97 кДж
повышение температуры смещает равновесие в сторону прямой реакции, а понижение температуры - в сторону обратной реакции.
Изменение давления существенно смещает равновесия в тех случаях, когда во взаимодействии участвуют газообразные соединения, так как при протекании подобных реакций часто наблюдается изменение давления. Реакции, сопровождающиеся увеличением числа молекул газов, протекают с повышением давления; реакции, в результате которых число молекул газом уменьшается, сопровождаются понижением давления.
Пусть в системе протекает реакция
mA(г) nВ(г) (8-69)
Поскольку давление газа пропорционально его концентрации, константа равновесия реакции (8-69) может быть выражена через парциальные давления газов, участвующих во взаимодействии:
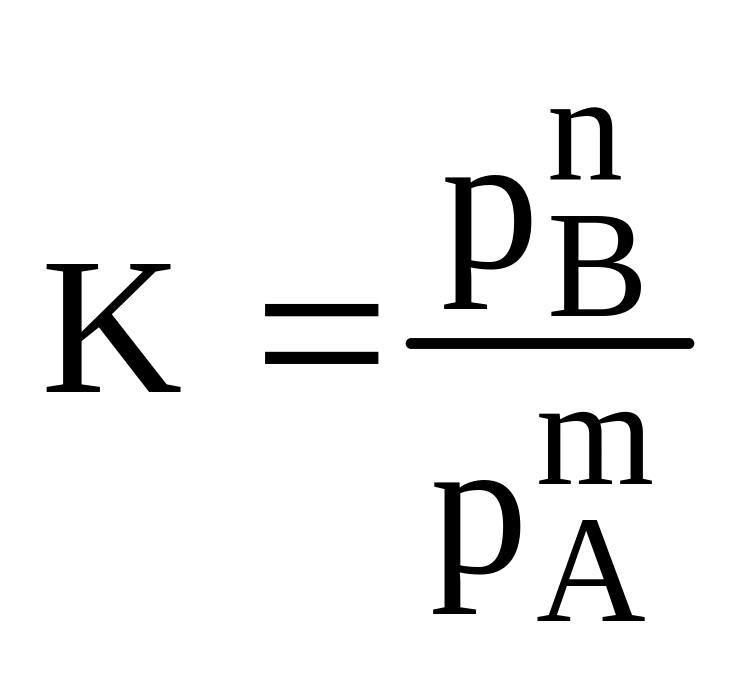 (8-70)
(8-70)
При увеличении давления газовой смеси в r раз давления этих газов составят:
![]()
![]()
Отношение этих давлений, взятых в степенях m и n,
 ,
(8-71)
,
(8-71)
где К - константа равновесия реакции (8-69). Если n>m, т.е. реакция сопровождается увеличением давления, то K<X. В этом случае равновесие сместится в сторону процесса, идущего с понижением давления реакционной смеси, т.е. в сторону обратной реакции. Если n<m, то K>X, а равновесие при повышении давления сместится в сторону прямой реакции.
Сопоставляя результаты влияния изменения концентраций, температуры и давления на смещение равновесия, можно заключить, что во всех случаях наблюдается противодействие системы произведенному изменению. Так, при повышении концентрации одного из веществ равновесие смещается в сторону реакции, при которой это вещество расходуется. Повышение температуры сопровождается смещением равновесия в сторону процесса, идущего с поглощением теплоты и понижением температуры. Повышение давления приводит к смещению равновесия в сторону процесса, сопровождающегося понижением давления. Закономерности смещения равновесия выражает принцип Ле Шателье (1884), который может быть сформулирован следующим образом:
Если на систему, находящуюся в состоянии химического равновесия, оказывать внешнее воздействие, то равновесие смещается в сторону процесса, ослабляющего оказанное воздействие.
Введение в систему катализатора не вызывает смещения равновесия, так как катализатор одинаково изменяет скорость как прямой, так и обратной реакции. С помощью катализатора, таким образом, невозможно увеличить выход того или иного вещества в химическом процессе. Однако катализатор ускоряет переход системы в состояние равновесие.
Проиллюстрируем принцип Ле Шателье на примере обратимой реакции синтеза аммиака:
N2 + 3H2 2NH3; ΔН = -92,38 кДж
Отвечающая этому процессу прямая реакция экзотермична и сопровождается уменьшением давления, так как при ее протекании из четырех молекул азота и водорода образуются две молекулы аммиака. Это равновесие можно сместить в сторону образования аммиака, оказывая на систему следующие воздействия:
1) увеличивая концентрацию азота или водорода;
2) уменьшая концентрацию аммиака;
3) повышая давление в системе;
4) понижая температуру.
Соответственно синтез аммиака проводят при максимально высоких давлениях и не слишком высокой температуре (450 – 500 ˚С). При более низких температурах синтез аммиака не осуществляют: равновесие при этом устанавливалось бы слишком медленно. Для сокращения времени достижения равновесия также используют катализатор - железо с некоторыми добавками.
От истинного химического равновесия следует отличать ложные равновесия - состояния системы, в случае которых концентрации взаимодействующих веществ остаются практически постоянными в связи с тем, что скорости прямой и обратной реакций очень малы. Для системы в состоянии ложного равновесия ΔG ≠ 0; изменение концентраций в такой системе не является обратимым. Примером системы в состоянии ложного равновесия может служить смесь водорода и кислорода при стандартных условиях. Состав такой смеси практически не изменяется во времени. Если температуру повысить до 500 ˚С, реакция образования воды начнет протекать с заметной скоростью, в результате чего концентрации водорода и кислорода уменьшатся. Если систему вновь вернуть к стандартным условиям, прежние значения концентраций не восстановятся: ложное равновесие не является динамическим.
