
- •Э.А. Гюннер, в.Ф. Шульгин общая химия
- •Введение Предмет и структура химии
- •1. Химическая атомистика
- •1.1. Основные положения и понятия химической атомистики
- •1.2. Стехиометрические законы химии
- •1.3. Методы определения молекулярных масс и атомных масс
- •Методы определения молекулярных масс.
- •1.3.2. Методы определения атомных масс.
- •2. Основы теории строения атома
- •2.1. Предпосылки возникновения квантово-механической теории
- •2.2. Постулаты квантово-механической теории
- •2.3. Волновая функция. Уравнение Шредингера
- •2.4. Атом водорода. Одноэлектронные атомарные ионы
- •2.5. Многоэлектронные атомы
- •3. Периодический закон д.И. Менделеева в свете квантово-механических представлений
- •3.1. Современная формулировка Периодического закона
- •3.2. Структура периодической системы элементов: периоды, группы, подгруппы элементов
- •3.3. Закономерности изменения свойств элементов в периодах и подгруппах периодической системы
- •3.3.1. Эффективный заряд ядра.
- •3.3.2. Атомные радиусы.
- •3.3.3. Энергия ионизации.
- •3.3.4. Сродство к электрону.
- •3.3.5. Электроотрицательность.
- •3.3.6. Степени окисления элементов.
- •3.4. Элементы-аналоги. Виды аналогии в периодической системе элементов
- •3.4.1. Групповая аналогия.
- •3.4.2. Типовая аналогия.
- •3.4.3. Электронная аналогия.
- •VI группа I группа
- •3.4.4. Слоевая аналогия.
- •3.4.5. Контракционная аналогия (шринк-аналогия).
- •3.4.6. Горизонтальная аналогия.
- •3.4.7. Диагональная аналогия.
- •4. Атомное ядро. Радиоактивность
- •4.1. Элементарные частицы
- •4.2. Теория строения атомных ядер
- •4.3. Ядерные реакции
- •4.4.Радиоактивность. Типы радиоактивного распада
- •4.5. Законы радиоактивного распада
- •4.6. Естественная радиоактивность. Радиоактивные ряды. Радиоактивное равновесие
- •4.7. Искусственная радиоактивность. Изотопная индикация
- •4.8. Новые химические элементы
- •4.9. Эволюция элементов во Вселенной
- •5. Химическая связь и строение молекул
- •5.1. Химическая связь. Параметры химической связи. Валентность
- •5.2. Метод валентных связей
- •5.2.1. Основные принципы метода валентных связей.
- •5.2.2. Насыщаемость ковалентной связи. Механизм образования двухцентровой связи.
- •5.2.3. Направленность ковалентной связи. Гибридизация электронных орбиталей.
- •5.2.4. Кратность ковалентной связи.
- •5.2.5. Делокализованные многоцентровые связи. Теория резонанса.
- •5.2.6. Предсказание геометрической формы молекул.
- •5.2.7. Неполярные и полярные связи. Типы ковалентных молекул.
- •5.2.8. Недостатки метода валентных связей.
- •5.3. Метод молекулярных орбиталей
- •5.3.1. Основные принципы метода молекулярных орбиталей.
- •5.3.2. Применение метода молекулярных орбиталей.
- •5.3.2.1. Двухатомные молекулы.
- •5.3.2.2. Молекулы, состоящие из трех и более атомов.
- •5.4. Ионная связь
- •5.4.1. Особенности ионной связи. Свойства ионных соединений.
- •5.4.2. Типы кристаллических решеток ионных соединений. Ионные радиусы.
- •5.3.3. Энергия ионной кристаллической решетки.
- •5.4.4. Поляризация ионов.
- •5.5. Металлическая связь. Зонная теория кристаллов
- •5.6. Межмолекулярное взаимодействие
- •5.7. Водородная связь
- •6. Координационные соединения
- •6.1. Координационные соединения. Основные положения координационной теории
- •6.2. Классификация координационных соединений
- •6.3. Номенклатура координационных соединений
- •6.4. Изомерия координационных соединений
- •6.5. Химическая связь в координационных соединениях
- •6.5.1. Метод валентных связей
- •6.2. Теория кристаллического поля
- •6.3. Метод молекулярных орбиталей
- •6.7. Реакции внешнесферного и внутрисферного замещения. Принцип транс-влияния
- •7. Агрегатные состояния вещества
- •7.1. Типы агрегатного состояния
- •7.2. Твердое состояние вещества
- •7.2.1. Кристаллическое состояние.
- •7.2.2. Аморфное состояние.
- •7.3. Жидкое состояние вещества
- •7.4. Газообразное состояние вещества
- •7.5. Плазма
- •8. Теория химических процессов
- •8.1. Предмет и основные понятия теории химических процессов
- •8.2. Основы химической термодинамики
- •8.2.1. Термодинамические функции. Внутренняя энергия и первый закон термодинамики. Энтальпия.
- •8.2.2. Термохимия. Закон Гесса.
- •8.2.3. Энтропия. Второй и третий законы термодинамики.
- •8.2.4. Свободная энергия Гиббса. Направление химического процесса.
- •8. Химическая кинетика
- •8.3.1. Предмет химической кинетики. Скорость химической реакции. Энергия активации.
- •8.3.2. Факторы, влияющие на скорость химической реакции. Катализаторы и катализ.
- •8.3.3. Кинетическая классификация реакций.Молекулярность и порядок реакции. Механизмы реакций.
- •8.3.4. Некоторые типы многостадийных реакций.
- •8.4. Химическое равновесие
- •8.4.1. Обратимые и необратимые реакции. Состояние химического равновесия.
- •8.4.2. Смещение химического равновесия.
- •9. Растворы
- •9.1. Общая характеристика растворов
- •9.2. Разбавленные растворы неэлектролитов. Коллигативные свойства растворов
- •9.3. Растворы электролитов
- •9.3.1. Электролиты. Теория электролитической диссоциации (ионизации).
- •9.3.2. Теория растворов слабых электролитов.
- •9.3.2.1. Степень ионизации слабых электролитов и методы ее определения.
- •9.3.2.2. Равновесия в растворах слабых электролитов.
- •6,5·10-4 Моль/л
- •9.3.3. Теория сильных электролитов.
- •9.3.4. Обменные реакции в растворах электролитов.
- •9.3.4.1. Типы обменных реакций в растворах электролитов.
- •9.3.4.2. Гидролиз солей.
- •9.3.5. Теории кислот и оснований.
- •9.3.6. Окислительно-восстановительные реакции в растворах.
- •9.3.6.1.Общая характеристика окислительно-восстановительных реакций.
- •9.3.6.2. Составление уравнений окислительно-восстановительных реакций.
- •9.3.6.3. Электродные потенциалы. Направление окислительно-восстановительных реакций. Гальванический элемент.
- •9.3.6.4. Электролиз.
- •9.4. Коллоидные растворы
- •9.4.1. Общая характеристика коллоидных растворов и методы их получения.
- •9.4.2. Строение коллоидных частиц.
- •9.5. Твердые растворы
- •Список рекомендуемой литературы
6. Координационные соединения
6.1. Координационные соединения. Основные положения координационной теории
Координационными называются соединения, содержащие в своем составе многоатомные молекулы или ионы, имеющие центр координации, связанный с частицами (молекулами или ионами), способными к самостоятельному существованию. Подобные агрегаты называют комплексными частицами (комплексами). Комплексы способны существовать в кристаллах и в растворах, а иногда и в газообразной фазе.
Несоблюдение хотя бы одного из перечисленных признаков не позволяет отнести то или иное соединение к координационным. Например, сульфат-анион является многоатомной тетраэдрической частицей, имеющей центр координации (атом серы).

Однако рассматривать этот анион как комплексную частицу нельзя, поскольку он состоит из частиц, не способных к самостоятельному существованию (катион серы(VI) и двухзарядный анион кислорода). Нельзя отнести к координационным соединениям и хингидрон, представляющий собой продукт соединения хинона и гидрохинона, молекулы которых многоатомны и устойчивы. Действительно, хингидрон

не имеет центра координации. Для подобных объектов более уместен термин "аддукт" (продукт присоединения). Аддукты и координационные соединения нередко объединяют под названием комплексное соединение.
Примером классического координационного соединения может служить соль Тассера, полученная еще в 1798 г., и отвечающая формуле CoCl36NH3 или

Это соединение содержит в своем составе многоатомный катион, имеющий центр координации (ион Со3+) и состоящий из частиц, способных к самостоятельному существованию.
В основе химии координационных соединений лежит координационная теория А. Вернера, предложенная в 1893 г. Основные принципы современной теории координационных соединений сводятся к следующим положениям:
1. Координационные соединения имеют центрическое строение. Атом или ион, занимающий центральное положение в комплексе, называется центральным атомом (ЦА). Вокруг центрального атома группируются остальные молекулярные или атомные частицы.
2. Ионы или молекулы, непосредственно связанные с ЦА, называются лигандами. Центральный атом и лиганды в своей совокупности образуют внутреннюю (координационную) сферу соединения.
3. Заряд координационной сферы (комплекса) равен алгебраической сумме зарядов частиц, образующих комплекс.
4. Совокупность ионов и молекул, не связанных с ЦА, образует внешнюю сферу. Связь между внутренней и внешней сферами осуществляется за счет сил невалентного взаимодействия (электростатическое притяжение, водородные связи, силы межмолекулярного взаимодействия).
В случае соли Тассера центральным атомом является катион Со3+, а в роли лигандов выступают молекулы аммиака. Образуемая ими внутренняя (координационная) сфера выделена квадратными скобками и представляет катион [Co(NH3)6]3+. Заряд этого комплекса компенсируется зарядами трех ионов хлора, образующих внешнюю сферу. Связь комплекса с внешнесферными ионами имеет ионный характер.
Важнейшей характеристикой центрального атома является координационное число (КЧ). Координационное число центрального атома - это число мест в координационной сфере, образованной этим ЦА. Оно измеряется числом -связей, образуемых ЦА со всеми лигандами. Так, для соли Тассера координационное число иона Со3+ равно шести. Координационное число может принимать различные значения. Наиболее часто оно равно 6, 4 и 2. Реже встречаются координационные числа 3, 5 и превышающие 6.
Число лигандов во внутренней координационной сфере называют лигандным числом. Поскольку лиганд может занимать во внутренней сфере несколько мест, лигандное число не всегда совпадает с координационным.
Число мест, занимаемых лигандом в координационной сфере, называется дентатностью лиганда (от греческого dentatus - имеющий зубы, зубчатый). Дентатность измеряется числом -связей, образуемых лигандом с центральным атомом. В зависимости от дентатности, лиганды можно подразделить на следующие группы:
1.
Монодентатные лиганды, образующие с ЦА
одну -связь.
Примером молекулярных монодентатных
лигандов могут служить NH3,
H2O,
CO, ионных –
![]() .
.
2. Бидентантные лиганды, образующие с ЦА две -связи. Примером бидентатного лиганда может служить этилендиамин H2NCH2CH2NH2 (сокращенное обозначение - en). Это соединение содержит два донорных атома азота и может занимать во внутренней сфере два места. Поэтому в соли Тассера 6 молекул аммиака могут быть замещены тремя молекулами этилендиамина с образованием комплекса [Co(en)3]Cl3:

Бидентатными
лигандами являются также многие
двухзарядные анионы (![]() и др.). Заметим, что бидентатные лиганды
могут выступать и в роли монодентатных
лигандов.
и др.). Заметим, что бидентатные лиганды
могут выступать и в роли монодентатных
лигандов.
3. Полидентатные лиганды, образующие с ЦА три и более -связей. Так, например, триаминоэтиламин может образовывать четыре -связи типа М←N и соответственно проявлять дентатность 4:
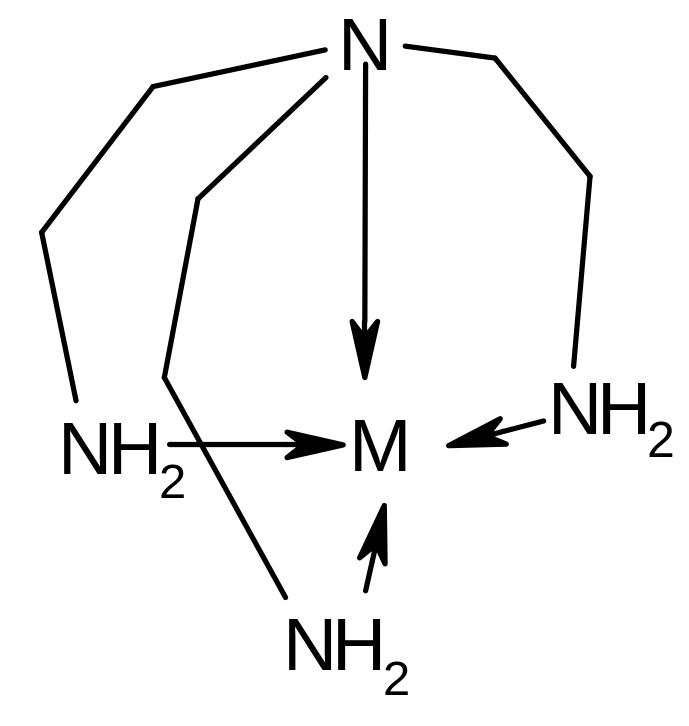
Анион этилендиаминтетрауксусной кислоты (ЭДТА) -

способен образовывать с катионом металла 6 -связей через два атома азота и четыре атома кислорода карбоксильной группы (гексадентатный лиганд).
Важной характеристикой комплексов является также форма координационного полиэдра - геометрической фигуры, получающейся при соединении координационных мест условными прямыми. Наиболее распространенными являются линейные (КЧ = 2), тетраэдрические (КЧ =4), квадратные (КЧ = 4) и октаэдрические (КЧ = 6) комплексы. Например, для соли Тассера координационный полиэдр имеет форму октаэдра.
