
- •Э.А. Гюннер, в.Ф. Шульгин общая химия
- •Введение Предмет и структура химии
- •1. Химическая атомистика
- •1.1. Основные положения и понятия химической атомистики
- •1.2. Стехиометрические законы химии
- •1.3. Методы определения молекулярных масс и атомных масс
- •Методы определения молекулярных масс.
- •1.3.2. Методы определения атомных масс.
- •2. Основы теории строения атома
- •2.1. Предпосылки возникновения квантово-механической теории
- •2.2. Постулаты квантово-механической теории
- •2.3. Волновая функция. Уравнение Шредингера
- •2.4. Атом водорода. Одноэлектронные атомарные ионы
- •2.5. Многоэлектронные атомы
- •3. Периодический закон д.И. Менделеева в свете квантово-механических представлений
- •3.1. Современная формулировка Периодического закона
- •3.2. Структура периодической системы элементов: периоды, группы, подгруппы элементов
- •3.3. Закономерности изменения свойств элементов в периодах и подгруппах периодической системы
- •3.3.1. Эффективный заряд ядра.
- •3.3.2. Атомные радиусы.
- •3.3.3. Энергия ионизации.
- •3.3.4. Сродство к электрону.
- •3.3.5. Электроотрицательность.
- •3.3.6. Степени окисления элементов.
- •3.4. Элементы-аналоги. Виды аналогии в периодической системе элементов
- •3.4.1. Групповая аналогия.
- •3.4.2. Типовая аналогия.
- •3.4.3. Электронная аналогия.
- •VI группа I группа
- •3.4.4. Слоевая аналогия.
- •3.4.5. Контракционная аналогия (шринк-аналогия).
- •3.4.6. Горизонтальная аналогия.
- •3.4.7. Диагональная аналогия.
- •4. Атомное ядро. Радиоактивность
- •4.1. Элементарные частицы
- •4.2. Теория строения атомных ядер
- •4.3. Ядерные реакции
- •4.4.Радиоактивность. Типы радиоактивного распада
- •4.5. Законы радиоактивного распада
- •4.6. Естественная радиоактивность. Радиоактивные ряды. Радиоактивное равновесие
- •4.7. Искусственная радиоактивность. Изотопная индикация
- •4.8. Новые химические элементы
- •4.9. Эволюция элементов во Вселенной
- •5. Химическая связь и строение молекул
- •5.1. Химическая связь. Параметры химической связи. Валентность
- •5.2. Метод валентных связей
- •5.2.1. Основные принципы метода валентных связей.
- •5.2.2. Насыщаемость ковалентной связи. Механизм образования двухцентровой связи.
- •5.2.3. Направленность ковалентной связи. Гибридизация электронных орбиталей.
- •5.2.4. Кратность ковалентной связи.
- •5.2.5. Делокализованные многоцентровые связи. Теория резонанса.
- •5.2.6. Предсказание геометрической формы молекул.
- •5.2.7. Неполярные и полярные связи. Типы ковалентных молекул.
- •5.2.8. Недостатки метода валентных связей.
- •5.3. Метод молекулярных орбиталей
- •5.3.1. Основные принципы метода молекулярных орбиталей.
- •5.3.2. Применение метода молекулярных орбиталей.
- •5.3.2.1. Двухатомные молекулы.
- •5.3.2.2. Молекулы, состоящие из трех и более атомов.
- •5.4. Ионная связь
- •5.4.1. Особенности ионной связи. Свойства ионных соединений.
- •5.4.2. Типы кристаллических решеток ионных соединений. Ионные радиусы.
- •5.3.3. Энергия ионной кристаллической решетки.
- •5.4.4. Поляризация ионов.
- •5.5. Металлическая связь. Зонная теория кристаллов
- •5.6. Межмолекулярное взаимодействие
- •5.7. Водородная связь
- •6. Координационные соединения
- •6.1. Координационные соединения. Основные положения координационной теории
- •6.2. Классификация координационных соединений
- •6.3. Номенклатура координационных соединений
- •6.4. Изомерия координационных соединений
- •6.5. Химическая связь в координационных соединениях
- •6.5.1. Метод валентных связей
- •6.2. Теория кристаллического поля
- •6.3. Метод молекулярных орбиталей
- •6.7. Реакции внешнесферного и внутрисферного замещения. Принцип транс-влияния
- •7. Агрегатные состояния вещества
- •7.1. Типы агрегатного состояния
- •7.2. Твердое состояние вещества
- •7.2.1. Кристаллическое состояние.
- •7.2.2. Аморфное состояние.
- •7.3. Жидкое состояние вещества
- •7.4. Газообразное состояние вещества
- •7.5. Плазма
- •8. Теория химических процессов
- •8.1. Предмет и основные понятия теории химических процессов
- •8.2. Основы химической термодинамики
- •8.2.1. Термодинамические функции. Внутренняя энергия и первый закон термодинамики. Энтальпия.
- •8.2.2. Термохимия. Закон Гесса.
- •8.2.3. Энтропия. Второй и третий законы термодинамики.
- •8.2.4. Свободная энергия Гиббса. Направление химического процесса.
- •8. Химическая кинетика
- •8.3.1. Предмет химической кинетики. Скорость химической реакции. Энергия активации.
- •8.3.2. Факторы, влияющие на скорость химической реакции. Катализаторы и катализ.
- •8.3.3. Кинетическая классификация реакций.Молекулярность и порядок реакции. Механизмы реакций.
- •8.3.4. Некоторые типы многостадийных реакций.
- •8.4. Химическое равновесие
- •8.4.1. Обратимые и необратимые реакции. Состояние химического равновесия.
- •8.4.2. Смещение химического равновесия.
- •9. Растворы
- •9.1. Общая характеристика растворов
- •9.2. Разбавленные растворы неэлектролитов. Коллигативные свойства растворов
- •9.3. Растворы электролитов
- •9.3.1. Электролиты. Теория электролитической диссоциации (ионизации).
- •9.3.2. Теория растворов слабых электролитов.
- •9.3.2.1. Степень ионизации слабых электролитов и методы ее определения.
- •9.3.2.2. Равновесия в растворах слабых электролитов.
- •6,5·10-4 Моль/л
- •9.3.3. Теория сильных электролитов.
- •9.3.4. Обменные реакции в растворах электролитов.
- •9.3.4.1. Типы обменных реакций в растворах электролитов.
- •9.3.4.2. Гидролиз солей.
- •9.3.5. Теории кислот и оснований.
- •9.3.6. Окислительно-восстановительные реакции в растворах.
- •9.3.6.1.Общая характеристика окислительно-восстановительных реакций.
- •9.3.6.2. Составление уравнений окислительно-восстановительных реакций.
- •9.3.6.3. Электродные потенциалы. Направление окислительно-восстановительных реакций. Гальванический элемент.
- •9.3.6.4. Электролиз.
- •9.4. Коллоидные растворы
- •9.4.1. Общая характеристика коллоидных растворов и методы их получения.
- •9.4.2. Строение коллоидных частиц.
- •9.5. Твердые растворы
- •Список рекомендуемой литературы
6.5. Химическая связь в координационных соединениях
6.5.1. Метод валентных связей
Для описания химической связи в координационных соединениях используют различные теоретические подходы. В основе наиболее результативных из них лежат метод валентных связей, теория кристаллического поля и метод молекулярных орбиталей.
Применительно к координационным соединениям метод валентных связей утверждает, что в подобных соединениях обязательно реализуются связи, образованные по донорно-акцепторному механизму. В химии комплексных соединений такая связь называется координационной. Обычно в функции донора электронной пары при образовании координационной связи выступает лиганд, а в функции акцептора - центральный атом. В этом случае формирование связи происходит по схеме М:L, а результатом чаще всего является -связь. Упрочнению связи способствует соответствующая гибридизация электронных орбиталей. Например, при образовании тетрафторобериллат-иона по уравнению
Be2+ + 4F- = [BeF4]2- (6-1)
в роли акцептора выступает ион бериллия с электронной конфигурацией 1s22s02p0 (четыре вакантных орбитали валентного уровня). Эти орбитали подвергаются sp3-гибридизации. В качестве доноров в реакции (6-1) выступают ионы фтора, имеющие четыре неподеленные пары. В результате образуется тетраэдрический ион [BeF4]2-:
sp3 - гибридизация

Координационная связь может формироваться также за счет неподеленной электронной пары центрального атома и вакантных орбиталей (обычно разрыхляющих) лиганда по схеме М:L. Такая разновидность координационной связи называется дативной связью. Образование дативных связей упрочняет молекулу, так как способствует перетеканию электронной плотности с центрального атома на лиганд и повышению эффективного заряда центрального атома.
В зависимости от того, какие орбитали ЦА участвуют в гибридизации, последняя может быть внутренней, внешней и смешанной (рис. 34, см также раздел 5.2.3.).

Рис. 34. Внутренняя, внешняя и смешанная гибридизация
Из рассмотренных типов гибридизации s-, трех p- и двух d-орбиталей энергетически наиболее выгодной является внутренняя гибридизация, так как в этом случае в гибридизацию вовлекаются (n-1)d-орбитали, энергия которых ниже энергии ns-, np- и nd-орбиталей. Поэтому у центральных атомов, содержащих в данной степени окисления не более трех электронов и, следовательно, не менее двух вакантных орбиталей на (n-1)d-орбиталях всегда наблюдается внутренняя гибридизация. Так, например, для центрального атома Cr3+, имеющего конфигурацию d3, всегда имеет место d2sp3-гибридизация. Смешанная гибридизация реализуется тогда, когда благодаря ей (n-1)d-орбиталь занимает электронная пара, а nd-орбиталь - неспаренный электрон. Так, для комплекса [Cu(H2O)6]2+ конфигурация

энергетически выгоднее конфигурации
Тип гибридизации центрального атома связан с координационным числом и определяет геометрическую форму комплекса. Наиболее часто встречающиеся формы координационного многогранника и соответствующие им типы гибридизации приведены в табл. 21.
Таблица 21
Формы координационного полиэдра и соответствующие им типы гибридизации
электронных орбиталей
Форма координационного полиэдра
|
Тип гибридизации
|
КЧ |
Примеры |
Линейная |
sp |
2 |
[Ag(NH3)2]+, [CuCl2]- |
Тетраэдрическая |
sp3 |
4 |
[Zn(NH3)4]2+ |
d3s |
4 |
[MnCl4]2- |
|
Квадратная |
dsp2 |
4 |
[AuCl4]- |
Октаэдрическая |
d2sp3 |
6 |
[Fe(CN)6]3- |
sp3d2 |
6 |
[Ni(NH3)6]2+ |
|
dsp3d |
6 |
[Cu(H2O)6]2+ |
Метод валентных связей позволяет объяснить, почему данный комплекс имеет ту или иную форму, но не позволяет предсказывать геометрию координационного полиэдра. Однако в ряде случаев эта задача может быть решена, если воспользоваться методом ОЭПВО Гиллеспи (раздел 5.2.6.).
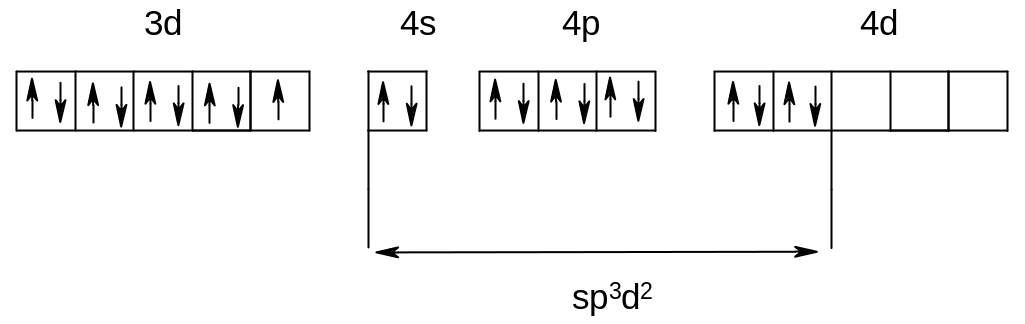
Используя метод валентных связей, можно также объяснить, почему данный комплекс является парамагнитной или диамагнитной частицей. Так, например, комплекс [CoF6]3- является парамагнитным, а комплекс [Co(CN)6]3- - диамагнитным. Этот факт связан с тем, что во фторидном комплексе наблюдается внешняя гибридизация (sp3d2) и комплекс имеет 4 неспаренных электрона (высокоспиновый комплекс).
[CoF6]3-

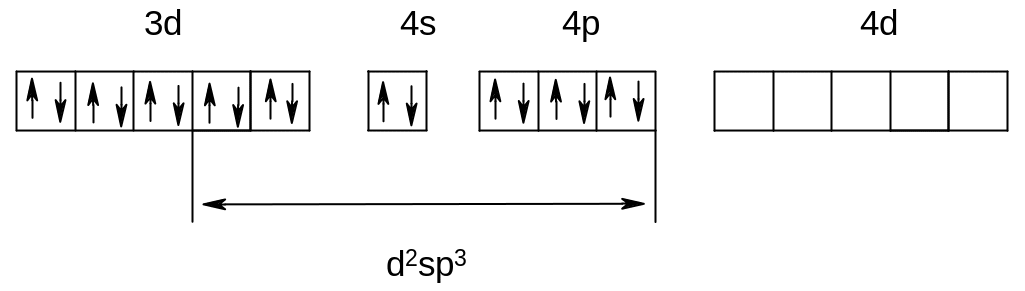
В цианидном комплексе имеет место внутренняя гибридизация (d2sp3), сопровождающаяся спариванием электронов атома кобальта на 3d-орбиталях, в результате чего комплекс не содержит неспаренных электронов (низкоспиновый комплекс).
[Co(CN)6]3-
Однако следует отметить, что предсказать, будет ли данный комплекс парамагнитным или диамагнитным, метод валентных связей не может.
