
- •Э.А. Гюннер, в.Ф. Шульгин общая химия
- •Введение Предмет и структура химии
- •1. Химическая атомистика
- •1.1. Основные положения и понятия химической атомистики
- •1.2. Стехиометрические законы химии
- •1.3. Методы определения молекулярных масс и атомных масс
- •Методы определения молекулярных масс.
- •1.3.2. Методы определения атомных масс.
- •2. Основы теории строения атома
- •2.1. Предпосылки возникновения квантово-механической теории
- •2.2. Постулаты квантово-механической теории
- •2.3. Волновая функция. Уравнение Шредингера
- •2.4. Атом водорода. Одноэлектронные атомарные ионы
- •2.5. Многоэлектронные атомы
- •3. Периодический закон д.И. Менделеева в свете квантово-механических представлений
- •3.1. Современная формулировка Периодического закона
- •3.2. Структура периодической системы элементов: периоды, группы, подгруппы элементов
- •3.3. Закономерности изменения свойств элементов в периодах и подгруппах периодической системы
- •3.3.1. Эффективный заряд ядра.
- •3.3.2. Атомные радиусы.
- •3.3.3. Энергия ионизации.
- •3.3.4. Сродство к электрону.
- •3.3.5. Электроотрицательность.
- •3.3.6. Степени окисления элементов.
- •3.4. Элементы-аналоги. Виды аналогии в периодической системе элементов
- •3.4.1. Групповая аналогия.
- •3.4.2. Типовая аналогия.
- •3.4.3. Электронная аналогия.
- •VI группа I группа
- •3.4.4. Слоевая аналогия.
- •3.4.5. Контракционная аналогия (шринк-аналогия).
- •3.4.6. Горизонтальная аналогия.
- •3.4.7. Диагональная аналогия.
- •4. Атомное ядро. Радиоактивность
- •4.1. Элементарные частицы
- •4.2. Теория строения атомных ядер
- •4.3. Ядерные реакции
- •4.4.Радиоактивность. Типы радиоактивного распада
- •4.5. Законы радиоактивного распада
- •4.6. Естественная радиоактивность. Радиоактивные ряды. Радиоактивное равновесие
- •4.7. Искусственная радиоактивность. Изотопная индикация
- •4.8. Новые химические элементы
- •4.9. Эволюция элементов во Вселенной
- •5. Химическая связь и строение молекул
- •5.1. Химическая связь. Параметры химической связи. Валентность
- •5.2. Метод валентных связей
- •5.2.1. Основные принципы метода валентных связей.
- •5.2.2. Насыщаемость ковалентной связи. Механизм образования двухцентровой связи.
- •5.2.3. Направленность ковалентной связи. Гибридизация электронных орбиталей.
- •5.2.4. Кратность ковалентной связи.
- •5.2.5. Делокализованные многоцентровые связи. Теория резонанса.
- •5.2.6. Предсказание геометрической формы молекул.
- •5.2.7. Неполярные и полярные связи. Типы ковалентных молекул.
- •5.2.8. Недостатки метода валентных связей.
- •5.3. Метод молекулярных орбиталей
- •5.3.1. Основные принципы метода молекулярных орбиталей.
- •5.3.2. Применение метода молекулярных орбиталей.
- •5.3.2.1. Двухатомные молекулы.
- •5.3.2.2. Молекулы, состоящие из трех и более атомов.
- •5.4. Ионная связь
- •5.4.1. Особенности ионной связи. Свойства ионных соединений.
- •5.4.2. Типы кристаллических решеток ионных соединений. Ионные радиусы.
- •5.3.3. Энергия ионной кристаллической решетки.
- •5.4.4. Поляризация ионов.
- •5.5. Металлическая связь. Зонная теория кристаллов
- •5.6. Межмолекулярное взаимодействие
- •5.7. Водородная связь
- •6. Координационные соединения
- •6.1. Координационные соединения. Основные положения координационной теории
- •6.2. Классификация координационных соединений
- •6.3. Номенклатура координационных соединений
- •6.4. Изомерия координационных соединений
- •6.5. Химическая связь в координационных соединениях
- •6.5.1. Метод валентных связей
- •6.2. Теория кристаллического поля
- •6.3. Метод молекулярных орбиталей
- •6.7. Реакции внешнесферного и внутрисферного замещения. Принцип транс-влияния
- •7. Агрегатные состояния вещества
- •7.1. Типы агрегатного состояния
- •7.2. Твердое состояние вещества
- •7.2.1. Кристаллическое состояние.
- •7.2.2. Аморфное состояние.
- •7.3. Жидкое состояние вещества
- •7.4. Газообразное состояние вещества
- •7.5. Плазма
- •8. Теория химических процессов
- •8.1. Предмет и основные понятия теории химических процессов
- •8.2. Основы химической термодинамики
- •8.2.1. Термодинамические функции. Внутренняя энергия и первый закон термодинамики. Энтальпия.
- •8.2.2. Термохимия. Закон Гесса.
- •8.2.3. Энтропия. Второй и третий законы термодинамики.
- •8.2.4. Свободная энергия Гиббса. Направление химического процесса.
- •8. Химическая кинетика
- •8.3.1. Предмет химической кинетики. Скорость химической реакции. Энергия активации.
- •8.3.2. Факторы, влияющие на скорость химической реакции. Катализаторы и катализ.
- •8.3.3. Кинетическая классификация реакций.Молекулярность и порядок реакции. Механизмы реакций.
- •8.3.4. Некоторые типы многостадийных реакций.
- •8.4. Химическое равновесие
- •8.4.1. Обратимые и необратимые реакции. Состояние химического равновесия.
- •8.4.2. Смещение химического равновесия.
- •9. Растворы
- •9.1. Общая характеристика растворов
- •9.2. Разбавленные растворы неэлектролитов. Коллигативные свойства растворов
- •9.3. Растворы электролитов
- •9.3.1. Электролиты. Теория электролитической диссоциации (ионизации).
- •9.3.2. Теория растворов слабых электролитов.
- •9.3.2.1. Степень ионизации слабых электролитов и методы ее определения.
- •9.3.2.2. Равновесия в растворах слабых электролитов.
- •6,5·10-4 Моль/л
- •9.3.3. Теория сильных электролитов.
- •9.3.4. Обменные реакции в растворах электролитов.
- •9.3.4.1. Типы обменных реакций в растворах электролитов.
- •9.3.4.2. Гидролиз солей.
- •9.3.5. Теории кислот и оснований.
- •9.3.6. Окислительно-восстановительные реакции в растворах.
- •9.3.6.1.Общая характеристика окислительно-восстановительных реакций.
- •9.3.6.2. Составление уравнений окислительно-восстановительных реакций.
- •9.3.6.3. Электродные потенциалы. Направление окислительно-восстановительных реакций. Гальванический элемент.
- •9.3.6.4. Электролиз.
- •9.4. Коллоидные растворы
- •9.4.1. Общая характеристика коллоидных растворов и методы их получения.
- •9.4.2. Строение коллоидных частиц.
- •9.5. Твердые растворы
- •Список рекомендуемой литературы
5.3.2. Применение метода молекулярных орбиталей.
5.3.2.1. Двухатомные молекулы.
Метод молекулярных орбиталей может быть использован для объяснения и предсказания возможности существования и свойств самых различных молекулярных частиц. Простейшим объектом описания по методу МО являются двухатомные молекулы и молекулярные ионы. Эти частицы могут быть подразделены на двухатомные гомоядерные молекулы, состоящие из двух атомов одного химического элемента, и двухатомные гетероядерные молекулы, образованные атомами двух разных элементов. Остановимся последовательно на характеристике каждой из этих групп молекул.
Двухатомные гомоядерные молекулярные частицы элементов I периода.
Первый период периодической системы содержит всего два элемента (водород и гелий), для которых валентной является 1s-орбиталь, что позволяет использовать для гомоядерных двухатомных частиц элементов первого периода набор МО, приведенный на рис. 20 (sсв и sр -орбитали). Рассмотрим, возможно ли существование двухатомных молекул Н2 и Не2. Как следует из табл. 14, два валентных электрона в молекуле водорода заполняют sсв - орбиталь, тогда как sр - орбиталь остается вакантной. Отсюда кратность связи в молекуле водорода равна 1:
![]() ,
,
что обеспечивает ее стабильность.
Метод МО объясняет также диамагнетизм молекулы водорода: эта молекула не содержит неспаренных электронов (табл. 14).
Молекула
может как терять, так и присоединять
электроны, превращаясь в молекулярные
ионы. В табл. 11 сопоставлены электронные
конфигурации ионов
![]() ,
,
![]() и
и
![]() .
Как следует из табл. 11,
и
,
имеющие кратность связи, равную 0,5,
способны к существованию, что подтверждается
экспериментом, в то время как ион
абсолютно неустойчив. В то же время
энергии связи в ионах
и
будут меньше энергии связи в молекуле
Н2,
а длины связей - больше. Действительно,
для молекулы Н2
эти характеристики равны 435 кДж/моль и
74 пм, а для иона
- 256 кДж/моль и 106 пм.
.
Как следует из табл. 11,
и
,
имеющие кратность связи, равную 0,5,
способны к существованию, что подтверждается
экспериментом, в то время как ион
абсолютно неустойчив. В то же время
энергии связи в ионах
и
будут меньше энергии связи в молекуле
Н2,
а длины связей - больше. Действительно,
для молекулы Н2
эти характеристики равны 435 кДж/моль и
74 пм, а для иона
- 256 кДж/моль и 106 пм.
То, что связь в ионе осуществляется лишь одним электроном, объясняется в рамках метода МО без каких-либо дополнительных допущений, тогда как метод ВС одноэлектронную связь не объясняет. Метод МО объясняет также невозможность существования молекул водорода с параллельными спинами электронов: в этом случае один из электронов оказался бы на sсв -, а другой на sр -орбитали, чему бы соответствовала кратность связи, равная нулю.
Для молекулы Не2 (табл. 14) число валентных электронов равно четырем, а кратность связи - нулю. Молекула Не2, таким образом, существовать не может. В то же время для молекулярного иона Не2+
КС
=
![]()
в силу чего существования катиона дигелия возможно. Действительно, образование ионов Не2+ (Есв = 241 кДж/моль, dНе-Не = 108 пм) подтверждено экспериментально при пропускании тихого электрического разряда через газообразный гелий.
Из рассмотренных частиц электронной формуле (sсв)1 отвечает ион Н2+, формуле (sсв)2 - молекула Н2, формуле (sсв)2(sр)1 - ионы Н2-1 и Не2+, (sсв)2(sр)2 - Не2 и Н2-2.
Таблица. 14.
Двухатомные гомоядерные молекулы и молекулярные ионы элементов первого периода
Распределение электронов |
Молекулярная частица
|
|||||
Н2 |
Н2+ |
Н2- |
Н22- |
Не2 |
Не2+ |
|
sр |
|
|
|
|
|
|
sсв |
|
|
|
|
|
|
Кратность связи |
1 |
0,5 |
0,5 |
0 |
0 |
0,5 |
Энергия связи, кДж/моль |
435 |
256 |
15 |
0 |
0 |
241 |
Длина связи, Пм |
74 |
106 |
нет данных |
- |
- |
108 |
Магнитные свойства* |
Д |
П |
П |
- |
- |
П |
*) Д - диамагнитные молекулы, П - парамагнитные молекулы
Двухатомные гомоядерные молекулы элементов II периода.
Для элементов второго периода валентными являются как 2s-, так и 2р-орбитали, в результате чего атомный базис будет включать 8 АО (по четыре от каждого атома):

Пунктиром соединены АО, способные перекрываться, если линей связи является ось z. В результате набор МО для рассматриваемой группы молекул будет включать восемь орбиталей. Некоторые осложнения вносит тот факт, что в этом случае 2s-орбитали перекрываются не только взаимно, но и с 2рz-орбиталями. Вопрос о том, будут ли вносить вклад 2рz-орбитали в формирование s - орбиталей, а 2s- орбитали в построение z- орбиталей, зависит от их энергетической близости. Если разность энергий 2s- и 2p-подуровней велика, 2pz-орбитали не будут участвовать в построении s- орбиталей. Если же эти подуровни близки по энергиям, то комбинирование 2s и 2pz-орбиталей в МО становится возможным.
Рассмотрим более простой случай, когда разность энергий 2s- и 2р-орбиталей высока и соответствующие волновые функции не смешиваются. В этом случае комбинирование 2sa и 2sb -орбиталей происходит так же, как и в случае 1s-орбиталей; в результате образуются молекулярные орбитали sсв и sр. Комбинирование 2pza и 2pzb АО иллюстрирует рис. 21; связывающая и разрыхляющая МО, полученные при этом, являются сигма-орбиталями (zсв и zр), так как при повороте вокруг оси z на 180 волновая функция не меняет знак.

Рис. 21. Построение zсв- и zp-орбиталей
Орбитали 2pxa и 2pxb перекрываются выше и ниже линии связи; комбинирование их приводит к образованию связывающей и разрыхляющей МО, граничные поверхности которых показаны на рис. 22. Поворот этих орбиталей вокруг оси z на 180 сопровождается переменой знака волновой функции; подобные орбитали называются -орбиталями. При этом орбиталь, представляющая сумму АО, будут связывающей (xсв-орбиталь), а разность - разрыхляющей (xр-орбиталь). Аналогичные орбитали дает комбинирование 2pya и 2pyb-орбиталей; орбитали yсв и yр имеют такую же энергию, что и орбитали xсв и xр, поскольку энергии АО 2px и 2py одинаковы.
Энергии построенных МО тем ниже, чем ниже энергии комбинируемых атомных орбиталей и чем сильнее последние перекрываются; в результате полученные МО в порядке возрастания их энергии располагаются в следующий ряд:
sсв < sp < zсв < xсв = yсв < xp = yp < zр (5-16)
Энергетическая диаграмма молекулярных орбиталей двухатомных гомоядерных молекул элементов второго периода со значительным энергетическим отличием 2s- и 2p-подуровней приведена на рис. 23,а.
Если энергии 2s- и 2p-орбиталей близки, становится возможной частичная гибридизация этих орбиталей, в результате чего 2pz-орбитали вносят некоторый вклад в s-орбитали, а 2s-орбитали - в z молекулярные орбитали. При этом энергия s-орбиталей понижается, в а z повышается, в результате чего энергия zсв-орбитали становится выше энергии орбиталей x,yсв, что приводит к ряду
sсв < sp < xсв = yсв < zсв < xp = yp < zр (5-17)
и энергетической диаграмме, изображенной на рис. 23,б.

Рис. 22. Построение xсв и xр-орбиталей

Рис. 23. Энергетические диаграммы молекулярных орбиталей двухатомных гомоядерных молекул
второго периода:
а) - различие Е2p и E2s велико;
б) - различие Е2p и E2s мало.
Во втором периоде при перемещении слева направо разности энергий подуровней 2р и 2s возрастают от 190 кДж/моль у лития до 2600 кДж/моль у неона. В связи с этим последовательность (5-17) соблюдается для элементов левой части периода (от лития до азота), а последовательность (5-16) для элементов правой части периода (от кислорода до неона).
Распределение электронов в молекулах типа А2 для элементов второго периода показано в табл. 15 и 16. Как следует из приведенных в этих таблицах данных, только бериллий и неон не могут образовывать двухатомные молекулы (кратность связи равна нулю). С увеличением кратности связи весьма четко прослеживается увеличение энергии связи и уменьшение межъядерных расстояний в молекулах. Так, максимальная энергия связи (940 кДж/моль) и минимальная длина связи (110 пм) отвечают молекуле N2, для которой кратность связи равна 3. У всех остальных молекул А2 кратность связи меньше трех.
Метод МО весьма убедительно объясняет парамагнетизм молекул кислорода: в молекуле О2 два электрона, занимающие вырожденные xр- и zp-орбитали, остаются неспаренными. Парамагнитной должна быть и молекула В2, что подтверждается экспериментальными данными.
Каждой из молекул А2 отвечает определенная электронная формула. Например, молекуле N2 отвечает конфигурация (sсв)2 (sp)2(x,yсв)4(zсв)2, молекуле О2 - конфигурация (sсв)2(sp)2(x,yсв)4(xp)1(yp)1.
Таблица 15.
Двухатомные гомоядерные молекулы элементов второго периода
(литий - азот)
Распределение электронов |
Молекула
|
||||
Li2 |
Be2 |
B2 |
C2 |
N2 |
|
zp
|
|
|
|
|
|
xp, yp
|
|
|
|
|
|
zсв
|
|
|
|
|
|
xсв, yсв |
|
|
|
|
|
sp |
|
|
|
|
|
sсв |
|
|
|
|
|
Кратность связи |
1 |
0 |
1 |
2 |
3 |
Энергия связи, кДж/моль |
105 |
- |
288 |
627 |
942 |
Длина связи, пм |
267 |
- |
159 |
131 |
110 |
Магнитные свойства |
Д |
- |
П |
Д |
Д |
Аналогично могут быть рассмотрены в рамках метода МО молекулярные ионы типа А2z. В этом случае метод МО позволяет судить о закономерностях изменения энергии связи, длины связи и магнитных свойств в совокупностях подобных молекулярных частиц. Пусть, например, требуется установить, однотипно ли меняются энергии и длины связей в молекулярных частицах А2+, А2 и А2- для углерода и кислорода. Распределение электронов по молекулярным орбиталям приводит к выводу, что в ряду С2+, С2 и С2- кратность связи растет, принимая значения 1.5, 2.0 и 2.5; можно предположить, что в этом ряду энергия связи будет возрастать, а длина связи уменьшаться.
Таблица 16.
Двухатомные гомоядерные молекулы элементов второго периода
(кислород - неон)
Молекула
|
O2 |
F2 |
Ne2 |
Распределение электронов |
|
|
|
zp
|
|
|
|
xp, yp
|
|
|
|
xсв, yсв
|
|
|
|
zсв
|
|
|
|
sp |
|
|
|
sсв |
|
|
|
Кратность связи |
2 |
1 |
0 |
Энергия связи, кДж/моль |
494 |
155 |
- |
Длина связи, м |
121 |
142 |
- |
Магнитные свойства |
П |
Д |
- |
В ряду О2+, О2, О2- кратность связи убывает (2.5, 2.0 и 1.5). Для частиц этого ряда следует ожидать последовательного уменьшения энергии связи и увеличения межъядерных расстояний. Экспериментально определенные значения Есв и dА-А, приведенные в табл. 17, подтверждают, что длины связей и энергии связей в рассматриваемых рядах изменяются именно так. Заметим, что метод валентных связей не позволяет решать подобные задачи.
Таблица 17.
Энергия и длина связи в молекулярных частицах А2+, А2 и А2- для углерода и
кислорода
А2z
|
КС |
Есв, кДж/моль |
dА-А, пм |
С2+ |
1.5 |
528 |
146 |
С2 |
2.0 |
627 |
131 |
С2- |
2.5 |
783 |
127 |
О2+ |
2.5 |
643 |
112 |
О2 |
2.0 |
494 |
121 |
О2- |
1.5 |
394 |
134 |
Двухатомные гетероядерные молекулы
Двухатомные гетероядерные молекулы типа АВ можно подразделить на две группы, отнеся к первой из них частицы, построенные из атомов элементов одного периода, а ко второй - из атомов элементов разных периодов.
Если элементы А и В принадлежат одному периоду, то для описания частиц АВ можно использовать набор молекулярных орбиталей, построенных для гомоядерных частиц А2. Однако в этом случае вклады атомов А и В в связывающие и разрыхляющие орбитали не будут одинаковы: атом, имеющий большую электроотрицательность, вносит больший вклад в связывающие МО, атомом с меньшей электроотрицательностью - в разрыхляющие МО. В результате коэффициенты с1, с2, с3 и с4 в уравнениях (5-13) и (5-14) не могут быть равны. Если А < В, то с2 будет больше с1, а с3 будет больше с4. Соответственно граничные поверхности молекулярных орбиталей перестанут быть симметричными: электронная плотность, отвечающая "связывающим" электронам будет смещена к атому с большей электроотрицательностью, тогда как вероятность нахождения "разрыхляющих" электронов будет выше вблизи атома с меньшей электроотрицательностью. В качестве примера на рис. 24 приведены граничные поверхности z-орбиталей для подобных молекул (сравни с рис. 21).
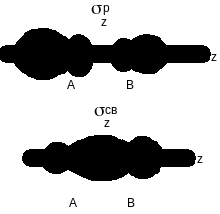
Рис. 24. zсв- и zр-орбитали молекулы АВ (А<В)
Применение метода МО к молекулам типа АВ позволяет объяснить некоторые свойства последних, не находящие объяснения в рамках метода ВС. Так, например, в молекуле оксида углерода(II), согласно методу ВС, имеет место образования тройной связи, причем одна из -связей образуется по донорно-акцепторному механизму за счет неподеленной электронной пары кислорода (раздел 5.2.4). Можно ожидать, что молекула СО будет полярной с отрицательным зарядом на углероде. В действительности же полярность данной молекулы очень мала и составляет 0,410-30 Клм. Метод МО объясняет данное явление достаточно убедительно. Молекула СО изоэлектронна молекуле N2 и отвечает электронной формуле (sсв)2 (sp)2(x,yсв)4(zсв)2, соответственно которой 8 из 10 валентных электронов находятся на связывающих орбиталях. Поскольку электроотрицательность кислорода больше электроотрицательности углерода, электроны связывающих орбиталей преимущественно находятся возле атома кислорода, в результате чего перетекание электронной плотности от кислороду к углероду не наблюдается.
Если атомы А и В принадлежат к разным периодам, то построение МО для молекул АВ усложняется; такая задача может быть решена строго лишь при использовании довольно сложного математического аппарата. Однако в ряде случаев можно удовлетвориться качественной стороной вопроса.
Рассмотрим в качестве примера строение молекулы газообразного гидрида лития LiH. Атомный базис для такой молекулы будет включать 5 атомных орбиталей (1s от водорода, 2s, 2pz, 2px и 2py от лития). Набор молекулярных орбиталей для молекулы LiH должен таким образом состоять из пяти МО. Если ядра атомов расположить на оси z, то 1s-орбиталь атома водорода перекрывается с 2s- и 2pz-орбиталями атома лития. Перекрывание 2px- и 2py- орбиталей с 1s-орбиталью атома водорода является нулевым (см. рис. 6,в), в результате чего орбитали 2px и 2py перейдут в молекулу гидрида лития как несвязывающие xнс и yнс молекулярные орбитали. Комбинирование перекрывающихся орбиталей с учетом энергетической близости 2s- и 2p-подуровней для лития приводит к следующим МО:
sсв = 2s + 2pz + 1s
sр = 2s - 1s
zр = 2pz - 1s
Читателю предлагается самостоятельно определить форму соответствующих МО. Энергетическая диаграмма для МО молекулы гидрида лития приведена на рис. 25. Число валентных электронов в рассматриваемой молекуле равно двум, что приводит к электронной формуле (св)2 для гидрида лития. Поскольку электроотрицательность водорода выше электроотрицательности лития, можно ожидать, что молекула LiH будет полярной. Экспериментальные данные подтверждают это предположение.

Рис. 25. Энергетическая диаграмма молекулярных орбиталей молекулы гидрида лития - LiH
