
- •Э.А. Гюннер, в.Ф. Шульгин общая химия
- •Введение Предмет и структура химии
- •1. Химическая атомистика
- •1.1. Основные положения и понятия химической атомистики
- •1.2. Стехиометрические законы химии
- •1.3. Методы определения молекулярных масс и атомных масс
- •Методы определения молекулярных масс.
- •1.3.2. Методы определения атомных масс.
- •2. Основы теории строения атома
- •2.1. Предпосылки возникновения квантово-механической теории
- •2.2. Постулаты квантово-механической теории
- •2.3. Волновая функция. Уравнение Шредингера
- •2.4. Атом водорода. Одноэлектронные атомарные ионы
- •2.5. Многоэлектронные атомы
- •3. Периодический закон д.И. Менделеева в свете квантово-механических представлений
- •3.1. Современная формулировка Периодического закона
- •3.2. Структура периодической системы элементов: периоды, группы, подгруппы элементов
- •3.3. Закономерности изменения свойств элементов в периодах и подгруппах периодической системы
- •3.3.1. Эффективный заряд ядра.
- •3.3.2. Атомные радиусы.
- •3.3.3. Энергия ионизации.
- •3.3.4. Сродство к электрону.
- •3.3.5. Электроотрицательность.
- •3.3.6. Степени окисления элементов.
- •3.4. Элементы-аналоги. Виды аналогии в периодической системе элементов
- •3.4.1. Групповая аналогия.
- •3.4.2. Типовая аналогия.
- •3.4.3. Электронная аналогия.
- •VI группа I группа
- •3.4.4. Слоевая аналогия.
- •3.4.5. Контракционная аналогия (шринк-аналогия).
- •3.4.6. Горизонтальная аналогия.
- •3.4.7. Диагональная аналогия.
- •4. Атомное ядро. Радиоактивность
- •4.1. Элементарные частицы
- •4.2. Теория строения атомных ядер
- •4.3. Ядерные реакции
- •4.4.Радиоактивность. Типы радиоактивного распада
- •4.5. Законы радиоактивного распада
- •4.6. Естественная радиоактивность. Радиоактивные ряды. Радиоактивное равновесие
- •4.7. Искусственная радиоактивность. Изотопная индикация
- •4.8. Новые химические элементы
- •4.9. Эволюция элементов во Вселенной
- •5. Химическая связь и строение молекул
- •5.1. Химическая связь. Параметры химической связи. Валентность
- •5.2. Метод валентных связей
- •5.2.1. Основные принципы метода валентных связей.
- •5.2.2. Насыщаемость ковалентной связи. Механизм образования двухцентровой связи.
- •5.2.3. Направленность ковалентной связи. Гибридизация электронных орбиталей.
- •5.2.4. Кратность ковалентной связи.
- •5.2.5. Делокализованные многоцентровые связи. Теория резонанса.
- •5.2.6. Предсказание геометрической формы молекул.
- •5.2.7. Неполярные и полярные связи. Типы ковалентных молекул.
- •5.2.8. Недостатки метода валентных связей.
- •5.3. Метод молекулярных орбиталей
- •5.3.1. Основные принципы метода молекулярных орбиталей.
- •5.3.2. Применение метода молекулярных орбиталей.
- •5.3.2.1. Двухатомные молекулы.
- •5.3.2.2. Молекулы, состоящие из трех и более атомов.
- •5.4. Ионная связь
- •5.4.1. Особенности ионной связи. Свойства ионных соединений.
- •5.4.2. Типы кристаллических решеток ионных соединений. Ионные радиусы.
- •5.3.3. Энергия ионной кристаллической решетки.
- •5.4.4. Поляризация ионов.
- •5.5. Металлическая связь. Зонная теория кристаллов
- •5.6. Межмолекулярное взаимодействие
- •5.7. Водородная связь
- •6. Координационные соединения
- •6.1. Координационные соединения. Основные положения координационной теории
- •6.2. Классификация координационных соединений
- •6.3. Номенклатура координационных соединений
- •6.4. Изомерия координационных соединений
- •6.5. Химическая связь в координационных соединениях
- •6.5.1. Метод валентных связей
- •6.2. Теория кристаллического поля
- •6.3. Метод молекулярных орбиталей
- •6.7. Реакции внешнесферного и внутрисферного замещения. Принцип транс-влияния
- •7. Агрегатные состояния вещества
- •7.1. Типы агрегатного состояния
- •7.2. Твердое состояние вещества
- •7.2.1. Кристаллическое состояние.
- •7.2.2. Аморфное состояние.
- •7.3. Жидкое состояние вещества
- •7.4. Газообразное состояние вещества
- •7.5. Плазма
- •8. Теория химических процессов
- •8.1. Предмет и основные понятия теории химических процессов
- •8.2. Основы химической термодинамики
- •8.2.1. Термодинамические функции. Внутренняя энергия и первый закон термодинамики. Энтальпия.
- •8.2.2. Термохимия. Закон Гесса.
- •8.2.3. Энтропия. Второй и третий законы термодинамики.
- •8.2.4. Свободная энергия Гиббса. Направление химического процесса.
- •8. Химическая кинетика
- •8.3.1. Предмет химической кинетики. Скорость химической реакции. Энергия активации.
- •8.3.2. Факторы, влияющие на скорость химической реакции. Катализаторы и катализ.
- •8.3.3. Кинетическая классификация реакций.Молекулярность и порядок реакции. Механизмы реакций.
- •8.3.4. Некоторые типы многостадийных реакций.
- •8.4. Химическое равновесие
- •8.4.1. Обратимые и необратимые реакции. Состояние химического равновесия.
- •8.4.2. Смещение химического равновесия.
- •9. Растворы
- •9.1. Общая характеристика растворов
- •9.2. Разбавленные растворы неэлектролитов. Коллигативные свойства растворов
- •9.3. Растворы электролитов
- •9.3.1. Электролиты. Теория электролитической диссоциации (ионизации).
- •9.3.2. Теория растворов слабых электролитов.
- •9.3.2.1. Степень ионизации слабых электролитов и методы ее определения.
- •9.3.2.2. Равновесия в растворах слабых электролитов.
- •6,5·10-4 Моль/л
- •9.3.3. Теория сильных электролитов.
- •9.3.4. Обменные реакции в растворах электролитов.
- •9.3.4.1. Типы обменных реакций в растворах электролитов.
- •9.3.4.2. Гидролиз солей.
- •9.3.5. Теории кислот и оснований.
- •9.3.6. Окислительно-восстановительные реакции в растворах.
- •9.3.6.1.Общая характеристика окислительно-восстановительных реакций.
- •9.3.6.2. Составление уравнений окислительно-восстановительных реакций.
- •9.3.6.3. Электродные потенциалы. Направление окислительно-восстановительных реакций. Гальванический элемент.
- •9.3.6.4. Электролиз.
- •9.4. Коллоидные растворы
- •9.4.1. Общая характеристика коллоидных растворов и методы их получения.
- •9.4.2. Строение коллоидных частиц.
- •9.5. Твердые растворы
- •Список рекомендуемой литературы
5.2.8. Недостатки метода валентных связей.
Наряду с очевидными достоинствами, методу валентных связей присущи определенные ограничения и недостатки.
1. Метод ВС не способен объяснить существование частиц, связь в которых осуществляется за счет одного электрона (одноэлектронная связь). Примером таких частиц может служить молекулярный катион водорода Н2+; эта частица существует в газовой фазе и характеризуется определенными длиной и энергией связи (106 пм, 255,7 кДж/моль).
2. Метод ВС не всегда адекватно отражает физические свойства молекул, в частности, их магнитное поведение. Так, по методу ВС молекула О2 должна быть диамагнитной, так как все электроны в ней спарены. Реально же молекулярный кислород парамагнитен, причем магнитная восприимчивость молекулы кислорода соответствует наличию в ней двух неспаренных электронов.
3. Метод ВС не рассматривает возбужденные состояния молекул, в силу чего не может быть использован для объяснения спектров поглощения веществ и присущей им окраски.
4. При качественной характеристике химической связи метод ВС прост и нагляден, однако математический аппарат метода весьма сложен, громоздок и неудобен для выполнения количественных расчетов с использованием ЭВМ.
5.3. Метод молекулярных орбиталей
5.3.1. Основные принципы метода молекулярных орбиталей.
Метод молекулярных орбиталей (ММО), являющийся в настоящее время наиболее широко используемым приемом описания химической связи, базируется на иных представлениях, нежели метод валентных связей, рассмотренный в разделе 5.2.
Если метод валентных связей стремится выделить в молекуле отдельные пары атомов, между которыми возникают двухцентровые локализованные связи, то метод молекулярных орбиталей рассматривает молекулу как единую частицу, электроны которой заселяют молекулярные орбитали, принадлежащие молекуле как целому. В результате описание молекулы по методу молекулярных орбиталей имеет много общего с описанием многоэлектронного атома (раздел 2.5.). Основное отличие между молекулярными орбиталями, используемыми методами ВС и МО, состоит в том, что в случае МВС молекулярные орбитали являются двухэлектронными волновыми функциями, описывающими поведение пары электронов, образующих локализованную связь, тогда как в случае ММО молекулярные орбитали представляют одноэлектронные волновые функции и описывают не электронные пары, а каждый электрон соответствующей молекулы (как в многоэлектронном атоме). Подобные МО обычно являются многоцентровыми и, как и атомные орбитали, характеризуются определенным набором квантовых чисел, определяющих энергию и пространственное расположение орбитали. Чтобы описать молекулу по методу МО, необходимо по определенным правилам сконструировать из атомных орбиталей взаимодействующих атомов набор молекулярных орбиталей, построить энергетическую диаграмму, расположив полученные орбитали в порядке возрастания их энергий, а затем распределить на них электроны молекулы. Метод МО более универсален и прост по сравнению с методом ВС, но уступает последнему в наглядности. Свое развитие ММО получил в трудах Р. Малликена, Ф. Хунда и ряда других исследователей.
Существует несколько вариантов ММО, отличающихся принципами конструирования молекулярных орбиталей; наиболее популярным из них является метод МО ЛКАО (аббревиатура тезиса: "Молекулярная орбиталь - линейная комбинация атомных орбиталей"), в случае которого волновая функция молекулы МО конструируется по уравнению
МО = сii (5-12)
где i - атомные орбитали входящих в молекулу атомов, сi - коэффициенты, определяющие "долю" участия данной атомной орбитали в сформированной МО. Набор атомных орбиталей, используемых для построения молекулярных орбиталей, называется атомным базисом. В основе метода МО ЛКАО лежат следующие положения:
1. Состояние каждого электрона в многоатомной молекуле описывается молекулярной волновой функцией МО, квадрат которой в любой точке пространства пропорционален вероятности нахождения электрона в объеме dV, включающем данную точку.
2. Число молекулярных орбиталей равно числу атомных орбиталей, образующих атомный базис.
3. Каждой МО соответствует определенный энергетический уровень; заполнение орбиталей электронами начинается с самого нижнего уровня (как в многоэлектронном атоме).
4. Молекулярные орбитали подчиняются принципу Паули и правилу Хунда: на каждой МО могут находиться два электрона с антипараллельными спинами; при наличии нескольких вырожденных МО электронные пары на них начинают формироваться лишь после того, как все эти орбитали заполнятся неспаренными электронами.
5. Не все орбитали атомного базиса можно комбинировать в молекулярные орбитали. Комбинируемые орбитали должны перекрываться (перекрывание может быть как положительным, так и отрицательным), быть близкими по энергии и обладать сходной симметрией относительно оси связи. Если хотя бы одно из этих условий не выполняется, соответствующие атомные орбитали переходят в молекулу без изменения.
Рассмотрим построение молекулярных орбиталей по методу МО ЛКАО на примере молекулы водорода. Пусть электроны атомов водорода На и Нb описывают волновые функции а и b (а = 1sa, b = 1sb). Примем за ось связи координату z, считая ее направленной для На слева направо, а для Нb - справа налево. Учитывая, что линейное комбинирование допускает как сложение, так и вычитание волновых функций, уравнения МО (5-12) для молекулы водорода приобретут вид:
+ = с1а + с2b (5-13)
- = с3а - с4b (5-13)
Примем для простоты, что с1 = с2 = с3 = с4 = 1. Тогда,
+ = а + b
- = а - b
На рис. 17 приведены кривые волновых функций а и b (пунктирная линия) и кривая молекулярной волновой функции + (сплошная линия); чтобы найти значения последней достаточно сложить значения а и b, отвечающие каждой точке оси z. Как следует из рисунка 17, для областей отрицательных значений координаты z а и b практически совпадают с кривой +, а в пространстве между ядрами атомов водорода + больше нуля при любых значениях z. Поскольку
+2 = а2 + b2 + 2аb > а2 + b2
вероятность нахождения электронов между ядрами, определяемая значением +2, будет больше, если электроны будут располагаться на орбитали +, чем если каждый их них находился на одной из атомных орбиталей. Соответственно возрастает плотность отрицательного заряда между ядрами, что приводит к сближению ядер. В результате молекулярные орбитали, являющиеся суммой атомных орбиталей, характеризуются более низкой энергией, чем комбинируемые атомные орбитали; заселение таких орбиталей электронами стабилизирует образующуюся молекулу, в силу чего орбитали, представляющие сумму атомных орбиталей, называются связывающими молекулярными орбиталями (СМО).
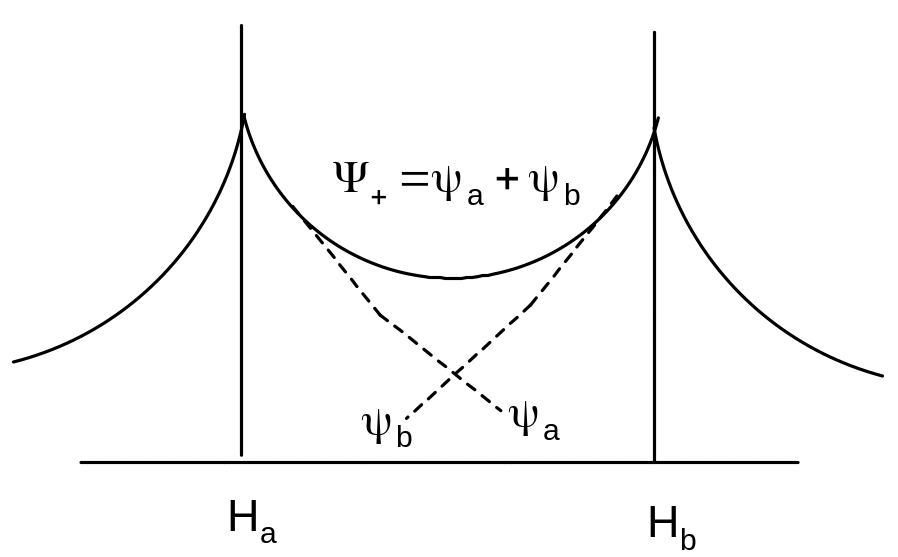
Рис. 17. Волновые функции а, b и +
Для молекулярной орбитали - значение b следует брать со знаком минус, в результате чего для точки, равно удаленной от ядер атомов На и Нb, значение - становится равным нулю (рис. 18), плотность электронного облака между ядрами понижается, а энергия системы при расположении электронов на --орбитали увеличивается, что влечет за собой дестабилизацию частицы. Орбитали, представляющие разность атомных орбиталей, называются разрыхляющими молекулярными орбиталями (РМО).

Рис. 18. Волновые функции а, b и -
Если атомные орбитали не могут быть скомбинированы в связывающие или разрыхляющие молекулярные орбитали, то они переходят в молекулу без изменений и называются несвязывающими молекулярными орбиталями; заселение несвязывающих орбиталей электронами не влияет на энергию частицы.
Граничные поверхности связывающей и разрыхляющей орбиталей, сконструированных из 1sa и 1sb-орбиталей с указанием знака волновых функций показаны на рис. 19. Как следует из рис. 19, обе МО являются симметричными относительно оси связи: поворот этих орбиталей вокруг оси z на 180 не сопровождается изменением знака волновой функции. Подобные орбитали называют сигма-орбиталями и обозначают символом с верхним индексом, указывающим является ли данная орбиталь связывающей, разрыхляющей или несвязывающей ("св.", "р", "нс") и с нижним индексом, указывающим на то, из каких АО сконструирована данная МО. Так, орбитали, построенные из 1sa и 1sb-орбиталей, можно обозначить символами sсв (или 1sсв) и sр (или 1sр).
Энергетические характеристики орбиталей атомного базиса и полученных из них молекулярных орбиталей удобно выражать с помощью энергетической диаграммы. На подобных диаграммах откладывают значения энергии атомных орбиталей и построенных из них молекулярных орбиталей (в середине); пунктирные линии на диаграмме показывают, из каких АО сконструированы МО (рис. 20). Валентные электроны взаимодействующих атомов распределяют по молекулярным орбиталям в порядке возрастания энергии последних, что дает определенную электронную формулу (электронную конфигурацию) молекулы и позволяет охарактеризовать ее свойства. Так, в случае молекулы водорода два валентных электрона займут орбиталь sсв (рис. 20), чему соответствует электронная формула (sсв)2.

Рис. 19. Граничные поверхности молекулярных орбиталей молекулы водорода

Рис. 20. Энергетическая диаграмма системы из двух атомов водорода
Метод МО не требует использования понятия валентность. В то же время важное значение для описания молекул приобретает характеристика, называемая кратностью связи. Кратность (порядок) связи определяют как полуразность числа электронов на связывающих и разрыхляющих орбиталях:
КС
=
![]() (5-15)
(5-15)
Кратность связи может быть как целочисленной, так и дробной величиной.
Метод молекулярных орбиталей позволяет оценить ряд важнейших характеристик молекул. К ним относятся:
1. Принципиальная возможность существования частиц. Частица может существовать, если кратность связи для нее больше нуля. При кратности связи, равной нулю, частица неустойчива.
2. Энергия связи. Энергия связи тем выше, чем больше кратность связи. При одинаковых значениях кратности связи энергия связи для различных частиц могут отличаться в зависимости от природы последних.
3. Длина связи (межъядерное расстояние). Межъядерное расстояние тем меньше, чем больше кратность связи.
4. Магнитные свойства частиц. По своему отношению к внешнему магнитному полю частицы делятся на две группы:
а) парамагнитные частицы, втягиваемые магнитным полем; такие частицы содержат неспаренные электроны;
б) диамагнитные частицы, выталкиваемые магнитным полем; все электроны таких частиц спарены.
Метод МО позволяет установить, содержит ли частица неспаренные электроны и, следовательно, является ли она парамагнитной или диамагнитной.
