
- •Э.А. Гюннер, в.Ф. Шульгин общая химия
- •Введение Предмет и структура химии
- •1. Химическая атомистика
- •1.1. Основные положения и понятия химической атомистики
- •1.2. Стехиометрические законы химии
- •1.3. Методы определения молекулярных масс и атомных масс
- •Методы определения молекулярных масс.
- •1.3.2. Методы определения атомных масс.
- •2. Основы теории строения атома
- •2.1. Предпосылки возникновения квантово-механической теории
- •2.2. Постулаты квантово-механической теории
- •2.3. Волновая функция. Уравнение Шредингера
- •2.4. Атом водорода. Одноэлектронные атомарные ионы
- •2.5. Многоэлектронные атомы
- •3. Периодический закон д.И. Менделеева в свете квантово-механических представлений
- •3.1. Современная формулировка Периодического закона
- •3.2. Структура периодической системы элементов: периоды, группы, подгруппы элементов
- •3.3. Закономерности изменения свойств элементов в периодах и подгруппах периодической системы
- •3.3.1. Эффективный заряд ядра.
- •3.3.2. Атомные радиусы.
- •3.3.3. Энергия ионизации.
- •3.3.4. Сродство к электрону.
- •3.3.5. Электроотрицательность.
- •3.3.6. Степени окисления элементов.
- •3.4. Элементы-аналоги. Виды аналогии в периодической системе элементов
- •3.4.1. Групповая аналогия.
- •3.4.2. Типовая аналогия.
- •3.4.3. Электронная аналогия.
- •VI группа I группа
- •3.4.4. Слоевая аналогия.
- •3.4.5. Контракционная аналогия (шринк-аналогия).
- •3.4.6. Горизонтальная аналогия.
- •3.4.7. Диагональная аналогия.
- •4. Атомное ядро. Радиоактивность
- •4.1. Элементарные частицы
- •4.2. Теория строения атомных ядер
- •4.3. Ядерные реакции
- •4.4.Радиоактивность. Типы радиоактивного распада
- •4.5. Законы радиоактивного распада
- •4.6. Естественная радиоактивность. Радиоактивные ряды. Радиоактивное равновесие
- •4.7. Искусственная радиоактивность. Изотопная индикация
- •4.8. Новые химические элементы
- •4.9. Эволюция элементов во Вселенной
- •5. Химическая связь и строение молекул
- •5.1. Химическая связь. Параметры химической связи. Валентность
- •5.2. Метод валентных связей
- •5.2.1. Основные принципы метода валентных связей.
- •5.2.2. Насыщаемость ковалентной связи. Механизм образования двухцентровой связи.
- •5.2.3. Направленность ковалентной связи. Гибридизация электронных орбиталей.
- •5.2.4. Кратность ковалентной связи.
- •5.2.5. Делокализованные многоцентровые связи. Теория резонанса.
- •5.2.6. Предсказание геометрической формы молекул.
- •5.2.7. Неполярные и полярные связи. Типы ковалентных молекул.
- •5.2.8. Недостатки метода валентных связей.
- •5.3. Метод молекулярных орбиталей
- •5.3.1. Основные принципы метода молекулярных орбиталей.
- •5.3.2. Применение метода молекулярных орбиталей.
- •5.3.2.1. Двухатомные молекулы.
- •5.3.2.2. Молекулы, состоящие из трех и более атомов.
- •5.4. Ионная связь
- •5.4.1. Особенности ионной связи. Свойства ионных соединений.
- •5.4.2. Типы кристаллических решеток ионных соединений. Ионные радиусы.
- •5.3.3. Энергия ионной кристаллической решетки.
- •5.4.4. Поляризация ионов.
- •5.5. Металлическая связь. Зонная теория кристаллов
- •5.6. Межмолекулярное взаимодействие
- •5.7. Водородная связь
- •6. Координационные соединения
- •6.1. Координационные соединения. Основные положения координационной теории
- •6.2. Классификация координационных соединений
- •6.3. Номенклатура координационных соединений
- •6.4. Изомерия координационных соединений
- •6.5. Химическая связь в координационных соединениях
- •6.5.1. Метод валентных связей
- •6.2. Теория кристаллического поля
- •6.3. Метод молекулярных орбиталей
- •6.7. Реакции внешнесферного и внутрисферного замещения. Принцип транс-влияния
- •7. Агрегатные состояния вещества
- •7.1. Типы агрегатного состояния
- •7.2. Твердое состояние вещества
- •7.2.1. Кристаллическое состояние.
- •7.2.2. Аморфное состояние.
- •7.3. Жидкое состояние вещества
- •7.4. Газообразное состояние вещества
- •7.5. Плазма
- •8. Теория химических процессов
- •8.1. Предмет и основные понятия теории химических процессов
- •8.2. Основы химической термодинамики
- •8.2.1. Термодинамические функции. Внутренняя энергия и первый закон термодинамики. Энтальпия.
- •8.2.2. Термохимия. Закон Гесса.
- •8.2.3. Энтропия. Второй и третий законы термодинамики.
- •8.2.4. Свободная энергия Гиббса. Направление химического процесса.
- •8. Химическая кинетика
- •8.3.1. Предмет химической кинетики. Скорость химической реакции. Энергия активации.
- •8.3.2. Факторы, влияющие на скорость химической реакции. Катализаторы и катализ.
- •8.3.3. Кинетическая классификация реакций.Молекулярность и порядок реакции. Механизмы реакций.
- •8.3.4. Некоторые типы многостадийных реакций.
- •8.4. Химическое равновесие
- •8.4.1. Обратимые и необратимые реакции. Состояние химического равновесия.
- •8.4.2. Смещение химического равновесия.
- •9. Растворы
- •9.1. Общая характеристика растворов
- •9.2. Разбавленные растворы неэлектролитов. Коллигативные свойства растворов
- •9.3. Растворы электролитов
- •9.3.1. Электролиты. Теория электролитической диссоциации (ионизации).
- •9.3.2. Теория растворов слабых электролитов.
- •9.3.2.1. Степень ионизации слабых электролитов и методы ее определения.
- •9.3.2.2. Равновесия в растворах слабых электролитов.
- •6,5·10-4 Моль/л
- •9.3.3. Теория сильных электролитов.
- •9.3.4. Обменные реакции в растворах электролитов.
- •9.3.4.1. Типы обменных реакций в растворах электролитов.
- •9.3.4.2. Гидролиз солей.
- •9.3.5. Теории кислот и оснований.
- •9.3.6. Окислительно-восстановительные реакции в растворах.
- •9.3.6.1.Общая характеристика окислительно-восстановительных реакций.
- •9.3.6.2. Составление уравнений окислительно-восстановительных реакций.
- •9.3.6.3. Электродные потенциалы. Направление окислительно-восстановительных реакций. Гальванический элемент.
- •9.3.6.4. Электролиз.
- •9.4. Коллоидные растворы
- •9.4.1. Общая характеристика коллоидных растворов и методы их получения.
- •9.4.2. Строение коллоидных частиц.
- •9.5. Твердые растворы
- •Список рекомендуемой литературы
5.2.4. Кратность ковалентной связи.
Между двумя атомами в молекуле возможно образование не только одной, но и нескольких локализованных связей. Ковалентные связи, осуществляемые двумя и более электронными парами называются кратными связями, в отличие от связи, осуществляемой одной электронной парой, называемой одинарной. Число электронных пар, связывающих два атома, называется кратностью связи.
При образовании кратных связей всегда соблюдается следующее правило: электронные облака взаимодействующих атомов, образующие кратные связи не могут перекрываться в одном и том же направлении, т.е. иметь одинаковое расположение в пространстве. Так, например, если между двумя атомами, ядра которых лежат на оси х образовалась связь в результате перекрывания двух px-орбиталей, то вторая связь за счет перекрывания s- или dx2-y2 орбиталей возникнуть не может, так как эти орбитали перекрываются в том же направлении, что и px-орбитали.
В зависимости от характера перекрывания различают три вида ковалентной связи.
1. Сигма-связь (-связь). Перекрывание валентных орбиталей происходит вдоль линии связи, т.е. линии, соединяющей ядра взаимодействующих атомов. -Связь, таким образом, включает координатную ось, соединяющую ядра, которая в данном случае является осью симметрии связывающего электронного облака. -Связь может быть образована орбиталями любого типа (s-, p-, d-орбитали), если эти орбитали положительно перекрываются по линии связи; наиболее прочная -связь образуется за счет гибридных орбиталей, так как эти орбитали перекрываются лучше, чем "чистые" орбитали. В силу этого образованию -связи обычно предшествует гибридизация, если последняя возможна. На рис. 6,а и 13,а приведены примеры перекрывания различных типов орбиталей (s-, px- , -, sp-гибриды), приводящие к образованию -связей.
2. Пи-связь (-связь). Перекрывание орбиталей происходит в направлении, перпендикулярном линии связи (боковое перекрывание). Образующееся при этом связывающее электронное облако имеет плоскость симметрии, включающую линию связи и одну из координатных осей. Поскольку линии связи (ось х) перпендикулярны как ось у, так и ось z, между двумя атомами могут возникнуть две -связи, для которых электронные облака не будут пространственно совмещаться. -Связь может образовываться за счет как р-, так и d-орбиталей. На рис. 13,б показано перекрывание пар pz- и dxy-орбиталей, приводящее к образованию -связей. s-Орбитали, перекрывающиеся только по линии связи, образовывать -связи не могут; не образуют -связи также пары типа pza-pyb, так как их перекрывание нулевое.
Поскольку перекрывание атомных орбиталей при образовании -связей происходит вне области максимальной плотности электронных облаков, прочность -связи меньше прочности -связи. Тем не менее образование -связей дополнительно стабилизирует молекулу. Поэтому, если -связь образуется за счет гибридной орбитали, реализуется тот тип гибридизации, который обеспечивает одновременное образование максимального числа -связей.
3.
Дельта-связь (-связь).
Перекрывающиеся орбитали расположены
в двух параллельных плоскостях,
перпендикулярных линии связи. -Связь
может образоваться в результате
перекрывания
![]() -орбиталей
взаимодействующих атомов, если линией
связи является ось z
(рис. 13,в); при этом между двумя атомами
возможно образование только одной
-связи.
Гибридные орбитали, а также чистые s-
и р-орбитали -связей
не образуют.
-орбиталей
взаимодействующих атомов, если линией
связи является ось z
(рис. 13,в); при этом между двумя атомами
возможно образование только одной
-связи.
Гибридные орбитали, а также чистые s-
и р-орбитали -связей
не образуют.
Таким образом максимальная теоретически возможная кратность связи между двумя атомами равна четырем (одна -, две - и одна -связь).

Рис. 13. Перекрывание электронных орбиталей при образовании -(а), -(б) и -связей (в)
В качестве примера соединения с - и -связями можно привести молекулу азота N2. Атом азота, имеющий электронную конфигурацию 1s22s22p3, характеризуется наличием на валентных энергетических подуровнях электронной пары и трех неспаренных электронов. Наиболее выгодным типом гибридизации в данном случае является sp-гибридизация, при которой сохраняются две "чистые" р-орбитали, обеспечивающие образование двух -связей:

На двух sp-гибридных орбиталях каждого атома азота распределяются три электрона (электронная пара и неспаренный электрон); электронные пары остаются неподеленными, а непарные электроны образуют -связь, направленную по оси х. Неспаренные электроны образуют две -связи, ориентированные взаимно перпендикулярно. Структура молекулы :NN: приведена на рис. 14,а.
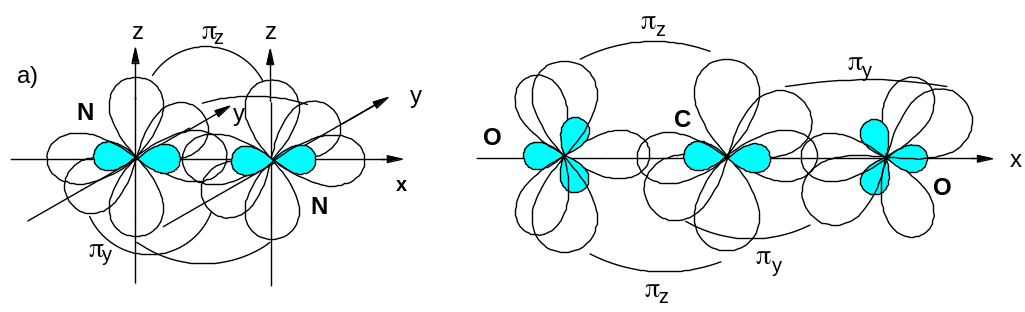
Рис. 14 Строение молекул азота(а) и диоксида углерода(б)
Аналогичную структуру имеет молекула оксида углерода(II), изоэлектронная молекуле азота. Однако в этой молекуле одна из -связей образуется по донорно-акцепторному механизму за счет неподеленной пары кислорода и вакантной орбитали углерода, что приводит к структуре
![]()
При образовании молекулы диоксида углерода атомы углерода и кислорода подвергаются sp- и sp2-гибридизации соответственно:

В результате атом углерода образует по одной -связи и по одной -связи с каждым атомом кислорода. Строение молекулы СО2 показано на рис. 14,б. Заметим, что в рассматриваемой молекуле каждый атом кислорода имеет по две неподеленные электронные пары на sp2-гибридах.
-Связь реализуется значительно реже, чем - и -связи. Примером соединения с -связью может служить ион [Re2Cl8]2-. Соединения, содержащие этот ион можно получить восстановлением производных рения(VII) фосфорноватистой кислотой, например,
2KReO4 + 2H3PO2 + 8HCl = K2[Re2Cl8] + 2H3PO4 + 4H2O
В ионе [Re2Cl8]2- рений имеет степень окисления +3, чему соответствует электронная конфигурация 5d5; конфигурация иона Cl- - 3s23p6. Распределение электронов по валентным орбиталям показано ниже:

При
образовании [Re2Cl8]2-
атом рения подвергается двум типам
гибридизации. Орбитали
,
s,
px
и py
каждого атома гибридизуются по схеме
dsp2,
образуя четыре гибридные орбитали,
лежащие в одной плоскости; эти орбитали
вакантны и образуют с ионами хлора
-связи
по донорно-акцепторному механизму.
Орбитали
![]() и pz
образуют два dp-гибрида,
ориентированные линейно по оси z,
на которой лежат ядра атомов рения. У
каждого атома рения одна dp-орбиталь
остается вакантной, а вторая идет на
образование -связи
между атомами рения, направленной по
оси z.
Оставшиеся у атома рения три "чистые"
d-орбитали,
занятые неспаренными электронами,
позволяют образовать между атомами
рения две -связи
(за счет dxz
и dyz-орбиталей)
и одну -связь
(за счет dxy-орбитали).
и pz
образуют два dp-гибрида,
ориентированные линейно по оси z,
на которой лежат ядра атомов рения. У
каждого атома рения одна dp-орбиталь
остается вакантной, а вторая идет на
образование -связи
между атомами рения, направленной по
оси z.
Оставшиеся у атома рения три "чистые"
d-орбитали,
занятые неспаренными электронами,
позволяют образовать между атомами
рения две -связи
(за счет dxz
и dyz-орбиталей)
и одну -связь
(за счет dxy-орбитали).
