
- •Э.А. Гюннер, в.Ф. Шульгин общая химия
- •Введение Предмет и структура химии
- •1. Химическая атомистика
- •1.1. Основные положения и понятия химической атомистики
- •1.2. Стехиометрические законы химии
- •1.3. Методы определения молекулярных масс и атомных масс
- •Методы определения молекулярных масс.
- •1.3.2. Методы определения атомных масс.
- •2. Основы теории строения атома
- •2.1. Предпосылки возникновения квантово-механической теории
- •2.2. Постулаты квантово-механической теории
- •2.3. Волновая функция. Уравнение Шредингера
- •2.4. Атом водорода. Одноэлектронные атомарные ионы
- •2.5. Многоэлектронные атомы
- •3. Периодический закон д.И. Менделеева в свете квантово-механических представлений
- •3.1. Современная формулировка Периодического закона
- •3.2. Структура периодической системы элементов: периоды, группы, подгруппы элементов
- •3.3. Закономерности изменения свойств элементов в периодах и подгруппах периодической системы
- •3.3.1. Эффективный заряд ядра.
- •3.3.2. Атомные радиусы.
- •3.3.3. Энергия ионизации.
- •3.3.4. Сродство к электрону.
- •3.3.5. Электроотрицательность.
- •3.3.6. Степени окисления элементов.
- •3.4. Элементы-аналоги. Виды аналогии в периодической системе элементов
- •3.4.1. Групповая аналогия.
- •3.4.2. Типовая аналогия.
- •3.4.3. Электронная аналогия.
- •VI группа I группа
- •3.4.4. Слоевая аналогия.
- •3.4.5. Контракционная аналогия (шринк-аналогия).
- •3.4.6. Горизонтальная аналогия.
- •3.4.7. Диагональная аналогия.
- •4. Атомное ядро. Радиоактивность
- •4.1. Элементарные частицы
- •4.2. Теория строения атомных ядер
- •4.3. Ядерные реакции
- •4.4.Радиоактивность. Типы радиоактивного распада
- •4.5. Законы радиоактивного распада
- •4.6. Естественная радиоактивность. Радиоактивные ряды. Радиоактивное равновесие
- •4.7. Искусственная радиоактивность. Изотопная индикация
- •4.8. Новые химические элементы
- •4.9. Эволюция элементов во Вселенной
- •5. Химическая связь и строение молекул
- •5.1. Химическая связь. Параметры химической связи. Валентность
- •5.2. Метод валентных связей
- •5.2.1. Основные принципы метода валентных связей.
- •5.2.2. Насыщаемость ковалентной связи. Механизм образования двухцентровой связи.
- •5.2.3. Направленность ковалентной связи. Гибридизация электронных орбиталей.
- •5.2.4. Кратность ковалентной связи.
- •5.2.5. Делокализованные многоцентровые связи. Теория резонанса.
- •5.2.6. Предсказание геометрической формы молекул.
- •5.2.7. Неполярные и полярные связи. Типы ковалентных молекул.
- •5.2.8. Недостатки метода валентных связей.
- •5.3. Метод молекулярных орбиталей
- •5.3.1. Основные принципы метода молекулярных орбиталей.
- •5.3.2. Применение метода молекулярных орбиталей.
- •5.3.2.1. Двухатомные молекулы.
- •5.3.2.2. Молекулы, состоящие из трех и более атомов.
- •5.4. Ионная связь
- •5.4.1. Особенности ионной связи. Свойства ионных соединений.
- •5.4.2. Типы кристаллических решеток ионных соединений. Ионные радиусы.
- •5.3.3. Энергия ионной кристаллической решетки.
- •5.4.4. Поляризация ионов.
- •5.5. Металлическая связь. Зонная теория кристаллов
- •5.6. Межмолекулярное взаимодействие
- •5.7. Водородная связь
- •6. Координационные соединения
- •6.1. Координационные соединения. Основные положения координационной теории
- •6.2. Классификация координационных соединений
- •6.3. Номенклатура координационных соединений
- •6.4. Изомерия координационных соединений
- •6.5. Химическая связь в координационных соединениях
- •6.5.1. Метод валентных связей
- •6.2. Теория кристаллического поля
- •6.3. Метод молекулярных орбиталей
- •6.7. Реакции внешнесферного и внутрисферного замещения. Принцип транс-влияния
- •7. Агрегатные состояния вещества
- •7.1. Типы агрегатного состояния
- •7.2. Твердое состояние вещества
- •7.2.1. Кристаллическое состояние.
- •7.2.2. Аморфное состояние.
- •7.3. Жидкое состояние вещества
- •7.4. Газообразное состояние вещества
- •7.5. Плазма
- •8. Теория химических процессов
- •8.1. Предмет и основные понятия теории химических процессов
- •8.2. Основы химической термодинамики
- •8.2.1. Термодинамические функции. Внутренняя энергия и первый закон термодинамики. Энтальпия.
- •8.2.2. Термохимия. Закон Гесса.
- •8.2.3. Энтропия. Второй и третий законы термодинамики.
- •8.2.4. Свободная энергия Гиббса. Направление химического процесса.
- •8. Химическая кинетика
- •8.3.1. Предмет химической кинетики. Скорость химической реакции. Энергия активации.
- •8.3.2. Факторы, влияющие на скорость химической реакции. Катализаторы и катализ.
- •8.3.3. Кинетическая классификация реакций.Молекулярность и порядок реакции. Механизмы реакций.
- •8.3.4. Некоторые типы многостадийных реакций.
- •8.4. Химическое равновесие
- •8.4.1. Обратимые и необратимые реакции. Состояние химического равновесия.
- •8.4.2. Смещение химического равновесия.
- •9. Растворы
- •9.1. Общая характеристика растворов
- •9.2. Разбавленные растворы неэлектролитов. Коллигативные свойства растворов
- •9.3. Растворы электролитов
- •9.3.1. Электролиты. Теория электролитической диссоциации (ионизации).
- •9.3.2. Теория растворов слабых электролитов.
- •9.3.2.1. Степень ионизации слабых электролитов и методы ее определения.
- •9.3.2.2. Равновесия в растворах слабых электролитов.
- •6,5·10-4 Моль/л
- •9.3.3. Теория сильных электролитов.
- •9.3.4. Обменные реакции в растворах электролитов.
- •9.3.4.1. Типы обменных реакций в растворах электролитов.
- •9.3.4.2. Гидролиз солей.
- •9.3.5. Теории кислот и оснований.
- •9.3.6. Окислительно-восстановительные реакции в растворах.
- •9.3.6.1.Общая характеристика окислительно-восстановительных реакций.
- •9.3.6.2. Составление уравнений окислительно-восстановительных реакций.
- •9.3.6.3. Электродные потенциалы. Направление окислительно-восстановительных реакций. Гальванический элемент.
- •9.3.6.4. Электролиз.
- •9.4. Коллоидные растворы
- •9.4.1. Общая характеристика коллоидных растворов и методы их получения.
- •9.4.2. Строение коллоидных частиц.
- •9.5. Твердые растворы
- •Список рекомендуемой литературы
5.2.3. Направленность ковалентной связи. Гибридизация электронных орбиталей.
Ковалентная связь тем прочнее, чем сильнее перекрываются атомные орбитали взаимодействующих атомов. Действительно, чем полнее перекрывание атомных орбиталей, тем выше электронная плотность между ядрами, ниже энергия образовавшейся частицы и, следовательно, выше энергия связи. Поскольку атомные орбитали ориентированы в пространстве строго определенным образом (раздел 2.4), для максимального перекрывания электронных орбиталей необходимо, чтобы взаимодействующие атомы были определенным образом ориентированы друг относительно друга. В результате образующиеся молекулы должны иметь определенную геометрическую форму, обеспечивающую максимальное перекрывание и наиболее прочную связь.
В качестве примера рассмотрим строение молекулы теллуроводорода. Теллур, аналог кислорода, имеет электронную конфигурацию 5s25p4. Образование связей в молекуле Н2Те происходит за счет перекрывания 1s-орбиталей двух атомов водорода с двумя 5р-орбиталями атома теллура (например, 5px и 5pz). Поскольку 5px-орбиталь направлена по оси х, а 5pz-орбиталь - по оси z, максимальное перекрывание будет наблюдаться тогда, когда ядро одного атома водорода окажется на оси х, а другого - на оси z (рис. 9,а). Вследствие этого молекула теллуроводорода должна иметь угловую форму с углом между связями Те-Н, близким к 90 , т.е. углу между орбитали px и pz. Экспериментально определенное значение валентного угла в молекуле Н2Те составляет 90,25 . Аналогично молекула гидрида сурьмы SbH3, в которой связи образуются в результате перекрывания трех 5р-орбиталей сурьмы с 1s-орбиталями трех атомов водорода, должна иметь форму тригональной пирамиды с прямыми углами при вершине. Действительно, валентные углы для молекулы SbH3 составляют 91,6 , т.е. весьма близки к ожидаемым (рис. 9,б).
Более сложная картина наблюдается в том случае, когда атом предоставляет для образования связей орбитали различных подуровней. Рассмотрим это вопрос на примере молекул газообразного фторида бериллия. Атом бериллия в этом соединении образует две связи с атомами фтора по обменному механизму, что требует перехода электронной конфигурации невозбужденного атома 2s2 в конфигурацию 2s12p1 (раздел 4.2.2). В результате можно ожидать, что связи в молекуле ВеF2 не будут равноценными, так как одна из них образуется за счет s-электрона, а вторая - за счет р-электрона. Однако в действительности обе связи в молекуле BeF2 абсолютно равноценны как по длине, так и по энергии. Аналогичное явление наблюдается для молекул BF3 и CF4, все связи в которых идентичны. Для объяснения этих и множества других подобных фактов Л.Полингом была предложена теория гибридизации электронных орбиталей, основные положения которой рассмотрены ниже.
Л.Полинг показал, что понижение энергии системы при образовании молекул становится более значительным, если волновые функции орбиталей, используемых атомом для образования связей, заменить их линейной комбинацией. Подобное "смешивание" волновых функций атома называется гибридизацией электронных орбиталей, а полученные в результате этой операции "смешанные" волновые функции - гибридными орбиталями. В результате гибридизации из нескольких отличающихся по энергии, форме граничной поверхности и кривой распределения электронной плотности орбиталей образуется такое же число одинаковых по энергии и форме граничной поверхности гибридных орбиталей. Последние ориентированы в пространстве таким образом, чтобы отталкивание между электронами было минимальным.

Рис. 9. Перекрывание атомных орбиталей при образовании молекул TeH2(a) и SbH3(б)
Рассмотрим простейший тип гибридизации, являющийся результатом смешивания s-орбитали и одной р-орбитали (например, рх) этот тип гибридизации называется sp-гибридизацией. Линейная комбинация взаимодействующих орбиталей s и px выразится уравнением
sp = c1s + c2px
где коэффициенты с1 и с2 определяют доли s- и р-характера полученной гибридной орбитали. Поскольку в данном случае s- и р-орбитали вносят в гибридную орбиталь одинаковые вклады, коэффициенты с1 и с2 равны по абсолютной величине, хотя могут отличаться по знаку, так как линейное комбинирование подразумевает как сложение, так и вычитание комбинируемых функций. Численные значения с1 и с2 можно найти, исходя из того, что гибридная функция должна быть нормированной (раздел 1.3). В этом случае
![]()
откуда
![]()
Поскольку
s
-и р-орбитали нормированы порознь,
интегралы
![]() и
и
![]() равны единице. Интеграл
равны единице. Интеграл
![]() является интегралом перекрывания s-
и р-орбиталей, принадлежащих одному
атому. Подобные орбитали обладают особым
свойством, называемым ортогональностью:
полное перекрывание любых двух орбиталей,
принадлежащих одному атому, всегда
является нулевым. Чтобы убедиться в
этом достаточно взглянуть на рис. 10, на
котором показано перекрывание s-
и рх-орбиталей.
является интегралом перекрывания s-
и р-орбиталей, принадлежащих одному
атому. Подобные орбитали обладают особым
свойством, называемым ортогональностью:
полное перекрывание любых двух орбиталей,
принадлежащих одному атому, всегда
является нулевым. Чтобы убедиться в
этом достаточно взглянуть на рис. 10, на
котором показано перекрывание s-
и рх-орбиталей.
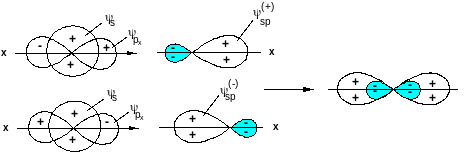
Рис. 10. Построение sp-гибридных орбиталей
Области перекрывания s-орбитали каждым из лепестков рх-орбитали равны, однако для положительных значений х перекрывание положительно, а для отрицательных - отрицательно, в результате чего полное перекрывание равно нулю. Отсюда интеграл перекрывания также равен нулю, соответственно
![]()
что приводит к двум уравнениям гибридных орбиталей
![]()
![]()
Изменение граничных поверхностей орбиталей при гибридизации показано на рис. 10. Как следует из рис. 10, при нулевом полном перекрывании орбиталей (свойство ортогональности) перекрывание будет положительным в области положительных значений рх и отрицательным там, где рх < 0. В результате гибридные орбитали приобретают форму асимметричной гантели. Такая форма обеспечивает большее перекрывание при образовании связи, чем в случае "чистых" атомных орбиталей. Поэтому образование связей с участием гибридных орбиталей энергетически более выгодно.
Образовавшиеся гибридные орбитали ориентируются в пространстве так, чтобы силы отталкивания между находящимися на них электронами были минимальными. В случае sp-гибридизации гибридные орбитали ориентируются по одной оси в разные стороны, а угол между ними составляет 180 .
Гибридные орбитали подчиняются всем квантово-механическим законам: на гибридной орбитали могут находиться не более двух электронов с антипараллельными спинами (принцип Паули), на вырожденных гибридных орбиталях электроны распределяются так, чтобы суммарный спин их был максимальным (правило Хунда). Именно по этой причине sp-гибридизация для атома бериллия приводит к распариванию 2s2-электронов и распределению их по одному на орбиталях двухкратно вырожденного sp-уровня.
Не все атомные орбитали могут быть гибридизованы. Устойчивая гибридизация требует соблюдения определенных условий:
1. Гибридизируемые орбитали должны быть близки по энергии. По этой причине s- и р-орбитали гибридизируются лишь тогда, когда они принадлежат одному и тому же энергетическому уровню. В случае d-орбиталей дело обстоит несколько иначе. Поскольку (n-1)d-орбитали не слишком сильно отличаются по энергии от ns-орбиталей, возможны три варианта гибридизации:
а) Внешняя гибридизация, при которой гибридизируются s-, p- и d-орбитали, принадлежащие одному энергетическому уровню и характеризующиеся одинаковым значением главного квантового числа. В случае этого типа гибридизации d-орбитали записываются после p-орбиталей (например, sp3d2);
б) Внутренняя гибридизация - гибридизируются (n-1)d-, ns- и np-орбитали. При записи данного типа гибридизации d-орбитали предшествуют s-орбиталям (например, d2sp3);
в) Смешанная гибридизация - в гибридизации участвуют как nd-, так и (n-1)d-орбитали. В случае смешанной гибридизации число (n-1)d-орбиталей указывается перед ns-орбиталями, число d-орбиталей - после np-орбиталей (например, dsp3d).
2. Гибридизируемые орбитали должны иметь достаточно высокую электронную плотность. В подгруппах периодической системы с увеличением главного квантового числа размеры орбиталей увеличиваются, а число электронов на валентных орбиталях не изменяется, в результате чего электронная плотность понижается. Поэтому в подгруппах элементов при перемещении сверху вниз способность к гибридизации атомных орбиталей убывает. Именно по этой причине в рассмотренных выше молекулах TeH2 и SbH3 связи образуются за счет p-орбиталей (рис. 9), а гибридизация не наблюдается.
Случай sp-гибридизации был рассмотрен выше. Этот тип гибридизации сопровождается образованием из s- и одной р-орбитали двух гибридных орбиталей и обеспечивает валентный угол, равный 180 . sp-Гибридизации соответствует образование линейных молекул, примером которых может служить молекула газообразного гидрида бериллия (рис. 11,а).
В случае sp2-гибридизации смешиваются s- и две р-орбитали. Полученные при этом асимметричные гибридные орбитали лежат в одной плоскости, образуя равносторонний треугольник; угол между смежными орбиталями составляет 120. sp2-Гибридизации подвергается, например, атом бора в молекуле ВН3, имеющей форму равностороннего треугольника (рис. 11,б). Следует отметить, что молекула ВН3 нестабильна и существует лишь в газовой фазе при высокой температуре, а при обычных температурах она димеризуется в диборан В2Н6.
При sp3-гибридизации из s- и трех р-орбиталей образуется четыре гибрида, направленные от центра тетраэдра к его вершинам. Валентный угол в молекулах с sp3-гибридизацией центрального атома составляет 109,5 ; примером молекул с данным типом гибридизации может служить молекула метана (рис. 11,в).

Рис. 11 Строение молекул BeH2(а), BH3(б) и CH4(в)
Некоторые типы гибридизации с участием d-орбиталей представлены в табл. 11, в которой приведены геометрические модели гибридных орбиталей, значения валентных углов и примеры молекул и ионов, центральный атом которых подвергается данному типу гибридизации.
Как правило, все орбитали, образующиеся при гибридизации данного типа, эквивалентны как по значениям валентных углов, так и по длине образующихся связей. Исключением является sp3d-гибридизация, в случае которой пять гибридных орбиталей образуют тригональную бипирамиду. При этом три орбитали располагаются в экваториальной плоскости (экваториальные орбитали), а две орбитали направлены перпендикулярно этой плоскости (аксиальные орбитали). Валентные углы, отвечающие этому типу гибридизации, не одинаковы (120 между экваториальными орбиталями, 180 между аксиальными орбиталями и 90 между экваториальными и аксиальными орбиталями). Связи, образованные за счет экваториальных и аксиальных орбиталей, несколько отличаются как по длине, так и по энергии. Так, в молекуле PСl5 длина связей P-Cl равна 202 пм для экваториальных и 212 пм для аксиальных орбиталей. Существует мнение, что dsp3-гибридизация не является индивидуальной, а представляет собой сочетание sp2-гибридизации (экваториальные орбитали) и pd-гибридизации (аксиальные орбитали). При таком подходе причины неэквивалентности гибридных орбиталей фосфора в PCl5 становятся очевидными.
Таблица 11.
Некоторые типы гибридизации с участием s-, p- и d-орбиталей
Тип гибридизации |
Геометрическая модель гибридных орбиталей |
Валентные углы, |
Примеры |
sp |
Прямая линия |
180 |
BeF2 |
dp |
Прямая линия |
180 |
[Re2Cl8]2- |
sp2 |
Треугольник |
120 |
BF3 |
sp3 |
Тетраэдр |
109,5 |
[BF4]1- |
d3s |
Тетраэдр |
109,5 |
[MnO4]1- |
dsp2 |
Квадрат |
90, 180 |
[AuCl4]1- |
sp3d |
Тригональная бипирамида |
90, 120, 180 |
PCl5 |
sp3d2 |
Октаэдр |
90, 180 |
SF6 |
На гибридных орбиталях могут находиться как неспаренные электроны, так и электронные пары, гибридные орбитали могут также оставаться вакантными. В результате подвергшийся гибридизации атом может образовывать связи как по обменному, так и по донорно-акцепторному механизму. Наличие в образовавшейся молекуле неподеленных пар на гибридных орбиталях оказывает влияние на геометрию частицы, искажая валентные углы, соответствующие данному типу гибридизации. Неподеленная пара электронов менее оттянута от ядра центрального атома, чем связывающая, находящаяся между ядрами. В связи с этим неподеленная электронная пара оказывает большее отталкивающее действие на другие электронные пары, нежели связывающая. В результате углы между орбиталями, занятыми связывающими парами, уменьшаются, а неподеленными - увеличиваются. В качестве примера рассмотрим строение молекул аммиака и воды (рис. 12). При образовании молекулы аммиака атом азота подвергается sp3-гибридизации; на четырех гибридных орбиталях распределяются пять электронов, что приводит к появлению неподеленной электронной пары; соответственно молекула аммиака имеет форму тригональной пирамиды (рис. 12,а). Валентный угол, отвечающий sp3-гибридизации, равен 109,5, однако наличие неподеленной электронной пары приводит к его сжатию до 107,3.
Образование молекул воды также сопровождается sp3-гибридизацией; две из четырех гибридных орбиталей заполняют неподленные пары, а остальные используются на образование связей О-Н по обменному механизму. В результате молекула воды имеет угловую форму, а валентный угол сжимается до 104,5.

Рис. 12 Строение молекул NH3(а) и H2O(б)
По мере того как в результате сжатия угол между гибридными орбиталями, занятыми несвязывающими электронными парами, приближается к 90, т.е. к углу между "чистыми" р-орбиталями, форма гибридных орбиталей меняется, приближаясь к форме р-орбиталей. Одновременно гибридная орбиталь, занятая неподеленной парой, приобретает форму s-орбитали. Гибридизация, при которой форма гибридных орбиталей перестает быть идентичной, называется неполной гибридизацией. Изменение формы орбиталей существенно влияет на свойства образующихся связей. Так в молекуле фосфина РН3 валентный угол НРН равен 93,5, в результате чего орбиталь, занятая неподеленной парой, имеет сильно выраженный s-характер, а орбитали, занятые связывающими парами - р-характер. В результате фосфор в молекуле фосфина значительно слабее проявляет донорные свойства, чем азот в молекуле аммиака.
Когда центральный атом в молекуле использует неподеленную пару для образования связи по донорно-акцепторному механизму, сжатие валентного угла исчезает, если неподеленная пара одна, или уменьшается, если неподеленных пар несколько. Так, присоединение аммиаком иона водорода приводит к образованию тетраэдрического иона NH4+, все валентные углы в котором равны 109,5. Ион гидроксония, образующийся при присоединении иона водорода к молекуле воды, имеет форму тригональной пирамиды, для которой валентные углы НОН равны 109,0.
При образовании молекул может наблюдаться и расширение валентных углов. Это явление имеет место тогда, когда на одной из гибридных орбиталей молекулярной частицы остается неспаренный электрон. Например, атом азота в молекуле NO2, подвергается sp2-гибридизации, две гибридные орбитали используются на образование связей с атомами кислорода, а на третьей сохраняется неспаренный электрон, который слабее отталкивает связывающие электронные пары, чем неподеленная пара. В результате валентный угол в молекуле диоксида азота составляет 131, а не 120.
Гибридизация электронных орбиталей существенно повышает прочность связи. По данным Л.Полинга относительная прочность связей, образованных за счет различных "чистых" и гибридных орбиталей, характеризуется следующими значениями:
Тип орбитали |
s |
p |
sp |
sp2 |
sp3 |
Относительная прочность связи |
1,00 |
1,73 |
1,93 |
1,99 |
2,00 |
В то же время тип гибридизации слабо влияет на прочность образующихся связей.
