
- •08.05.2001 Р., протокол № 4
- •XiMiKo-технологiчного унiверситету, м.Днiпропетровськ;
- •1.1. Прогностическая ценность и теоретическая достаточность
- •Глава 1. Новые подходы к идентификации каменноугольной смолы как физико-химической системы
- •1.1.1. Природа взаимодействия компонентов каменноугольной смолы. Фенолы, пиридиновые основания, ароматические углеводороды
- •Глава 1. Новые подходы к идентификации каменноугольной смолы как физико-химической системы
- •Глава 1. Новые подходы к идентификации каменноугольной смолы как физико-химической системы
- •Глава I. Новые подходы к идентификации каменноугольной смолы как физико-химической системы
- •Глава I. Новые подходы к идентификации каменноугольной смолы как физико-химической системы
- •Глава I. Новые подходы к идентификации каменноугольной смолы как физико-химической системы
- •Глава 1. Новые подходы к идентификации каменноугольной смолы как физико-химической системы
- •Глава 1. Новые подходы к идентификации каменноугольной смолы как физико-химической системы
- •Глава I. Новые подходы к идентификации каменноугольной смолы как физико-химической системы
- •Глава 1. Новые подходы к идентификации каменноугольной смолы как физико-химической системы
- •Глава 1. Новые подходы к идентификации каменноугольной смолы как физико-химической системы
- •Глава 1. Новые подходы к идентификации каменноугольной смолы как физико-химической системы
- •Глава 1. Новые подходы к идентификации каменноугольной смолы как физико-химической системы
- •1.3. Теоретико-информационный подход к исследованию
- •Глава1. Новые подходы к идентификации каменноугольной смолы как физико-химической системы
- •Глава 1. Новые подходы к идентификации каменноугольной смолы как физико- химической системы
- •Глава 1. Новые подходы к идентификации каменноугольной смолы как физико-химической системы
- •Глава 1. Новые подходы к идентификации каменноугольной смолы как физико-химической системы
- •Глава I. Новые подходы к идентификации каменноугольной смолы как физико-химической системы
- •Глава I. Новые подходы к идентификации каменноугольной смолы как физико-химической системы
- •Глава 1. Новые подходы к идентификации каменноугольной смолы как физико-химической системы
- •ГлаваI. Новые подходы к идентификации каменноугольной смолы как физико-химической системы
- •Глава I. Новые подходы к идентификации каменноугольной смолы кик физико-химической системы
- •Глава 2. Фракционирование каменноугольной смолы. Теоретические и технологические аспекты
- •Глава 2
- •Глава 2. Фракционирование каменноугольной смолы. Теоретические и технологические аспекты
- •Глава 2. Фракционирование каменноугольной смолы. Теоретические и технологические аспекты
- •Глава 2. Фракционирование каменноугольной смолы. Теоретические и технологические аспекты
- •Глава 2. Фракционирование каменноугольной смолы. Теоретические и технологические аспекты
- •Глава 2. Фракционирование каменноугольной смолы. Теоретические и технологические аспекты
- •Глава 2. Фракционирование каменноугольной смолы. Теоретические и технологические аспекты
- •I сборник смолы; 2,5,7-трубчатая печь; 3-испаритель I ступени; 4 -
- •I , ректификационные колонны; 8- узел ввода дополнительного тепла в
- •Глава 2. Фракционирование каменноугольной смолы. Теоретические и технологические аспекты
- •Глава 2. Фракционирование каменноугольной смолы. Теоретические и технологические аспекты
- •Глава 2. Фракционирование каменноугольной смолы. Теоретические и технологические аспекты
- •Глава 2. Фракционирование каменноугольной смолы. Теоретические и технологические аспекты
- •Глава 3
- •Высококипящие фракции каменноугольной
- •Смолы как сырьевая база для получения
- •Полициклических ароматических соединений
- •3.1. Поглотительная фракция
- •Глава 3. Высококипящие фракции каменноугольной смолы как сырьевая база для получения полициклических ароматических соединений
- •Глава 3. Высококипящие фракции каменноугольной смолы как сырьевая база для получения полициклических ароматических соединений
- •3.1.3. Взаимосвязь температуры кристаллизации каменноугольного поглотительного масла с его компонентным составом
- •Глава 3. Высококипящие фракции каменноугольной смолы как сырьевая база для получения полициклических ароматических соединений
- •Глава 3. Высококипящие фракции каменноугольной смолы как сырьевая база для получения полициклических ароматических соединений
- •Глава 3. Высококипящие фракции каменноугольной смолы как сырьевая база для получения полициклических ароматических соединений
- •Глава 3. Высококипящие фракции каменноугольной смолы как сырьевая база для получения полициклических ароматических соединений
- •Глава 3. Высококипящие фракции каменноугольной смолы как сырьевая база для получения полициклических ароматических соединений
- •Глава 3. Высококипящие фракции каменноугольной смолы как сырьевая база для получения полициклических ароматических соединений
- •3.2. Антраценовая фракция
- •3.2.1. Получение сырого антрацена
- •Глава 3. Высококипящие фракции каменноугольной смолы как сырьевая база для получения полициклических ароматических соединений
- •Глава 3. Высококипящие фракции каменноугольной смолы как сырьевая база для
- •Глава 3. Высококипящие фракции каменноугольной смолы как сырьевая база для получения полициклических ароматических соединений
- •Глава 3. Высококипящие фракции каменноугольной смолы как сырьевая база для получения полициклических ароматических соединений
- •Глава 3. Высококипящие фракции камеяноугольной смолы как сырьевая база для получения полициклических ароматических соединений
- •3.3.I. Методы выделения и аналитический контроль высококонденси-рованных ароматических углеводородов с получением индивидуальных соединений высокой степени чистоты
- •Глава 3. Высококипящие фракции каменноугольной смолы как сырьевая база для получения полициклических ароматических соединений
- •Глава 3. Высококипящие фракции каменноугольной смолы как сырьевая база для получения полициклических ароматических соединений
- •Глава 3. Высококипящие фракции каменноугольной смолы как сырьевая база для получения полициклических ароматических соединений
- •Глава 3. Высококипящие фракции каменноугольной смолы как сырьевая база для получения полициклических ароматических соединений
- •Глава 4
- •Глава 4. Переработка высококипящих фракций с получением индивидуальных полициклических углеводородов
- •Глава 4. Переработка высококипящих фракций с получением индивидуальных полициклических углеводородов
- •Глава 4. Переработка высококипящих фракций с получением индивидуальных полициклических углеводородов
- •Глава 4. Переработка высококипящих фракций с получением индивидуальных полициклических углеводородов
- •Глава 4. Переработка высококипящих фракций с получением индивидуальных полициклических углеводородов
- •Глава 4. Переработка высококипящих фракций с получением индивидуальных полициклических углеводородов
- •Глава 4. Переработка высококипящих фракций с получением индивидуальных полициклических углеводородов
- •Глава 4. Переработка высококипящих фракций с получением индивидуальных полициклических углеводородов
- •Глава 4. Переработка высококипящих фракций с получением индивидуальных полициклических углеводородов
- •Глава 4. Переработка высококипящих фракций с получением индивидуальных полициклических углеводородов
- •Глава 4. Переработка высококипящих фракций с получением индивидуальных полициклических углеводородов
- •Глава 4. Переработка высококипящих фракций с получением индивидуальных полициклических углеводородов
- •Глава 4. Переработка высококипящих фракций с получением индивидуальных полициклических углеводородов
- •Глава 4. Переработка высококипящих фракций с получением индивидуальных полициклических углеводородов
- •Глава 4. Переработка высококипящих фракций с получением индивидуальных полициклических углеводородов
- •Глава 4. Переработка высококипящих фракций с получением индивидуальных полициклических углеводородов
- •Глава 4. Переработка высококипящих фракций с получением индивидуальных полициклических углеводородов
- •Глава 4. Переработка высококипящих фракций с получением индивидуальных полициклических углеводородов
- •Глава 4. Переработка высококипящих фракций с получением индивидуальных полициклических углеводородов
- •Глава 4. Переработка высококипящих фракций с получением индивидуальных полициклических углеводородов
- •4.3.2. Исследование режима ректификации исходного сырья для получения обогащенных фракций
- •Глава 4. Переработка высококипящих фракций с получением индивидуальных полициклических углеводородов
- •Глава 4. Переработка высококипящих фракций с получением индивидуальных полициклических углеводородов
- •Глава 4. Переработка высококипящих фракций с получением индивидуальных полициклических углеводородов
- •Глава 4. Переработка высококипящих фракций с получением индивидуальных полициклических углеводородов
- •Глава 4. Переработка высококипящих фракций с получением индивидуальных полициклических углеводородов
- •Глава 4. Переработка высококипящих фракций с получением индивидуальных полициклических углеводородов
- •Глава 4. Переработка высококипящих фракций с получением индивидуальных полициклических углеводородов
- •Глава 4. Переработка высококипящих фракций с получением индивидуальных полициклических углеводородов
- •Глава 4. Переработка высококипящих фракций с получением индивидуальных полициклических углеводородов
- •Глава 4. Переработка высококипящих фракций с получением индивидуальных полициклических углеводородов
- •Глава 4. Переработка высококипящих фракций с получением индивидуальных полициклических углеводородов
- •Глава 4. Переработка высококипящих фракций с получением индивидуальных полициклических углеводородов
- •Глава 4. Переработка высококипящих фракций с получением индивидуальных полициклических углеводородов
- •Глава 4. Переработка высококипящих фракций с получением индивидуальных полициклических углеводородов
- •4.3.6. Технологическая схема комплексной переработки
- •Глава 4. Переработка высококипящих фракций с получением индивидуальных полициклических углеводородов
- •Глава 4. Переработка высококипящих фракций с получением индивидуальных полициклических углеводородов
- •Глава 4. Переработка высококипящих фракций с получением индивидуальных полициклических углеводородов
- •Глава 4. Переработка высококипящих фракций с получением индивидуальных полициклических углеводородов
- •Глава 4. Переработка высококипящих фракций с получением индивидуальных полициклических углеводородов
- •Глава 4. Переработка высококипящих фракций с получением индивидуальных полициклических углеводородов
- •4.3.7. Исследование состава и свойств промежуточных продуктов
- •Глава 4. Переработка высококипящих фракций с получением индивидуальных полициклических углеводородов
- •Глава 4. Переработка высококипящих фракций с получением индивидуальных полициклических углеводородов
- •Глава 4. Переработка высококипящих фракций с получением индивидуальных полициклических углеводородов
- •Глава 4. Переработка высококипящих фракций с получением индивидуальных полициклических углеводородов
- •Заключение
Глава I. Новые подходы к идентификации каменноугольной смолы как физико-химической системы
Полученные автором экспериментальные данные [13] подтвердили наличие связи между прочностью Н-комплексов пиридиновых оснований и фенолов и значениями рКа (П.0). На рис. 1.4 приведены ИК-спектры смесей некоторых пиридиновых оснований и фенола в СС14.
Наличие широкой полосы валентных колебаний ОН-группы фенола в области v = 3150-3100 см-1 и ряда побочных полос при v = 2950, 2860, 1730 и 3600-2700 см"1 доказывает образование комплексов с водородной связью [16].
Р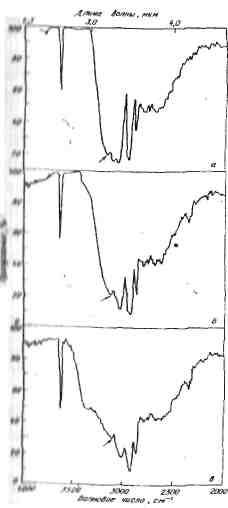 ис.
1.4 ИК-спектры смесей фенола с пиридиновыми
основаниями в CCL4
(стрелкой
показано положение полосы поглощения
3150-3100 см-1
, принадлежащей соединению фенол - ПО):
ис.
1.4 ИК-спектры смесей фенола с пиридиновыми
основаниями в CCL4
(стрелкой
показано положение полосы поглощения
3150-3100 см-1
, принадлежащей соединению фенол - ПО):
а - пиридин; б - 2,5-лутидин; в - 2, 4, 6-коллидин (концентрация фенола 2 %, пиридинового основания 1 %, толщина кюветы 0,424 мм)
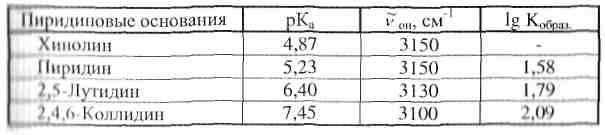
В табл. 1.4 приведены значения максимума частоты валентных колебаний группы ОН (^ОН) в Н-комплексах фенола с пиридиновыми основаниями и показателя константы кислотной диссоциации (рКа) соответствующих оснований [36, 37].
Таблица 1.4
Максимумы валентных колебаний группы ОН в Н-комплексах фенолов
-16-
-17-
Е. Т. КОВАЛЕВ. Научные основы и технология переработки высококипящих фракций каменноугольной смолы с получением полициклических углеводородов
Для удобства обсуждения эта зависимость представлена графически (рис. 1.5). Как видно, она имеет линейный характер: чем выше рКа, т.е. чем выше основность пиридиновых оснований, тем меньше значение v0h, т.е. тем больше сдвиг полосы валентных колебаний ОН-группы фенола в коротковолновую область и тем прочнее водородная связь.
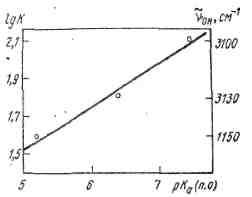
Рис. 1.5 Зависимость положения максимума частоты валентных колебаний группы ОН и константы образования Н-комплексов фенола с пиридиновыми основаниями от показателя константы кислотной диссоциации пиридиновых оснований
С использованием метода однотипных реакций [38] и полученных ИК-спектров автором была рассчитана энтальпия образования водородной связи и константы образования комплексов некоторых пиридиновых оснований с фенолом. Исходя из значений энтальпии образования (ДН2=-28,6 кДж/моль) и константы образования Н-комплекса фенол-пиридин (К2= 38 л/моль) [34], по формуле
![]() (1.51
(1.51
были получены значения lg К (см. табл. 1.4). Значения энтальпий ΔH1 образования комплекса фенолов с другими пиридиновыми основаниями (2,5-лутидином и 2,4,6-коллидином), необходимые для расчета К, были найдены из спектральных данных по формуле, приведенной в [30]:
![]() (1.6)
(1.6)
где:![]()
Как уже отмечалось, зависимость lg К от рКа(п.о.) (рис. 1.5) имеет ли нейный характер и демонстрирует увеличение прочности Н-комплексов ростом основности пиридиновых оснований. Была предпринята попытка проанализировать имеющиеся данные о составе азеотропов пиридиновых оснований с фенолами для выявления корреляций между составом азеот-ропов и величинами рК и АрК. На рис. 1.6 и 1.7 представлены некоторые из обнаруженных зависимостей [13].
