
- •Глава 1 введение
- •1.2 Основные сырьевые источники органических соединений
- •1.3 Классификация органических соединений
- •1.4 Номенклатура органических соединений
- •1.4.1 Тривиальная номенклатура
- •1.4.2 Рациональная номенклатура
- •1.4.3 Номенклатура июпак
- •1.4.3.1. Номенклатура июпак для алифатических углеводородов.
- •Глава 2 теоретические представления в органической химии
- •2.1 Типы химических связей
- •2.2 Образование ковалентных связей атомами углерода (σ- и π-ковалентные связи)
- •2.3 Общие представления о механизмах химических реакций
- •2.3.1 Свободнорадикальные реакции
- •2.3.2 Ионные реакции
- •2.4 Пространственное расположение атомов в молекуле. Конформация молекул
- •Глава 3 алифатические углеводороды алканы,алкены, алкины и алкадиены
- •3.1 Алканы: определениек,изомерия и номенклатура
- •3.1.2 Способы получения алканов
- •3.1.3 Химические свойства
- •Радикальное галогенирование
- •Нитрование
- •Сульфирование, сульфоокисление, сульфохлорирование
- •Окисление
- •Крекинг углеводородов при высоких температурах
- •Задачи для самопроверки
- •3.2 Алкены: определение, изомерия, номенклатура
- •3.2.1 Способы получения
- •3.2.2 Химические свойства
- •3.3. Алкадиены: определение, изомерия, номенклатура
- •3.3.1 Способы получения важнейших диенов
- •3.3.2 Химические особенности 1,3-алкадиенов
- •3.4. Алкины: определение, изомерия, номенклатура
- •3.4.1. Способы получения.
- •3.4.2. Химические свойства
- •Глава 4 карбоциклические соединения
- •4.1. Алициклический ряд: определение, изомерия, номенклатура
- •4.1.1 Способы получения
- •4.1.2. Химические свойства
- •4.1.3. Современные представления о строении моноциклоалканов.
- •4.2. Ароматические углеводороды
- •4.2.1. Строение бензола
- •4.2.2. Способы получения
- •4.2.3. Химические свойства
- •4.3.4. Правила ориентации в бензольном кольце
- •4.2.5. Механизм ориентирующего влияния заместителей
- •4.3. Многоядерные ароматические соединения с неконденсированными и конденсированными бензольными ядрами
- •4.3.1. Основные способы получения
- •4.3.2. Химические особенности
- •Функциональные производные углеводородов
- •Глава 5 галогенопроизводные
- •5.1. Галогенопроизводные: определение, изомерия, номенклатура
- •5.2. Способы получения
- •5..3 Химические свойства
- •Глава 6 кислородсодержащие органические соединения
- •6.1. Спирты: определение, изомерия, номенклатура
- •6.1.1. Способы получения
- •6.1.2 Физические свойства спиртов
- •6.1.3. Химические свойства
- •6.1.4 Понятие о непредельных и многоатомных спиртах
- •6.2. Фенолы: определение, изомерия, номенклатура
- •16.2.1. Способы получения
- •6.2.2. Химические свойства
- •6.3. Простые эфиры: определение, изомерия, номенклатура
- •6.3.1. Способы получения
- •6.3.2. Химические свойства
- •6.3.3. Окись этилена (эпоксисоединения)
- •6.4. Оксосоединения (альдегиды и кетоны)
- •6.4.1. Определение, изомерия и номенклатура оксосоединений
- •6.4.2. Способы получения
- •6.4.3. Химические свойства
- •6.4.4. Понятие о непредельных альдегидах и кетонах
- •6.4.5. Особенности получения и химические свойства хинонов
- •Задачи для самопроверки
- •6.5. Одно и многоосновные карбоновые кислоты и их производные: определение, изомерия, номенклатура
- •6.5.1. Способы получения
- •6.5.2. Химические свойства
- •6.5.3. Особенности предельных и непредельных кислот
- •Задачи для самопроверки
- •Глава 7. Серосодержащие соединения
- •7.1. Органические соединения двухвалентной серы (Тиолы, сульфиды, дисульфиды)
- •7.2. Сульфиновые кислоты и их производные
- •7.3. Сульфоновые кислоты и их производные. Сульфоны.
- •Глава 8. Азотсодержащие органические соединения
- •8.1 Нитросоединения: определение, изомерия, номенклатура.
- •8.1.1. Способы получения
- •8.1.2. Химические свойства
- •Задачи для самопроверки
- •8.2 Амины: определение, изомерия, номенклатура
- •8.2.1 Способы получения
- •8.2.2. Химические свойства
- •8.2.3. Понятие о диаминах
- •Задачи для самопроверки
- •8.3. Диазо- и азосоединения: определение, изомерия, номенклатура
- •8.3.1. Способы получения
- •8.3.2 Физические и химические свойства
- •II. Реакции без выделения азота
- •Задачи для самопроверки
- •Глава 9 . Гетерофункциональные соединеия
- •9.1. Гидроксикислоты: определение, изомерия, номенклатура
- •9.1.1. Способы получения
- •9.1.2. Химические свойства
- •9.1.3. Оптическая изомерия гидроксикислот
- •9.1.4. Ароматические гидроксикислоты и их производные
- •Задачи для самопроверки
- •9.2. Альдегидо- и кетокислоты: определение, изомерия, номенклатура
- •9.2.1. Способы получения
- •9.2.2. Химические особенности
- •9.2.3. Применение ацетоуксусного эфира в органическом синтезе
- •Задачи для самопроверки
- •9.3. Аминокислоты: определение, изомерия, номенклатура
- •9.3.1. Способы получения
- •9.3.2. Химические свойства
- •Задачи для самопроверки
- •Глава 10. Гетероциклические соединения
- •10.1. Определение и классификация гетероциклических соединений.
- •10.2. Пятичленные гетероциклические соединения: изомерия, номенклатура, ароматический характер.
- •10.2.1. Способы получения пятичленных гетероциклических соединений.
- •10.2.3. Химические свойства
- •10.3. Понятие о конденсированных гетероциклах (индол)
- •10.4. Шестичленные гетероциклические соединения: изомерия, номенклатура
- •10.4.1. Химические свойства.
- •Глава 11. Липиды
- •11.1.Определение, классификация изомерия, номенклатура
- •11.2. Простые липиды. (Жиры, масла)
- •10.3. Сложные липиды. Понятие о фосфолипидах.
- •10.4. Понятие о циклических липидах
- •Глава 12. Углеводы
- •12.1. Определение, классификация, изомерия, номенклатура.
- •12.2. Моносахариды: строение, оптическая изомерия.
- •12.3.Химические свойства моносахаридов.
- •12.4. Олигосахариды: особенности строения, химические свойства
- •12.5. Несахароподобные полисахариды: крахмал, гликоген, клетчатка.
- •Глава 13. Пептиды и белки
- •13.1. Протеиногенные аминокислоты
- •13.2. Понятие о строении пептидов.
- •13.3. Особенности строения белков
- •Глава 14. Нуклеиновые кислоты
- •14.1. Понятие о составе и строении нуклеиновых кислот
- •14.2. Классификация и биологическая роль нуклеиновых кислот
2.4 Пространственное расположение атомов в молекуле. Конформация молекул
Ковалентные связи в отличие от ионных имеют строго определенную локализацию в пространстве, отвечающую симметрии атомных орбиталей, участвующих в связях. Каждая атомная орбиталь характеризуется определенной энергией и симметрией (формой орбитали).
Ковалентная связь, кроме направленности, обладает еще свойством насыщаемости. При образовании σ-связи достигается почти полное насыщение валентности, тогда как π-связь имеет остаточное химическое сродство ( индекс свободной валентности ИСВ).
При образовании π-связи образуются две области высокой электронной плотности, которые будут изменяться при повороте одного атома относительно другого. π-Связь запрещает свободное вращение.
Углеродная σ-связь в принципе допускает свободное вращение окружающих ее атомных группировок, так как при таком вращении не происходит изменения площади перекрывания орбиталей взаимодействующих атомов, т.е. не меняется энергия связи.
Конформации – очень неустойчивые динамические формы одной и той же молекулы, которые возникают в результате внутреннего вращения атомных группировок, относительно друг друга и самопроизвольно превращаются друг в друга.
Отдельные состояния, через которые проходят эти группировки в процессе свободного вращения получили названия конформаций.
Однако конформации, возникающие в процессе свободного вращения вокруг простой связи как оси вращения, имеют неодинаковую устойчивость. Некоторые из них оказываются более энергетически выгодными.
Например, для газообразного этана, среди бесконечного количества других, возможны две крайние формы: заторможенная (*более выгодная) и заслоненная (**менее выгодная). Однако переход заторможенной формы в заслоненную требует около 12,6 кДж/моль энергии.
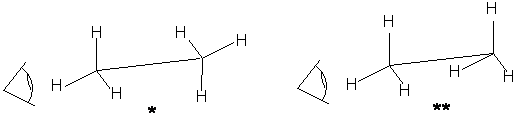
Конформации удобно изображать проекциями Ньюмена

ВОПРОСЫ И ЗАДАЧИ ДЛЯ САМОПРОВЕРКИ
1.Определить число sp3-гибридных орбиталей в молекуле пропана.
2. Сколько неспаренных электронов в радикале втор-бутиле?
3. Определить число σ-связей в молекуле 2,2,3,3-тетраметилбутана.
4. Определить число σ-и π-связей в молекуле 2,2-диметил-3-этил-3-гексена
5. Определить число σ-и π-связей в молекуле 3,6-диметил-1-гептен-4-ина
6. Определить число sp2-гибридных орбиталей в молекуле 3,6-диметил-1-гептен-4-ина.
Глава 3 алифатические углеводороды алканы,алкены, алкины и алкадиены
Предельными углеводородами (алканами) называются соединения, состоящие из атомов углерода и водорода, соединенных между собой только σ-связями. В алканах атомы углерода находятся в состоянии sp3-гибридизации.
3.1 Алканы: определениек,изомерия и номенклатура
Для предельных углеводородов характерна структурная изомерия. Изомеры этого типа отличаются друг от друга порядком связей между отдельными атомами в молекуле (структурой углеродной цепи).
Как ранее отмечалось, первые четыре члена гомологического ряда предельных углеводородов сохранили тривиальные названия: метан, этан, пропан, бутан. По рациональной номенклатуре алканы называют как производные метана. При выборе основы используют или самый разветвленный атом углерода, или тот, вокруг которого стоят наиболее простые радикалы. По номенклатуре ИЮПАК названия предельных углеводородов характеризуются суффиксом «ан».
 триметилизобутилметан
трет-бутилнеопентилметан
триметилизобутилметан
трет-бутилнеопентилметан
2,2,4-триметилпентан 2,2,5,5-тетраметилгексан
