
- •Глава 1 введение
- •1.2 Основные сырьевые источники органических соединений
- •1.3 Классификация органических соединений
- •1.4 Номенклатура органических соединений
- •1.4.1 Тривиальная номенклатура
- •1.4.2 Рациональная номенклатура
- •1.4.3 Номенклатура июпак
- •1.4.3.1. Номенклатура июпак для алифатических углеводородов.
- •Глава 2 теоретические представления в органической химии
- •2.1 Типы химических связей
- •2.2 Образование ковалентных связей атомами углерода (σ- и π-ковалентные связи)
- •2.3 Общие представления о механизмах химических реакций
- •2.3.1 Свободнорадикальные реакции
- •2.3.2 Ионные реакции
- •2.4 Пространственное расположение атомов в молекуле. Конформация молекул
- •Глава 3 алифатические углеводороды алканы,алкены, алкины и алкадиены
- •3.1 Алканы: определениек,изомерия и номенклатура
- •3.1.2 Способы получения алканов
- •3.1.3 Химические свойства
- •Радикальное галогенирование
- •Нитрование
- •Сульфирование, сульфоокисление, сульфохлорирование
- •Окисление
- •Крекинг углеводородов при высоких температурах
- •Задачи для самопроверки
- •3.2 Алкены: определение, изомерия, номенклатура
- •3.2.1 Способы получения
- •3.2.2 Химические свойства
- •3.3. Алкадиены: определение, изомерия, номенклатура
- •3.3.1 Способы получения важнейших диенов
- •3.3.2 Химические особенности 1,3-алкадиенов
- •3.4. Алкины: определение, изомерия, номенклатура
- •3.4.1. Способы получения.
- •3.4.2. Химические свойства
- •Глава 4 карбоциклические соединения
- •4.1. Алициклический ряд: определение, изомерия, номенклатура
- •4.1.1 Способы получения
- •4.1.2. Химические свойства
- •4.1.3. Современные представления о строении моноциклоалканов.
- •4.2. Ароматические углеводороды
- •4.2.1. Строение бензола
- •4.2.2. Способы получения
- •4.2.3. Химические свойства
- •4.3.4. Правила ориентации в бензольном кольце
- •4.2.5. Механизм ориентирующего влияния заместителей
- •4.3. Многоядерные ароматические соединения с неконденсированными и конденсированными бензольными ядрами
- •4.3.1. Основные способы получения
- •4.3.2. Химические особенности
- •Функциональные производные углеводородов
- •Глава 5 галогенопроизводные
- •5.1. Галогенопроизводные: определение, изомерия, номенклатура
- •5.2. Способы получения
- •5..3 Химические свойства
- •Глава 6 кислородсодержащие органические соединения
- •6.1. Спирты: определение, изомерия, номенклатура
- •6.1.1. Способы получения
- •6.1.2 Физические свойства спиртов
- •6.1.3. Химические свойства
- •6.1.4 Понятие о непредельных и многоатомных спиртах
- •6.2. Фенолы: определение, изомерия, номенклатура
- •16.2.1. Способы получения
- •6.2.2. Химические свойства
- •6.3. Простые эфиры: определение, изомерия, номенклатура
- •6.3.1. Способы получения
- •6.3.2. Химические свойства
- •6.3.3. Окись этилена (эпоксисоединения)
- •6.4. Оксосоединения (альдегиды и кетоны)
- •6.4.1. Определение, изомерия и номенклатура оксосоединений
- •6.4.2. Способы получения
- •6.4.3. Химические свойства
- •6.4.4. Понятие о непредельных альдегидах и кетонах
- •6.4.5. Особенности получения и химические свойства хинонов
- •Задачи для самопроверки
- •6.5. Одно и многоосновные карбоновые кислоты и их производные: определение, изомерия, номенклатура
- •6.5.1. Способы получения
- •6.5.2. Химические свойства
- •6.5.3. Особенности предельных и непредельных кислот
- •Задачи для самопроверки
- •Глава 7. Серосодержащие соединения
- •7.1. Органические соединения двухвалентной серы (Тиолы, сульфиды, дисульфиды)
- •7.2. Сульфиновые кислоты и их производные
- •7.3. Сульфоновые кислоты и их производные. Сульфоны.
- •Глава 8. Азотсодержащие органические соединения
- •8.1 Нитросоединения: определение, изомерия, номенклатура.
- •8.1.1. Способы получения
- •8.1.2. Химические свойства
- •Задачи для самопроверки
- •8.2 Амины: определение, изомерия, номенклатура
- •8.2.1 Способы получения
- •8.2.2. Химические свойства
- •8.2.3. Понятие о диаминах
- •Задачи для самопроверки
- •8.3. Диазо- и азосоединения: определение, изомерия, номенклатура
- •8.3.1. Способы получения
- •8.3.2 Физические и химические свойства
- •II. Реакции без выделения азота
- •Задачи для самопроверки
- •Глава 9 . Гетерофункциональные соединеия
- •9.1. Гидроксикислоты: определение, изомерия, номенклатура
- •9.1.1. Способы получения
- •9.1.2. Химические свойства
- •9.1.3. Оптическая изомерия гидроксикислот
- •9.1.4. Ароматические гидроксикислоты и их производные
- •Задачи для самопроверки
- •9.2. Альдегидо- и кетокислоты: определение, изомерия, номенклатура
- •9.2.1. Способы получения
- •9.2.2. Химические особенности
- •9.2.3. Применение ацетоуксусного эфира в органическом синтезе
- •Задачи для самопроверки
- •9.3. Аминокислоты: определение, изомерия, номенклатура
- •9.3.1. Способы получения
- •9.3.2. Химические свойства
- •Задачи для самопроверки
- •Глава 10. Гетероциклические соединения
- •10.1. Определение и классификация гетероциклических соединений.
- •10.2. Пятичленные гетероциклические соединения: изомерия, номенклатура, ароматический характер.
- •10.2.1. Способы получения пятичленных гетероциклических соединений.
- •10.2.3. Химические свойства
- •10.3. Понятие о конденсированных гетероциклах (индол)
- •10.4. Шестичленные гетероциклические соединения: изомерия, номенклатура
- •10.4.1. Химические свойства.
- •Глава 11. Липиды
- •11.1.Определение, классификация изомерия, номенклатура
- •11.2. Простые липиды. (Жиры, масла)
- •10.3. Сложные липиды. Понятие о фосфолипидах.
- •10.4. Понятие о циклических липидах
- •Глава 12. Углеводы
- •12.1. Определение, классификация, изомерия, номенклатура.
- •12.2. Моносахариды: строение, оптическая изомерия.
- •12.3.Химические свойства моносахаридов.
- •12.4. Олигосахариды: особенности строения, химические свойства
- •12.5. Несахароподобные полисахариды: крахмал, гликоген, клетчатка.
- •Глава 13. Пептиды и белки
- •13.1. Протеиногенные аминокислоты
- •13.2. Понятие о строении пептидов.
- •13.3. Особенности строения белков
- •Глава 14. Нуклеиновые кислоты
- •14.1. Понятие о составе и строении нуклеиновых кислот
- •14.2. Классификация и биологическая роль нуклеиновых кислот
6.5.1. Способы получения
1. Окисление органических соединений (углеводородов, спиртов, альдегидов, кетонов):

2. Гидролиз нитрилов
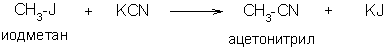

3. Действие двуокиси углерода на металлорганические соединения:

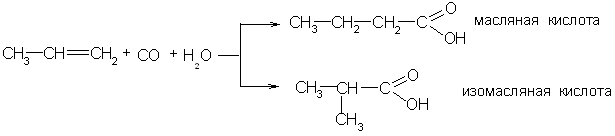
4. Оксосинтез. Взаимодействие олефинов с оксидом углерода (II) и водяным паром в присутствии катализаторов (тетракарбонил никеля, фосфорной кислоты и др.) при температуре 300–4000С и давлении 2–5∙107 Па дает смесь кислот нормального и изостроения:
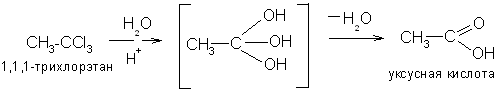
5. Гидролиз тригалогенопроизводных, содержащих галоген у одного углеродного атома:
6. Ароматические кислоты могут быть получены окислением гомологов бензола:

7. Кроме того, ароматические карбоновые кислоты могут быть получены:
а) сплавлением ароматических сульфатов с формиатами и цианидами

б) реакцией ароматических соединений с галогенопроизводными угольной кислоты:

Физические свойства
В зависимости от строения карбоновые кислоты являются жидкостями или твердыми телами. Уменьшение длины углеродного скелета или появление дополнительной карбоксильной группы увеличивают растворимость кислоты в воде. На физические свойства кислот оказывают влияние ассоциация молекул вследствие образования водородных связей. Кислоты образуют более прочные водородные связи, чем спирты, так как связи О─Н в них в большей степени поляризованы. В твердом, жидком и даже в некоторой степени в парообразном состоянии карбоновые кислоты существуют в виде димеров:

Ароматические кислоты кипят при несколько более высоких и плавятся при значительно более высоких температурах, чем кислоты жирного ряда с тем же числом углеродных атомов. В водных растворах ароматические монокарбоновые кислоты обнаруживают большую степень диссоциации, чем кислоты жирного ряда: константа диссоциации бензойной кислоты 6,6∙10-5, уксусной кислоты 1,75∙10–5.
6.5.2. Химические свойства
Кислотный характер карбоновых кислот ярко выражен. Это объясняется взаимным влиянием атомов в карбоксильной группе: в ней электронная плотность смещена в сторону наиболее электроноакцепторного атома кислорода

Это ослабляет связь между кислородом и водородом и облегчает отделение иона водорода, т.е. диссоциацию кислоты.
![]()
Появление пониженной электронной плотности (δ+) на центральном углеродном атоме карбоксила приводит также к стягиванию σ–электронов соседней углерод-углеродной связи к карбоксильной группе и появлению пониженной электронной плотности (δ+) на α–углеродном атоме кислоты.
Сдвиг электронной плотности в молекуле недиссоциированной карбоновой кислоты понижает электронную плотность на гидроксильном атоме кислорода и повышает ее на карбонильном. Этот сдвиг еще больше увеличивается у аниона кислоты.

Результатом сдвига является полное выравнивание зарядов в анионе, названное мезомерией карбоксиланиона. Выравнивание электронной плотности приводит к выигрышу в энергии и для многих реакций является движущей силой, называемой энергией резонанса.
Наличие электрофильных заместителей в радикале, особенно в α–положении, кратных связей, или появление второй карбоксильной группы приводит к возрастанию кислого характера.
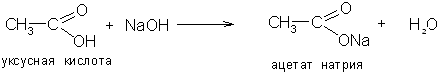
1. Карбоновые кислоты способны образовывать соли с металлами, их оксидами, гидроксидами, аммиаком:
2. Характерной реакцией карбоновых кислот является их способность образовывать со спиртами в присутствии минеральных кислот сложные эфиры – реакция этерификации:
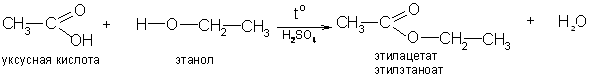
Роль катализатора в реакции этерификации играют ионы водорода. Механизм реакции этерификации описывается следующим образом:
а) кислород карбонильной группы кислоты, захватывая протон, образует карбкатион I:
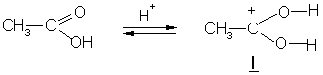
Карбкатион I присоединяет молекулу спирта за счет неподеленных электронных пар атома кислорода с образованием промежуточного тетраэдрического комплекса II, который способен обратимо распадаться с отщеплением воды и образованием нового карбокатиона сложного эфира III. При диссоциации последнего образуется сложный эфир, причем освобождается катализатор протон.

Большой интерес представляет вопрос кислота или спирт отщепляют гидроксил в реакциях этерификации.
С помощью «меченых атомов» (тяжелого изотопа кислорода 18О) было показано, что вода при этерификации образуется за счет водорода спирта и гидроксила кислоты:
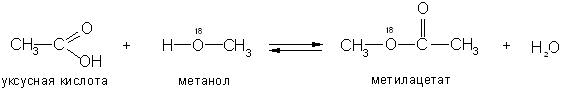
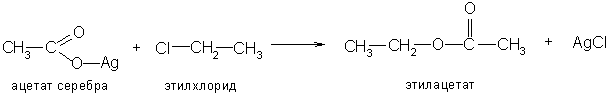
Сложные эфиры получают также взаимодействием галогенацилов со спиртами и алкоголятами и нагреванием солей карбоновых кислот с галогеналкилами и действием спиртов на ангидриды кислот:

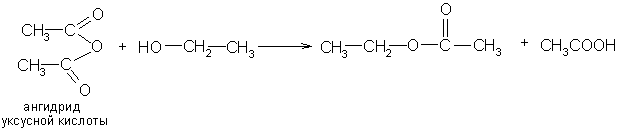
Сложные эфиры низших кислот и спиртов – жидкости с приятным запахом, в некоторых случаях напоминающих запах плодов. Например: изоамилацетат – грушевая эссенция.
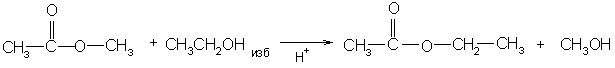
Для сложных эфиров характерны реакции гидролиза и переэтерификации:
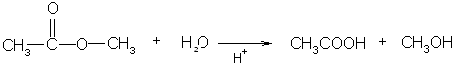
3. При действии галогенидов фосфора и серы на карбоновые кислоты образуются галогенангидриды кислот. При этом, как и в случае спиртов, гидроксил замещается галогеном:

Галогенангидриды кислот можно называть по кислоте и галогену, например бромангидрид масляной кислоты. Но чаще их называют по кислотному радикалу - ацилу. Перед названием ацила указывают галоген:
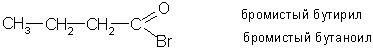
Низшие галогенангидриды – жидкости с весьма резким запахом, раздражающим слизистые оболочки.
При взаимодействии галагенангидридов с соединениями, содержащими атом металла или активный атом водорода, происходит замена его кислотным остатком – ацилом. Подобные реакции называются ацилированием и позволяют получить все производные кислот: ангидриды, кислоты, сложные эфиры, амиды, пероксиды и т.д.

Все эти реакции являются реакциями нуклеофильного замещения и идут в большинстве случаев по тетраэдрическому механизму.
4. При дегидратации кислот или при взаимодействии солей кислот с их галогенангидридами образуются ангидриды кислот:

Ангидриды низших кислот – легкоподвижные жидкости с острым запахом; в воде плохо растворимы или вовсе не растворимы. Кипят при более высокой температуре, чем соответствующие кислоты.
Ангидриды кислот обладают большой химической активностью и являются, как и галогенангидриды, хорошими ацилирующими агентами:

Большое значение имеет реакция получения фторангидрида.
5. При пропускании паров кислот вместе с аммиаком над дегидратирующими катализаторами получаются амиды кислот:

Амиды кислот получают также действием NH3 на галогенангидриды или ангидриды кислот или из аммонийных солей кислот:

Амиды кислот – кристаллические вещества (кроме жидкого амида муравьиной кислоты – формамида).
Амиды, за счет сопряжения свободной электронной пары азота с карбонильным кислородом, почти лишены основных свойств

Наиболее важным для амидов являются реакции:
а) гидролиза в кислой или щелочной среде
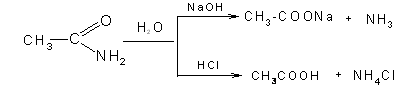
б) дегидратации в присутствии пентаоксида фосфора

О нитрилах кислот подробнее смотрите в главе «Азотсодержащие соединения».
6. Галогензамещенные кислоты могут быть получены при действии молекулярного хлора или брома на карбоновые кислоты. Наиболее легко α-галогензамещенные производные кислот образуются из ангидридов и галогенангидридов:

