
- •Глава 1 введение
- •1.2 Основные сырьевые источники органических соединений
- •1.3 Классификация органических соединений
- •1.4 Номенклатура органических соединений
- •1.4.1 Тривиальная номенклатура
- •1.4.2 Рациональная номенклатура
- •1.4.3 Номенклатура июпак
- •1.4.3.1. Номенклатура июпак для алифатических углеводородов.
- •Глава 2 теоретические представления в органической химии
- •2.1 Типы химических связей
- •2.2 Образование ковалентных связей атомами углерода (σ- и π-ковалентные связи)
- •2.3 Общие представления о механизмах химических реакций
- •2.3.1 Свободнорадикальные реакции
- •2.3.2 Ионные реакции
- •2.4 Пространственное расположение атомов в молекуле. Конформация молекул
- •Глава 3 алифатические углеводороды алканы,алкены, алкины и алкадиены
- •3.1 Алканы: определениек,изомерия и номенклатура
- •3.1.2 Способы получения алканов
- •3.1.3 Химические свойства
- •Радикальное галогенирование
- •Нитрование
- •Сульфирование, сульфоокисление, сульфохлорирование
- •Окисление
- •Крекинг углеводородов при высоких температурах
- •Задачи для самопроверки
- •3.2 Алкены: определение, изомерия, номенклатура
- •3.2.1 Способы получения
- •3.2.2 Химические свойства
- •3.3. Алкадиены: определение, изомерия, номенклатура
- •3.3.1 Способы получения важнейших диенов
- •3.3.2 Химические особенности 1,3-алкадиенов
- •3.4. Алкины: определение, изомерия, номенклатура
- •3.4.1. Способы получения.
- •3.4.2. Химические свойства
- •Глава 4 карбоциклические соединения
- •4.1. Алициклический ряд: определение, изомерия, номенклатура
- •4.1.1 Способы получения
- •4.1.2. Химические свойства
- •4.1.3. Современные представления о строении моноциклоалканов.
- •4.2. Ароматические углеводороды
- •4.2.1. Строение бензола
- •4.2.2. Способы получения
- •4.2.3. Химические свойства
- •4.3.4. Правила ориентации в бензольном кольце
- •4.2.5. Механизм ориентирующего влияния заместителей
- •4.3. Многоядерные ароматические соединения с неконденсированными и конденсированными бензольными ядрами
- •4.3.1. Основные способы получения
- •4.3.2. Химические особенности
- •Функциональные производные углеводородов
- •Глава 5 галогенопроизводные
- •5.1. Галогенопроизводные: определение, изомерия, номенклатура
- •5.2. Способы получения
- •5..3 Химические свойства
- •Глава 6 кислородсодержащие органические соединения
- •6.1. Спирты: определение, изомерия, номенклатура
- •6.1.1. Способы получения
- •6.1.2 Физические свойства спиртов
- •6.1.3. Химические свойства
- •6.1.4 Понятие о непредельных и многоатомных спиртах
- •6.2. Фенолы: определение, изомерия, номенклатура
- •16.2.1. Способы получения
- •6.2.2. Химические свойства
- •6.3. Простые эфиры: определение, изомерия, номенклатура
- •6.3.1. Способы получения
- •6.3.2. Химические свойства
- •6.3.3. Окись этилена (эпоксисоединения)
- •6.4. Оксосоединения (альдегиды и кетоны)
- •6.4.1. Определение, изомерия и номенклатура оксосоединений
- •6.4.2. Способы получения
- •6.4.3. Химические свойства
- •6.4.4. Понятие о непредельных альдегидах и кетонах
- •6.4.5. Особенности получения и химические свойства хинонов
- •Задачи для самопроверки
- •6.5. Одно и многоосновные карбоновые кислоты и их производные: определение, изомерия, номенклатура
- •6.5.1. Способы получения
- •6.5.2. Химические свойства
- •6.5.3. Особенности предельных и непредельных кислот
- •Задачи для самопроверки
- •Глава 7. Серосодержащие соединения
- •7.1. Органические соединения двухвалентной серы (Тиолы, сульфиды, дисульфиды)
- •7.2. Сульфиновые кислоты и их производные
- •7.3. Сульфоновые кислоты и их производные. Сульфоны.
- •Глава 8. Азотсодержащие органические соединения
- •8.1 Нитросоединения: определение, изомерия, номенклатура.
- •8.1.1. Способы получения
- •8.1.2. Химические свойства
- •Задачи для самопроверки
- •8.2 Амины: определение, изомерия, номенклатура
- •8.2.1 Способы получения
- •8.2.2. Химические свойства
- •8.2.3. Понятие о диаминах
- •Задачи для самопроверки
- •8.3. Диазо- и азосоединения: определение, изомерия, номенклатура
- •8.3.1. Способы получения
- •8.3.2 Физические и химические свойства
- •II. Реакции без выделения азота
- •Задачи для самопроверки
- •Глава 9 . Гетерофункциональные соединеия
- •9.1. Гидроксикислоты: определение, изомерия, номенклатура
- •9.1.1. Способы получения
- •9.1.2. Химические свойства
- •9.1.3. Оптическая изомерия гидроксикислот
- •9.1.4. Ароматические гидроксикислоты и их производные
- •Задачи для самопроверки
- •9.2. Альдегидо- и кетокислоты: определение, изомерия, номенклатура
- •9.2.1. Способы получения
- •9.2.2. Химические особенности
- •9.2.3. Применение ацетоуксусного эфира в органическом синтезе
- •Задачи для самопроверки
- •9.3. Аминокислоты: определение, изомерия, номенклатура
- •9.3.1. Способы получения
- •9.3.2. Химические свойства
- •Задачи для самопроверки
- •Глава 10. Гетероциклические соединения
- •10.1. Определение и классификация гетероциклических соединений.
- •10.2. Пятичленные гетероциклические соединения: изомерия, номенклатура, ароматический характер.
- •10.2.1. Способы получения пятичленных гетероциклических соединений.
- •10.2.3. Химические свойства
- •10.3. Понятие о конденсированных гетероциклах (индол)
- •10.4. Шестичленные гетероциклические соединения: изомерия, номенклатура
- •10.4.1. Химические свойства.
- •Глава 11. Липиды
- •11.1.Определение, классификация изомерия, номенклатура
- •11.2. Простые липиды. (Жиры, масла)
- •10.3. Сложные липиды. Понятие о фосфолипидах.
- •10.4. Понятие о циклических липидах
- •Глава 12. Углеводы
- •12.1. Определение, классификация, изомерия, номенклатура.
- •12.2. Моносахариды: строение, оптическая изомерия.
- •12.3.Химические свойства моносахаридов.
- •12.4. Олигосахариды: особенности строения, химические свойства
- •12.5. Несахароподобные полисахариды: крахмал, гликоген, клетчатка.
- •Глава 13. Пептиды и белки
- •13.1. Протеиногенные аминокислоты
- •13.2. Понятие о строении пептидов.
- •13.3. Особенности строения белков
- •Глава 14. Нуклеиновые кислоты
- •14.1. Понятие о составе и строении нуклеиновых кислот
- •14.2. Классификация и биологическая роль нуклеиновых кислот
Глава 2 теоретические представления в органической химии
2.1 Типы химических связей
Взаимное влияние непосредственно связанных между собой атомов зависит в первую очередь от их природы и характера связи между ними.
Различают два основных типа химической связи: ковалентную и электровалентную (ионную).
Электровалентная (ионная) связь образуется между атомами значительно отличающимися по электроотрицательности:
Nao + Clo → Na+Cl–
Эта связь не характерна для органических соединений.
Ковалентная связь возникает в результате обобщения неспаренных валентных электронов. Атомы с одинаковой или близкой по значению электроотрицательностью находясь на достаточно близком расстоянии перекрываются атомными орбиталями с образованием единой связывающей молекулярной орбитали на которой и располагаются оба электрона:
Н![]() + Н
→ Н
+ Н
→ Н![]() Н
Н
Разновидностью ковалентной связи является координационная (донорно-акцепторная) связь. При ее возникновении пару электронов, связывающих два ядра, представляет только один из атомов (донор), тогда как другой атом представляет только свою незаполненную орбиталь (акцептор)
![]()
В органической химии очень часто встречается водородная связь. Если атом водорода связан с сильно электроотрицательными элементами (О, N, F), то в результате существенного смещения электронной плотности к электроотрицательному элементу первый приобретает частичный положительный заряд и может электростатически взаимодействовать с обогащенным электронной плотностью центром:
–О←Н∙∙∙О–
Важным критерием отличия ковалентной связи от ионной является полярность, т.е. наличие постоянного дипольного момента. Для ковалентной связи дипольный момент мал 0,4 ÷ 1,5D.
2.2 Образование ковалентных связей атомами углерода (σ- и π-ковалентные связи)
Электронная конфигурация основного состояния атома углерода 1s22s22p2, т.е. углерод должен проявлять валентность, равную двум, так как на внешнем электронном уровне находится два неспаренных (валентных) электрона. Как известно, в большинстве органических соединений углерод четырехвалентен, поскольку в процессе образования связей атом углерода переходит в возбужденное состояние. В возбужденном состоянии валентные электроны не равноценны. Согласно экспериментальным данным в молекуле метана все четыре связи атома углерода с атомами водорода одинаковы. Противоречие между теорией и экспериментом было разрешено введением понятия гибридизация орбиталей.

Для атома углерода характерно три валентных состояния, т.е. три типа гибридизации.
В зависимости от типа гибридизации между атомами углерода могут образовываться два типа ковалентной связи: σ- и π.
σ-Связь образуется при перекрывании валентных орбиталей по прямой, соединяющей центры реагирующих атомов. В зависимости от природы атомов образующих эту связь она может быть полярной и неполярной. Полярность ковалентной σ-связи показывается стрелкой по связи в структурной формуле.
π-Связь образуется за счет двойного перекрывания р-электронных орбиталей, располагающихся на параллельных осях. π-связь в отличие от σ-связи способна поляризоваться, т.е. изменять распределение электронной плотности в момент реакции.
Таблица 2.1 - Характеристики ковалентной связи
Тип связи |
Валентный угол |
Длина, нм |
Энергия, кДж/моль |
С-С (σ) С=С (σ + π) С≡С (σ + 2π) |
109о28′ 120о 180о |
0,154 0,134 0,121 |
335 628 837 |
Способность органической молекулы к тем или иным типам превращений определяется энергией связи, длиной связи, а также распределением и подвижностью электронной плотности. Распределение и подвижность электронной плотности зависит от полярности и поляризуемости связи, которые в сложных молекулах проявляются в виде эффектов: индукционного, сопряжения, сверхсопряжения.
Полярность связи определяется электроотрицательностью атомов, образующих связь, т.е. способностью атомов в молекуле притягивать к себе электронную плотность. Поляризация одной какой-либо связи в сложной молекуле оказывает влияние на состояние соседних связей. Дипольный момент индуцирует в них также дипольные моменты, значительно меньшие по величине. Такой эффект называется индукционным:
![]()
Индукционный эффект сказывается на реакционной способности молекулы, но затухает по углеродной цепи к 4 – 5 углеродному атому
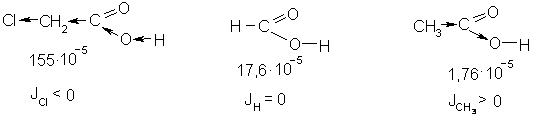
Способность ковалентных связей к перераспределению электронной плотности в момент реакции под влиянием различных факторов, называется поляризуемостью. В сложных молекулах поляризуемость проявляется в виде эффекта сопряжения.
Молекулы с чередующимися простыми и двойными связями обладают рядом специфических особенностей, резко отличающих их от прочих молекул. Такие соединения называются системами с сопряженными связями. Каждый из атомов сопряженной системы имеет р-электрон. Благодаря взаимодействию всех р-электронов образуется единое р-электронное облако, которое на любое внешнее воздействие отвечает как единое целое.
![]()
Проявлением эффекта сопряжения объясняется присоединение к диеновым углеводородам в положение 1,4
Эффект сопряжения (мезомерный) характерен для соединений, содержащих кратные связи или атомы с неподеленными электронными парами
![]()
Если непосредственно с ненасыщенной группой связана группа подобная метилу, то имеет место особый вид сопряжения, называемый сверхсопряжением:

Сверхсопряжение проявляется в том, что выполняется правило Марковникова.
