
- •Глава 1 введение
- •1.2 Основные сырьевые источники органических соединений
- •1.3 Классификация органических соединений
- •1.4 Номенклатура органических соединений
- •1.4.1 Тривиальная номенклатура
- •1.4.2 Рациональная номенклатура
- •1.4.3 Номенклатура июпак
- •1.4.3.1. Номенклатура июпак для алифатических углеводородов.
- •Глава 2 теоретические представления в органической химии
- •2.1 Типы химических связей
- •2.2 Образование ковалентных связей атомами углерода (σ- и π-ковалентные связи)
- •2.3 Общие представления о механизмах химических реакций
- •2.3.1 Свободнорадикальные реакции
- •2.3.2 Ионные реакции
- •2.4 Пространственное расположение атомов в молекуле. Конформация молекул
- •Глава 3 алифатические углеводороды алканы,алкены, алкины и алкадиены
- •3.1 Алканы: определениек,изомерия и номенклатура
- •3.1.2 Способы получения алканов
- •3.1.3 Химические свойства
- •Радикальное галогенирование
- •Нитрование
- •Сульфирование, сульфоокисление, сульфохлорирование
- •Окисление
- •Крекинг углеводородов при высоких температурах
- •Задачи для самопроверки
- •3.2 Алкены: определение, изомерия, номенклатура
- •3.2.1 Способы получения
- •3.2.2 Химические свойства
- •3.3. Алкадиены: определение, изомерия, номенклатура
- •3.3.1 Способы получения важнейших диенов
- •3.3.2 Химические особенности 1,3-алкадиенов
- •3.4. Алкины: определение, изомерия, номенклатура
- •3.4.1. Способы получения.
- •3.4.2. Химические свойства
- •Глава 4 карбоциклические соединения
- •4.1. Алициклический ряд: определение, изомерия, номенклатура
- •4.1.1 Способы получения
- •4.1.2. Химические свойства
- •4.1.3. Современные представления о строении моноциклоалканов.
- •4.2. Ароматические углеводороды
- •4.2.1. Строение бензола
- •4.2.2. Способы получения
- •4.2.3. Химические свойства
- •4.3.4. Правила ориентации в бензольном кольце
- •4.2.5. Механизм ориентирующего влияния заместителей
- •4.3. Многоядерные ароматические соединения с неконденсированными и конденсированными бензольными ядрами
- •4.3.1. Основные способы получения
- •4.3.2. Химические особенности
- •Функциональные производные углеводородов
- •Глава 5 галогенопроизводные
- •5.1. Галогенопроизводные: определение, изомерия, номенклатура
- •5.2. Способы получения
- •5..3 Химические свойства
- •Глава 6 кислородсодержащие органические соединения
- •6.1. Спирты: определение, изомерия, номенклатура
- •6.1.1. Способы получения
- •6.1.2 Физические свойства спиртов
- •6.1.3. Химические свойства
- •6.1.4 Понятие о непредельных и многоатомных спиртах
- •6.2. Фенолы: определение, изомерия, номенклатура
- •16.2.1. Способы получения
- •6.2.2. Химические свойства
- •6.3. Простые эфиры: определение, изомерия, номенклатура
- •6.3.1. Способы получения
- •6.3.2. Химические свойства
- •6.3.3. Окись этилена (эпоксисоединения)
- •6.4. Оксосоединения (альдегиды и кетоны)
- •6.4.1. Определение, изомерия и номенклатура оксосоединений
- •6.4.2. Способы получения
- •6.4.3. Химические свойства
- •6.4.4. Понятие о непредельных альдегидах и кетонах
- •6.4.5. Особенности получения и химические свойства хинонов
- •Задачи для самопроверки
- •6.5. Одно и многоосновные карбоновые кислоты и их производные: определение, изомерия, номенклатура
- •6.5.1. Способы получения
- •6.5.2. Химические свойства
- •6.5.3. Особенности предельных и непредельных кислот
- •Задачи для самопроверки
- •Глава 7. Серосодержащие соединения
- •7.1. Органические соединения двухвалентной серы (Тиолы, сульфиды, дисульфиды)
- •7.2. Сульфиновые кислоты и их производные
- •7.3. Сульфоновые кислоты и их производные. Сульфоны.
- •Глава 8. Азотсодержащие органические соединения
- •8.1 Нитросоединения: определение, изомерия, номенклатура.
- •8.1.1. Способы получения
- •8.1.2. Химические свойства
- •Задачи для самопроверки
- •8.2 Амины: определение, изомерия, номенклатура
- •8.2.1 Способы получения
- •8.2.2. Химические свойства
- •8.2.3. Понятие о диаминах
- •Задачи для самопроверки
- •8.3. Диазо- и азосоединения: определение, изомерия, номенклатура
- •8.3.1. Способы получения
- •8.3.2 Физические и химические свойства
- •II. Реакции без выделения азота
- •Задачи для самопроверки
- •Глава 9 . Гетерофункциональные соединеия
- •9.1. Гидроксикислоты: определение, изомерия, номенклатура
- •9.1.1. Способы получения
- •9.1.2. Химические свойства
- •9.1.3. Оптическая изомерия гидроксикислот
- •9.1.4. Ароматические гидроксикислоты и их производные
- •Задачи для самопроверки
- •9.2. Альдегидо- и кетокислоты: определение, изомерия, номенклатура
- •9.2.1. Способы получения
- •9.2.2. Химические особенности
- •9.2.3. Применение ацетоуксусного эфира в органическом синтезе
- •Задачи для самопроверки
- •9.3. Аминокислоты: определение, изомерия, номенклатура
- •9.3.1. Способы получения
- •9.3.2. Химические свойства
- •Задачи для самопроверки
- •Глава 10. Гетероциклические соединения
- •10.1. Определение и классификация гетероциклических соединений.
- •10.2. Пятичленные гетероциклические соединения: изомерия, номенклатура, ароматический характер.
- •10.2.1. Способы получения пятичленных гетероциклических соединений.
- •10.2.3. Химические свойства
- •10.3. Понятие о конденсированных гетероциклах (индол)
- •10.4. Шестичленные гетероциклические соединения: изомерия, номенклатура
- •10.4.1. Химические свойства.
- •Глава 11. Липиды
- •11.1.Определение, классификация изомерия, номенклатура
- •11.2. Простые липиды. (Жиры, масла)
- •10.3. Сложные липиды. Понятие о фосфолипидах.
- •10.4. Понятие о циклических липидах
- •Глава 12. Углеводы
- •12.1. Определение, классификация, изомерия, номенклатура.
- •12.2. Моносахариды: строение, оптическая изомерия.
- •12.3.Химические свойства моносахаридов.
- •12.4. Олигосахариды: особенности строения, химические свойства
- •12.5. Несахароподобные полисахариды: крахмал, гликоген, клетчатка.
- •Глава 13. Пептиды и белки
- •13.1. Протеиногенные аминокислоты
- •13.2. Понятие о строении пептидов.
- •13.3. Особенности строения белков
- •Глава 14. Нуклеиновые кислоты
- •14.1. Понятие о составе и строении нуклеиновых кислот
- •14.2. Классификация и биологическая роль нуклеиновых кислот
4.2.2. Способы получения
Ароматические углеводороды ряда бензола содержатся в некоторых сортах нефти. Помимо этого, так как ядро бензола энергетически очень «выгодная» система, соединения ароматического ряда образуются при многих процессах. Так, например, при каталитическом и термическом крекинге нефти они образуются в заметных количествах. При переработке каменного угля в кокс в каменноугольной смоле содержание ароматических соединений достигает нескольких десятков процентов (бензол, толуол, ксилолы, фенол, нафталин, антрацен).
В лабораторной практике и в промышленности для синтеза аренов применимы следующие способы:
1. Ароматизация парафинов на оксиде хрома

2. Ацетилен и его гомологи при температуре красного каления, а в присутствии катализаторов и при более низкой температуре образуют ароматические углеводороды
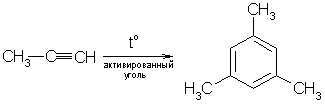
Мезитилен
3. Дегидрирование циклоалканов, содержащих шестичленное кольцо
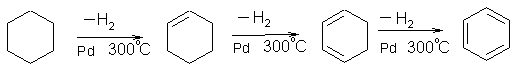
циклогексан циклогексен циклогексадиен бензол
4. Сплавление солей бензойной кислоты со щелочами

5. Гомологи бензола можно получить:
а) из галогенопроизводных реакцией Вюрца-Фиттига
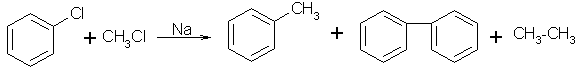 хлорбензол
хлорметан
толуол
дифенил
этан
хлорбензол
хлорметан
толуол
дифенил
этан
б) реакцией Фриделя-Крафтса
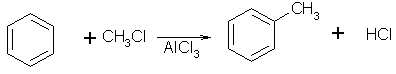
В качестве катализатора в реакции Фриделя-Крафтса используют безводные хлориды тяжелых металлов и алюминия, а также фтористый водород.
в) восстановлением ароматических кетонов амальгамированным цинком в соляной кислоте:
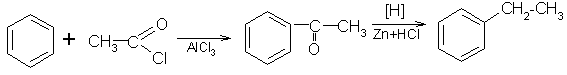
хлористый ацетил ацетофенон этилбензол
Физические свойства
Ароматические углеводороды – обычно жидкости и реже твердые вещества – обладают сильным специфическим запахом. Температура кипения ароматических углеводородов выше, чем соответствующих алканов.
Изомеры с несколькими радикалами кипят при более высокой температуре, чем изомеры с одним радикалом. При сближении радикалов температура кипения обычно возрастает.
Каждая новая группа СН2 повышает температуру кипения примерно на 30 оС.
Плотность и показатели преломления ароматических углеводородов значительно выше, чем у углеводородов алифатического и алициклического рядов.
Ароматические углеводороды почти нерастворимы в воде. Вдыхание их паров вызывает отравление. Обладают канцерогенностью.
4.2.3. Химические свойства
Ароматические углеводороды обладают большей склонностью к реакциям замещения, чем к реакциям присоединения. Характерна также большая устойчивость бензольного кольца к окислителям.
Реакции присоединения
Реакции присоединения протекают обычно по трем кратным связям бензольного кольца одновременно.
1. Гидрирование бензола и его гомологов происходит в присутствии катализаторов (Ni, Pt, Pd) при повышенной температуре:
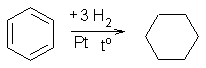
2. Если раствор хлора или брома в бензоле подвергнуть действию солнечного света или ультрафиолетовых лучей, то происходит быстрое присоединение трех молекул галогена. Продукты присоединения при нагревании теряют три молекулы галогеноводорода и дают тригалогенбензол:

3. Бензол и его гомологи присоединяют озон с образованием чрезвычайно взрывоопасных триозонидов, которые разлагаются на карбонильные соединения под действие воды. Эта реакция используется для доказательства строения ароматических соединений:

Реакции окисления
Бензольное кольцо устойчиво к действию окислителей. Такие окислители как перманганат калия, оксид хрома (+6), азотная кислота на бензол не действуют.
1. При окислении бензола кислородом воздуха на оксиде ванадия (+5) образуется малеиновый ангидрид:

малеиновый ангидрид
2. При окислении гомологов бензола кислородом воздуха образуются гидропероксиды. В реакции принимает участие углеродный атом в α-положении к бензольному кольцу:
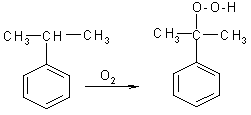
кумол гидроперекись кумола
3. При действии окислителей на гомологи бензола окисляется боковая цепь. Независимо от длины боковой цепи она дает карбоксильную группу:

толуол бензойная кислота
Следует отметить, что третичные алкильные группы, связанные с бензольным кольцом, устойчивы к окислению; бензольное кольцо окисляется легче, чем эти группы.
Реакции замещения
1. В присутствии катализаторов (FeCl3, AlCl3) хлор и бром не присоединяются к бензолу, но замещают атомы водорода в его молекуле:
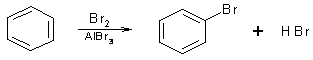
бромбензол
2. Концентрированная серная кислота не вызывает полимеризации бензола, как это происходит в случае алкенов и алкадиенов, а приводит к образованию бензолсульфокислоты:

Бензолсульфокислота
3. При действии нитрующей смеси (концентрированная азотная и серная кислоты) происходит нитрование ядра:
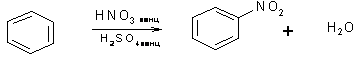
нитробензол
Механизм этих реакций электрофильный. Он осуществляется и при протекании реакций алкилирования, ацилирования, азосочетания.
Механизм электрофильного замещения в бензольном кольце разберем на примере реакции галогенирования.
Под действием катализатора образуется активная форма электрофильного реагента:
![]()
Стадией, определяющей скорость реакции, является образование σ-комплекса:

π-комплекс σ-комплекс
π-Комплекс – это промежуточное состояние, в котором реагирующие частицы сориентировались относительно друг друга.
σ-Комплекс – это катион, лишенный ароматической структуры, с четырьмя π-электронами, делокализованными в сфере воздействия ядер пяти углеродных атомов. Шестой углеродный атом при образовании σ-комплекса переходит из состояния sp2 в состояние sp3-гибридизации, приобретая таким образом тетраэдрическую симметрию.
σ-Комплекс – это не переходное состояние, а настоящее промежуточное соединение.
На следующей стадии лабильный σ-комплекс превращается в стабильный замещенный бензол с потерей протона:
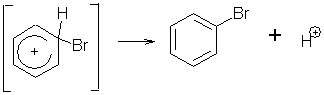
Н+ + AlBr4– → AlBr3 + HBr
