
- •Глава 1 введение
- •1.2 Основные сырьевые источники органических соединений
- •1.3 Классификация органических соединений
- •1.4 Номенклатура органических соединений
- •1.4.1 Тривиальная номенклатура
- •1.4.2 Рациональная номенклатура
- •1.4.3 Номенклатура июпак
- •1.4.3.1. Номенклатура июпак для алифатических углеводородов.
- •Глава 2 теоретические представления в органической химии
- •2.1 Типы химических связей
- •2.2 Образование ковалентных связей атомами углерода (σ- и π-ковалентные связи)
- •2.3 Общие представления о механизмах химических реакций
- •2.3.1 Свободнорадикальные реакции
- •2.3.2 Ионные реакции
- •2.4 Пространственное расположение атомов в молекуле. Конформация молекул
- •Глава 3 алифатические углеводороды алканы,алкены, алкины и алкадиены
- •3.1 Алканы: определениек,изомерия и номенклатура
- •3.1.2 Способы получения алканов
- •3.1.3 Химические свойства
- •Радикальное галогенирование
- •Нитрование
- •Сульфирование, сульфоокисление, сульфохлорирование
- •Окисление
- •Крекинг углеводородов при высоких температурах
- •Задачи для самопроверки
- •3.2 Алкены: определение, изомерия, номенклатура
- •3.2.1 Способы получения
- •3.2.2 Химические свойства
- •3.3. Алкадиены: определение, изомерия, номенклатура
- •3.3.1 Способы получения важнейших диенов
- •3.3.2 Химические особенности 1,3-алкадиенов
- •3.4. Алкины: определение, изомерия, номенклатура
- •3.4.1. Способы получения.
- •3.4.2. Химические свойства
- •Глава 4 карбоциклические соединения
- •4.1. Алициклический ряд: определение, изомерия, номенклатура
- •4.1.1 Способы получения
- •4.1.2. Химические свойства
- •4.1.3. Современные представления о строении моноциклоалканов.
- •4.2. Ароматические углеводороды
- •4.2.1. Строение бензола
- •4.2.2. Способы получения
- •4.2.3. Химические свойства
- •4.3.4. Правила ориентации в бензольном кольце
- •4.2.5. Механизм ориентирующего влияния заместителей
- •4.3. Многоядерные ароматические соединения с неконденсированными и конденсированными бензольными ядрами
- •4.3.1. Основные способы получения
- •4.3.2. Химические особенности
- •Функциональные производные углеводородов
- •Глава 5 галогенопроизводные
- •5.1. Галогенопроизводные: определение, изомерия, номенклатура
- •5.2. Способы получения
- •5..3 Химические свойства
- •Глава 6 кислородсодержащие органические соединения
- •6.1. Спирты: определение, изомерия, номенклатура
- •6.1.1. Способы получения
- •6.1.2 Физические свойства спиртов
- •6.1.3. Химические свойства
- •6.1.4 Понятие о непредельных и многоатомных спиртах
- •6.2. Фенолы: определение, изомерия, номенклатура
- •16.2.1. Способы получения
- •6.2.2. Химические свойства
- •6.3. Простые эфиры: определение, изомерия, номенклатура
- •6.3.1. Способы получения
- •6.3.2. Химические свойства
- •6.3.3. Окись этилена (эпоксисоединения)
- •6.4. Оксосоединения (альдегиды и кетоны)
- •6.4.1. Определение, изомерия и номенклатура оксосоединений
- •6.4.2. Способы получения
- •6.4.3. Химические свойства
- •6.4.4. Понятие о непредельных альдегидах и кетонах
- •6.4.5. Особенности получения и химические свойства хинонов
- •Задачи для самопроверки
- •6.5. Одно и многоосновные карбоновые кислоты и их производные: определение, изомерия, номенклатура
- •6.5.1. Способы получения
- •6.5.2. Химические свойства
- •6.5.3. Особенности предельных и непредельных кислот
- •Задачи для самопроверки
- •Глава 7. Серосодержащие соединения
- •7.1. Органические соединения двухвалентной серы (Тиолы, сульфиды, дисульфиды)
- •7.2. Сульфиновые кислоты и их производные
- •7.3. Сульфоновые кислоты и их производные. Сульфоны.
- •Глава 8. Азотсодержащие органические соединения
- •8.1 Нитросоединения: определение, изомерия, номенклатура.
- •8.1.1. Способы получения
- •8.1.2. Химические свойства
- •Задачи для самопроверки
- •8.2 Амины: определение, изомерия, номенклатура
- •8.2.1 Способы получения
- •8.2.2. Химические свойства
- •8.2.3. Понятие о диаминах
- •Задачи для самопроверки
- •8.3. Диазо- и азосоединения: определение, изомерия, номенклатура
- •8.3.1. Способы получения
- •8.3.2 Физические и химические свойства
- •II. Реакции без выделения азота
- •Задачи для самопроверки
- •Глава 9 . Гетерофункциональные соединеия
- •9.1. Гидроксикислоты: определение, изомерия, номенклатура
- •9.1.1. Способы получения
- •9.1.2. Химические свойства
- •9.1.3. Оптическая изомерия гидроксикислот
- •9.1.4. Ароматические гидроксикислоты и их производные
- •Задачи для самопроверки
- •9.2. Альдегидо- и кетокислоты: определение, изомерия, номенклатура
- •9.2.1. Способы получения
- •9.2.2. Химические особенности
- •9.2.3. Применение ацетоуксусного эфира в органическом синтезе
- •Задачи для самопроверки
- •9.3. Аминокислоты: определение, изомерия, номенклатура
- •9.3.1. Способы получения
- •9.3.2. Химические свойства
- •Задачи для самопроверки
- •Глава 10. Гетероциклические соединения
- •10.1. Определение и классификация гетероциклических соединений.
- •10.2. Пятичленные гетероциклические соединения: изомерия, номенклатура, ароматический характер.
- •10.2.1. Способы получения пятичленных гетероциклических соединений.
- •10.2.3. Химические свойства
- •10.3. Понятие о конденсированных гетероциклах (индол)
- •10.4. Шестичленные гетероциклические соединения: изомерия, номенклатура
- •10.4.1. Химические свойства.
- •Глава 11. Липиды
- •11.1.Определение, классификация изомерия, номенклатура
- •11.2. Простые липиды. (Жиры, масла)
- •10.3. Сложные липиды. Понятие о фосфолипидах.
- •10.4. Понятие о циклических липидах
- •Глава 12. Углеводы
- •12.1. Определение, классификация, изомерия, номенклатура.
- •12.2. Моносахариды: строение, оптическая изомерия.
- •12.3.Химические свойства моносахаридов.
- •12.4. Олигосахариды: особенности строения, химические свойства
- •12.5. Несахароподобные полисахариды: крахмал, гликоген, клетчатка.
- •Глава 13. Пептиды и белки
- •13.1. Протеиногенные аминокислоты
- •13.2. Понятие о строении пептидов.
- •13.3. Особенности строения белков
- •Глава 14. Нуклеиновые кислоты
- •14.1. Понятие о составе и строении нуклеиновых кислот
- •14.2. Классификация и биологическая роль нуклеиновых кислот
Задачи для самопроверки
1. Назовите следующих соединений по номенклатуре ИЮПАК:

2. Покажите, каким образом можно осуществить следующие превращения:


![]()
3. Расположите следующие кислоты в порядке увеличения их кислотности:
![]()
4. Завершите следующие реакции:
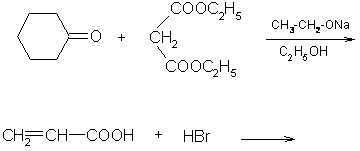
5. Напишите уравнения реакций, соответствующие схеме; назовите органические соединения:

6. Предложите химический метод выделения масляной кислоты из смеси ее с бутиловым спиртом и бутаналем.
7. Из малоновой кислоты получите изомасляную кислоту.
Глава 7. Серосодержащие соединения
Многие органические соединения, содержащие в молекуле серу, близки к аналогичным кислородсодержащим соединениям. Однако, рассматривая эти вещества, необходимо учитывать особенности строения атома серы. Являясь аналогом кислорода, сера в тоже время отличается от него своей переменной валентностью и меньшей электроотрицательностью. В органических соединениях сера проявляет валентность равную двум, четырем и шести и образует следующие классы (типы) соединений.

7.1. Органические соединения двухвалентной серы (Тиолы, сульфиды, дисульфиды)
Тиолы можно рассматривать как производные сероводорода, в котором один атом водорода замещен радикалом. Они являются аналогами спиртов и фенолов.
Номенклатура тиолов подобна номенклатуре оксипроизводных, только вместо суффикса «ол» применяется «тиол» или вместо префикса «гидрокси (окси)» – применяется «меркапто–». Эти соединения называются еще меркаптанами, тиоспиртами, тиофенолами.

Сульфиды и дисульфиды являются производными сероводорода H2S и H2S2, в которых оба атома водорода замещены углеводородными остатками. Они являются аналогами простых эфиров и пероксидов.

Способы получения
1.Алкантиолы получают реакциями алкилирования сероводорода и его солей

2.Арентиолы обычно получают восстановлением аренсульфонилхлоридов

3. Сульфиды получают алкилированием алкан- и арентиолятов или неорганических сульфидов
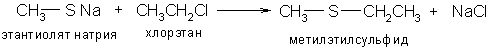


Для получения диарилсульфидов используют реакцию галогенидов серы с аренами в присутствии кислот Льюиса
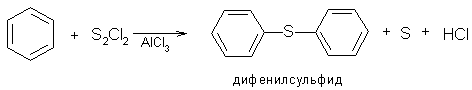
4. Дисульфиды получают окислением тиолятов или алкилированием неорганических дисульфидов

Физические свойства
Тиолы представляют собой бесцветные соединения с чрезвычайно неприятным запахом, который обнаруживается уже в ничтожных концентрациях (1:4∙108). Связь S–H менее полярна, чем связь О–Н, поэтому у тиолов слабее межмолекулярные водородные связи и ниже температуры кипения, чем у соответствующих кислородных аналогов.
Сульфиды и дисульфиды также бесцветные вещества с неприятным запахом. Их температуры кипения выше, чем у аналогичных простых эфиров и пероксидов.
Химические свойства
1. Тиолы. Реакции тиолов обусловлены главным образом ионизацией связи S–H и нуклеофильными свойствами атома серы.
1.1) тиолы являются SH-кислотами, причем значительно более сильными, чем аналогичные ОН-кислоты
![]()
Характерно, что только тиолят ртути содержит ковалентную связь Hg–S.
1.2) тиолы и особенно тиоляты легко окисляются. При действии слабых окислителей продуктом реакции являются дисульфиды. Сильные окислители превращают тиолы в сульфоновые кислоты
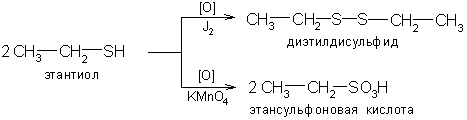
1.3) тиолят-ион является сильным нуклеофилом и легко алкилируется:

1.4) тиолы и дисульфиды взаимодействуют с молекулярным хлором с образованием сульфенилхлоридов. Сульфенилхлориды под действием щелочи образуют сульфеновые кислоты:



Сульфиды и дисульфиды
2.1) Химические свойства сульфидов и дисульфидов определяются главным образом большой подвижностью электронной системы атома серы. Они легко образуют донорно-акцепторные комплексы с различными ионами металлов,галогенами и другими кислотами Льюиса:

2.2) Но в тоже время сульфиды являются очень слабыми основаниями

2.3) Сульфиды легко алкилируются с образованием солей сульфония:
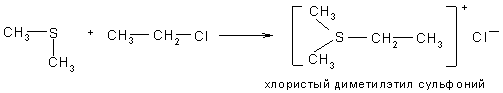
2.4) Слабые окислители (например пероксид водорода) позволяют получить из сульфидов сульфоксиды, а более сильные окислители – сульфоны:

К классу сульфидов относится боевое отравляющее вещество кожно-нарывного действия – иприт (β, β′-дихлордиэтилсульфид). Это бесцветная жидкость (tкип 217оС) с чесночным запахом. Иприт можно получить по схеме:
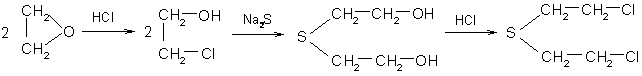
Для дегазации иприта используется хлорная известь или хлорамин Б и Т. Дегазаторы превращают иприт в сульфоксиды и другие вещества.
