
- •Глава 1 введение
- •1.2 Основные сырьевые источники органических соединений
- •1.3 Классификация органических соединений
- •1.4 Номенклатура органических соединений
- •1.4.1 Тривиальная номенклатура
- •1.4.2 Рациональная номенклатура
- •1.4.3 Номенклатура июпак
- •1.4.3.1. Номенклатура июпак для алифатических углеводородов.
- •Глава 2 теоретические представления в органической химии
- •2.1 Типы химических связей
- •2.2 Образование ковалентных связей атомами углерода (σ- и π-ковалентные связи)
- •2.3 Общие представления о механизмах химических реакций
- •2.3.1 Свободнорадикальные реакции
- •2.3.2 Ионные реакции
- •2.4 Пространственное расположение атомов в молекуле. Конформация молекул
- •Глава 3 алифатические углеводороды алканы,алкены, алкины и алкадиены
- •3.1 Алканы: определениек,изомерия и номенклатура
- •3.1.2 Способы получения алканов
- •3.1.3 Химические свойства
- •Радикальное галогенирование
- •Нитрование
- •Сульфирование, сульфоокисление, сульфохлорирование
- •Окисление
- •Крекинг углеводородов при высоких температурах
- •Задачи для самопроверки
- •3.2 Алкены: определение, изомерия, номенклатура
- •3.2.1 Способы получения
- •3.2.2 Химические свойства
- •3.3. Алкадиены: определение, изомерия, номенклатура
- •3.3.1 Способы получения важнейших диенов
- •3.3.2 Химические особенности 1,3-алкадиенов
- •3.4. Алкины: определение, изомерия, номенклатура
- •3.4.1. Способы получения.
- •3.4.2. Химические свойства
- •Глава 4 карбоциклические соединения
- •4.1. Алициклический ряд: определение, изомерия, номенклатура
- •4.1.1 Способы получения
- •4.1.2. Химические свойства
- •4.1.3. Современные представления о строении моноциклоалканов.
- •4.2. Ароматические углеводороды
- •4.2.1. Строение бензола
- •4.2.2. Способы получения
- •4.2.3. Химические свойства
- •4.3.4. Правила ориентации в бензольном кольце
- •4.2.5. Механизм ориентирующего влияния заместителей
- •4.3. Многоядерные ароматические соединения с неконденсированными и конденсированными бензольными ядрами
- •4.3.1. Основные способы получения
- •4.3.2. Химические особенности
- •Функциональные производные углеводородов
- •Глава 5 галогенопроизводные
- •5.1. Галогенопроизводные: определение, изомерия, номенклатура
- •5.2. Способы получения
- •5..3 Химические свойства
- •Глава 6 кислородсодержащие органические соединения
- •6.1. Спирты: определение, изомерия, номенклатура
- •6.1.1. Способы получения
- •6.1.2 Физические свойства спиртов
- •6.1.3. Химические свойства
- •6.1.4 Понятие о непредельных и многоатомных спиртах
- •6.2. Фенолы: определение, изомерия, номенклатура
- •16.2.1. Способы получения
- •6.2.2. Химические свойства
- •6.3. Простые эфиры: определение, изомерия, номенклатура
- •6.3.1. Способы получения
- •6.3.2. Химические свойства
- •6.3.3. Окись этилена (эпоксисоединения)
- •6.4. Оксосоединения (альдегиды и кетоны)
- •6.4.1. Определение, изомерия и номенклатура оксосоединений
- •6.4.2. Способы получения
- •6.4.3. Химические свойства
- •6.4.4. Понятие о непредельных альдегидах и кетонах
- •6.4.5. Особенности получения и химические свойства хинонов
- •Задачи для самопроверки
- •6.5. Одно и многоосновные карбоновые кислоты и их производные: определение, изомерия, номенклатура
- •6.5.1. Способы получения
- •6.5.2. Химические свойства
- •6.5.3. Особенности предельных и непредельных кислот
- •Задачи для самопроверки
- •Глава 7. Серосодержащие соединения
- •7.1. Органические соединения двухвалентной серы (Тиолы, сульфиды, дисульфиды)
- •7.2. Сульфиновые кислоты и их производные
- •7.3. Сульфоновые кислоты и их производные. Сульфоны.
- •Глава 8. Азотсодержащие органические соединения
- •8.1 Нитросоединения: определение, изомерия, номенклатура.
- •8.1.1. Способы получения
- •8.1.2. Химические свойства
- •Задачи для самопроверки
- •8.2 Амины: определение, изомерия, номенклатура
- •8.2.1 Способы получения
- •8.2.2. Химические свойства
- •8.2.3. Понятие о диаминах
- •Задачи для самопроверки
- •8.3. Диазо- и азосоединения: определение, изомерия, номенклатура
- •8.3.1. Способы получения
- •8.3.2 Физические и химические свойства
- •II. Реакции без выделения азота
- •Задачи для самопроверки
- •Глава 9 . Гетерофункциональные соединеия
- •9.1. Гидроксикислоты: определение, изомерия, номенклатура
- •9.1.1. Способы получения
- •9.1.2. Химические свойства
- •9.1.3. Оптическая изомерия гидроксикислот
- •9.1.4. Ароматические гидроксикислоты и их производные
- •Задачи для самопроверки
- •9.2. Альдегидо- и кетокислоты: определение, изомерия, номенклатура
- •9.2.1. Способы получения
- •9.2.2. Химические особенности
- •9.2.3. Применение ацетоуксусного эфира в органическом синтезе
- •Задачи для самопроверки
- •9.3. Аминокислоты: определение, изомерия, номенклатура
- •9.3.1. Способы получения
- •9.3.2. Химические свойства
- •Задачи для самопроверки
- •Глава 10. Гетероциклические соединения
- •10.1. Определение и классификация гетероциклических соединений.
- •10.2. Пятичленные гетероциклические соединения: изомерия, номенклатура, ароматический характер.
- •10.2.1. Способы получения пятичленных гетероциклических соединений.
- •10.2.3. Химические свойства
- •10.3. Понятие о конденсированных гетероциклах (индол)
- •10.4. Шестичленные гетероциклические соединения: изомерия, номенклатура
- •10.4.1. Химические свойства.
- •Глава 11. Липиды
- •11.1.Определение, классификация изомерия, номенклатура
- •11.2. Простые липиды. (Жиры, масла)
- •10.3. Сложные липиды. Понятие о фосфолипидах.
- •10.4. Понятие о циклических липидах
- •Глава 12. Углеводы
- •12.1. Определение, классификация, изомерия, номенклатура.
- •12.2. Моносахариды: строение, оптическая изомерия.
- •12.3.Химические свойства моносахаридов.
- •12.4. Олигосахариды: особенности строения, химические свойства
- •12.5. Несахароподобные полисахариды: крахмал, гликоген, клетчатка.
- •Глава 13. Пептиды и белки
- •13.1. Протеиногенные аминокислоты
- •13.2. Понятие о строении пептидов.
- •13.3. Особенности строения белков
- •Глава 14. Нуклеиновые кислоты
- •14.1. Понятие о составе и строении нуклеиновых кислот
- •14.2. Классификация и биологическая роль нуклеиновых кислот
6.4.3. Химические свойства
Карбонильные соединения отличаются большой реакционной способностью. Большинство их реакции обусловлено присутствием активной карбонильной группы. Двойная связь карбонильной группы сходна по физической природе с двойной связью между двумя атомами углерода (σ–связь + π–связь). С другой стороны, кислород является более электроотрицательным элементом, чем углерод, и поэтому электронная плотность вблизи атома кислорода больше, чем вблизи атома углерода.

Дипольный момент карбонильной группы – около 9∙10–30 Кл/м (2,7Д). Благодаря такой поляризации углеродный атом карбонольной группы обладает электрофильными свойствами и способен реагировать с нуклеофильными реагентами. Соответственно атом кислорода является нуклеофильным.
Реакции нуклеофильного присоединения
Реакции нуклеофильного присоединения к карбонильной группе начинаются с взаимодействия положительно заряженного карбонильного углерода со свободной электронной парой нуклеофильного реагента. На этом этапе реакция протекает медленно
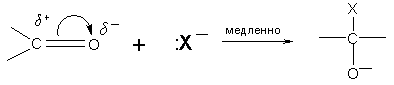
Вторая стадия – присоединение протона (или другого катиона) к образовавшемуся аниону протекает быстро:

1. По этому механизму к карбонильным соединениям присоединяются синильная кислота, гидросульфит натрия, магнийорганические соединения, водород:


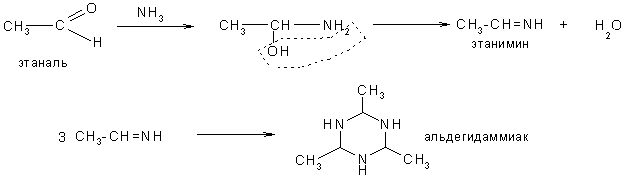
2. Альдегиды, но не кетоны по данному механизму реагируют со спиртами, образуя полуацетали и ацетали, а также с аммиаком, альдимины и альдегидаммиаки:

Реакции замещения кислорода карбонильной группы
Эти реакции также начинаются с нуклеофильного присоединения, но приводят к замещению атома кислорода в карбонильной группе.
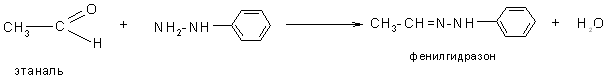
1. Реакции с гидроксиламином, гидразином, фенилгидразином применяются для обнаружения, идентификации и количественного определения карбонильных соединений:

Примечение: Гидразоны могу быть использованы для получения предельных углеводородов (реакция Кижнера):
![]()
2. При действии галогенидов фосфора или серы атом кислорода в молекуле карбонильного соединения замещается двумя атомами галогена:

3. Важной для ароматических альдегидов является реакция с аминами, приводящая к шиффовым основаниям (анилам)

Реакции окисления
1. Альдегиды в отличие от кетонов легко окисляются кислородом воздуха, слабыми и сильными окислителями до кислот с тем же числом углеродных атомов. Реакцию альдегидов с аммиачным раствором гидроксида серебра называют реакцией серебряного зеркала. Ее используют для обнаружения альдегидов:

2. Для альдегидов характерна также реакция с так называемой фелинговой жидкостью. Последняя представляет собой водно-щелочной раствор комплексной соли, образовавшейся из гидроксида меди и натрий-калиевой соли винной кислоты. При нагревании альдегидов с фелинговой жидкостью медь (II) восстанавливается до меди (I), а альдегид окисляется до кислоты:
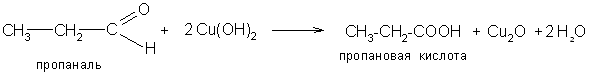
Красная окись меди Cu2O почти количественно выпадает в осадок. С кетонами эта реакция не идет.
3. Окисление кетонов протекает с разрывом углеродной цепочки в разных направлениях в зависимости от строения кетонов. Разрыв углеродной цепи требует действий сильных окислителей и жестких условий реакции:
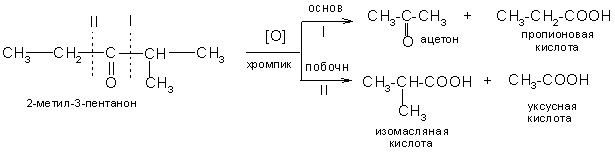
4. Для ароматических и алифатических альдегидов, не имеющих в молекуле водорода у α–углеродных атомов, характерна реакция Канницаро – окисление одной молекулы альдегида за счет другой при действии концентрированных щелочей:

5. Алифатические альдегиды под действием этилата алюминия подвергаются окислительно–восстановительному превращению с образованием сложных эфиров (реакция Тищенко).
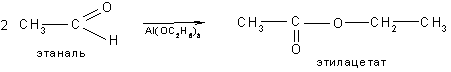
Реакции конденсации
1. Альдольная конденсация
Альдегиды и метилкетоны в слабоосновной среде (ацетат калия, поташ) подвергаются альдольной конденсации. Альдольная конденсация идет только за счет группы, находящейся в α-положении к карбонилу, так как только водородные атомы этой группы в достаточной степени активизируются карбонильной группой:

В результате реакции конденсации образуются новые углерод-углеродные связи. Образовавшееся соединение содержит в молекуле как альдегидную, так и спиртовую группы (отсюда название альд-оль).
2. Кротоновая конденсация
Альдоли – малоустойчивые соединения; они легко теряют элемент воды, образующиеся в результате отщепления гидроксильной группы и оставшегося у α-углеродного атома водорода:

Ароматические альдегиды, содержащие альдегидную группу в ядре, не могут конденсироваться между собой из-за отсутствия водорода у α-углеродных атомов, но могут конденсироваться с другими веществами:
3. Реакция Перкина
Ароматические альдегиды взаимодействуют с ангидридами кислот жирного ряда в слабощелочной среде:
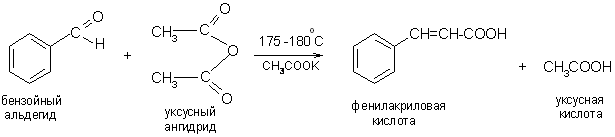
4. Конденсация Кляйзена
Ароматические альдегиды взаимодействуют с альдегидами и кетонами алифатических углеводородов:


5. Конденсация ароматических альдегидов с ароматическими соединениями с подвижными атомами водорода (фенолами, ароматическими аминами) имеет большое значение в синтезе красителей трифенилметанового ряда:

6. Специфической для ароматических альдегидов является бензоиновая конденсация, идущая под влиянием солей синильной кислоты (Н. Н. Зинин):
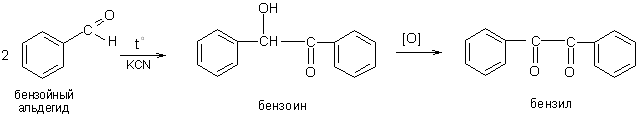
Бензоин легко окисляется в дикетон бензил.
7. Очень своеобразно протекает реакция ароматических альдегидов с аммиаком. Из бензойного альдегида получается гидробензамид, превращающийся при нагревании в присутствии кислот в амарин:

Сравнение свойств альдегидов и кетонов
Как альдегиды, так и кетоны могут присоединять водород, синильную кислоту, магнийорганические соединения, гидросульфит натрия. Из кетонов с гидросульфитом натрия реагируют только те, которые содержат метильную или две метиленовые группы в непосредственном соседстве с карбонилом. С гидроксиламином, гидразином и его производными альдегиды и кетоны реагируют с образованием оксимов, гидразонов, фенилгидразонов и т. д. При действии галогенидов фосфора и серы атом кислорода в молекулах альдегидов и кетонов замещается двумя атомами галогена.
Однако между альдегидами и кетонами имеются существенные различия. Так, в отличие от альдегидов кетоны не окрашивают бесцветный раствор фуксинсернистой кислоты, в мягких условиях не конденсируются под действием щелочей, не дают со спиртами ацеталей, не дают реакции серебряного зеркала.
Окисляются кетоны труднее, чем альдегиды, причем при их окислении происходит разрыв углерод–углеродной связи; труднее для кетонов протекают и реакции конденсации; кетоны дают цветную реакцию с нитропруссидом натрия.
