
- •Глава 1 введение
- •1.2 Основные сырьевые источники органических соединений
- •1.3 Классификация органических соединений
- •1.4 Номенклатура органических соединений
- •1.4.1 Тривиальная номенклатура
- •1.4.2 Рациональная номенклатура
- •1.4.3 Номенклатура июпак
- •1.4.3.1. Номенклатура июпак для алифатических углеводородов.
- •Глава 2 теоретические представления в органической химии
- •2.1 Типы химических связей
- •2.2 Образование ковалентных связей атомами углерода (σ- и π-ковалентные связи)
- •2.3 Общие представления о механизмах химических реакций
- •2.3.1 Свободнорадикальные реакции
- •2.3.2 Ионные реакции
- •2.4 Пространственное расположение атомов в молекуле. Конформация молекул
- •Глава 3 алифатические углеводороды алканы,алкены, алкины и алкадиены
- •3.1 Алканы: определениек,изомерия и номенклатура
- •3.1.2 Способы получения алканов
- •3.1.3 Химические свойства
- •Радикальное галогенирование
- •Нитрование
- •Сульфирование, сульфоокисление, сульфохлорирование
- •Окисление
- •Крекинг углеводородов при высоких температурах
- •Задачи для самопроверки
- •3.2 Алкены: определение, изомерия, номенклатура
- •3.2.1 Способы получения
- •3.2.2 Химические свойства
- •3.3. Алкадиены: определение, изомерия, номенклатура
- •3.3.1 Способы получения важнейших диенов
- •3.3.2 Химические особенности 1,3-алкадиенов
- •3.4. Алкины: определение, изомерия, номенклатура
- •3.4.1. Способы получения.
- •3.4.2. Химические свойства
- •Глава 4 карбоциклические соединения
- •4.1. Алициклический ряд: определение, изомерия, номенклатура
- •4.1.1 Способы получения
- •4.1.2. Химические свойства
- •4.1.3. Современные представления о строении моноциклоалканов.
- •4.2. Ароматические углеводороды
- •4.2.1. Строение бензола
- •4.2.2. Способы получения
- •4.2.3. Химические свойства
- •4.3.4. Правила ориентации в бензольном кольце
- •4.2.5. Механизм ориентирующего влияния заместителей
- •4.3. Многоядерные ароматические соединения с неконденсированными и конденсированными бензольными ядрами
- •4.3.1. Основные способы получения
- •4.3.2. Химические особенности
- •Функциональные производные углеводородов
- •Глава 5 галогенопроизводные
- •5.1. Галогенопроизводные: определение, изомерия, номенклатура
- •5.2. Способы получения
- •5..3 Химические свойства
- •Глава 6 кислородсодержащие органические соединения
- •6.1. Спирты: определение, изомерия, номенклатура
- •6.1.1. Способы получения
- •6.1.2 Физические свойства спиртов
- •6.1.3. Химические свойства
- •6.1.4 Понятие о непредельных и многоатомных спиртах
- •6.2. Фенолы: определение, изомерия, номенклатура
- •16.2.1. Способы получения
- •6.2.2. Химические свойства
- •6.3. Простые эфиры: определение, изомерия, номенклатура
- •6.3.1. Способы получения
- •6.3.2. Химические свойства
- •6.3.3. Окись этилена (эпоксисоединения)
- •6.4. Оксосоединения (альдегиды и кетоны)
- •6.4.1. Определение, изомерия и номенклатура оксосоединений
- •6.4.2. Способы получения
- •6.4.3. Химические свойства
- •6.4.4. Понятие о непредельных альдегидах и кетонах
- •6.4.5. Особенности получения и химические свойства хинонов
- •Задачи для самопроверки
- •6.5. Одно и многоосновные карбоновые кислоты и их производные: определение, изомерия, номенклатура
- •6.5.1. Способы получения
- •6.5.2. Химические свойства
- •6.5.3. Особенности предельных и непредельных кислот
- •Задачи для самопроверки
- •Глава 7. Серосодержащие соединения
- •7.1. Органические соединения двухвалентной серы (Тиолы, сульфиды, дисульфиды)
- •7.2. Сульфиновые кислоты и их производные
- •7.3. Сульфоновые кислоты и их производные. Сульфоны.
- •Глава 8. Азотсодержащие органические соединения
- •8.1 Нитросоединения: определение, изомерия, номенклатура.
- •8.1.1. Способы получения
- •8.1.2. Химические свойства
- •Задачи для самопроверки
- •8.2 Амины: определение, изомерия, номенклатура
- •8.2.1 Способы получения
- •8.2.2. Химические свойства
- •8.2.3. Понятие о диаминах
- •Задачи для самопроверки
- •8.3. Диазо- и азосоединения: определение, изомерия, номенклатура
- •8.3.1. Способы получения
- •8.3.2 Физические и химические свойства
- •II. Реакции без выделения азота
- •Задачи для самопроверки
- •Глава 9 . Гетерофункциональные соединеия
- •9.1. Гидроксикислоты: определение, изомерия, номенклатура
- •9.1.1. Способы получения
- •9.1.2. Химические свойства
- •9.1.3. Оптическая изомерия гидроксикислот
- •9.1.4. Ароматические гидроксикислоты и их производные
- •Задачи для самопроверки
- •9.2. Альдегидо- и кетокислоты: определение, изомерия, номенклатура
- •9.2.1. Способы получения
- •9.2.2. Химические особенности
- •9.2.3. Применение ацетоуксусного эфира в органическом синтезе
- •Задачи для самопроверки
- •9.3. Аминокислоты: определение, изомерия, номенклатура
- •9.3.1. Способы получения
- •9.3.2. Химические свойства
- •Задачи для самопроверки
- •Глава 10. Гетероциклические соединения
- •10.1. Определение и классификация гетероциклических соединений.
- •10.2. Пятичленные гетероциклические соединения: изомерия, номенклатура, ароматический характер.
- •10.2.1. Способы получения пятичленных гетероциклических соединений.
- •10.2.3. Химические свойства
- •10.3. Понятие о конденсированных гетероциклах (индол)
- •10.4. Шестичленные гетероциклические соединения: изомерия, номенклатура
- •10.4.1. Химические свойства.
- •Глава 11. Липиды
- •11.1.Определение, классификация изомерия, номенклатура
- •11.2. Простые липиды. (Жиры, масла)
- •10.3. Сложные липиды. Понятие о фосфолипидах.
- •10.4. Понятие о циклических липидах
- •Глава 12. Углеводы
- •12.1. Определение, классификация, изомерия, номенклатура.
- •12.2. Моносахариды: строение, оптическая изомерия.
- •12.3.Химические свойства моносахаридов.
- •12.4. Олигосахариды: особенности строения, химические свойства
- •12.5. Несахароподобные полисахариды: крахмал, гликоген, клетчатка.
- •Глава 13. Пептиды и белки
- •13.1. Протеиногенные аминокислоты
- •13.2. Понятие о строении пептидов.
- •13.3. Особенности строения белков
- •Глава 14. Нуклеиновые кислоты
- •14.1. Понятие о составе и строении нуклеиновых кислот
- •14.2. Классификация и биологическая роль нуклеиновых кислот
5..3 Химические свойства
Большинство галогенопроизводных углеводородов - весьма реакционноспособные соединения, широко применяемые в разнообразных синтезах. Это определяется тем, что атом любого галогена обладает большим сродством к электрону, чем атом углерода. σ-Связь C─Halg в галогеналкилах сильно поляризована, что приводит к возникновению пониженной электронной плотности на атоме углерода и повышенной на атоме галогена. Для органических молекул характерна так называемая поляризуемость, т.е. cпособность увеличивать полярность связи при подходе атакующего реагента. Поляризуемость связи тем больше, чем более объемиста и подвижна электронная оболочка атомов, образующих связь. Так, если полярность связей C-F, C-Cl, C-Br и C-J довольно близка, то поляризуемость связи C-J значительно больше, чем связи C-F. В точном соответствии с поляризуемостью во всех реакциях нуклеофильного замещения иодпроизводные максимально активны, а фторопроизводные практически не реакционноспособны.
На реакционную способность галогена оказывает большое влияние, и строение органического радикала. При нахождении галогена у углерода с кратной связью свободная электронная пара атома галогена сопряжена с π-электронами двойной связи:

Это проявляется в заметном укорачивании связи C–Cl от 0,176 до 0,169 нм вследствие дополнительного взаимодействия и в очень сильном уменьшении реакционной способности. Атомы галогена при двойной связи практически не реакционноспособны. Напротив, у атома галогена в аллильном положении реакционная способность резко увеличивается. Это объясняется тем, что способность таких соединений к диссоциации заметно повышена
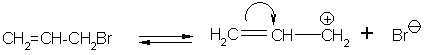
Образующийся аллильный карбкатион стабилизируется вследствие смещения π-электронной плотности на положительно заряженный атом углерода. Поэтому образование такого карбкатиона энергетически значительно более выгодно, чем алкилкатиона. Все реакции замещения аллильного галогена идут по механизму SN1 и их скорость на несколько порядков выше, чем для алкилгалогенидов. По той же причине, что и в хлористом виниле, атом галогена в бензольном ядре мало реакционноспособен, однако бензильный атом галогена, как и в бромистом аллиле, очень легко вступает в реакции нуклеофильного замещения.
Реакция гидролиза
При действии свежеприготовленной гидроокиси серебра или воды в присутствии щелочей галогеналкилы дают спирты

Для первичных и вторичных алкилгалогенидов механизм этих реакций SN2
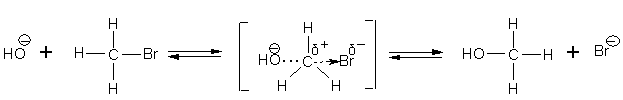
Отрицательно заряженная гидроксильная группа атакует положительно заряженный атом углерода со стороны, противоположной отрицательно заряженному атому брома. При наличии достаточной энергии гидроксил приближается настолько, что между ним и атомом углерода начинает образовываться связь, а связь между атомами углерода и брома начинает разрываться. В этом переходном состоянии атом углерода и все три атома водорода находятся в одной плоскости (молекула «уплощена»). Затем анион брома выталкивается и образуется молекула метилового спирта. Такой процесс называется реакцией нуклеофильного замещения второго порядка (SN2): нуклеофильного потому, что атакующая частица заряжена отрицательно; второго порядка - потому что скорость реакции зависит от концентрации как бромистого метила, так и гидроксила.
У третичных алкилгалогенидов подход отрицательно заряженной частицы затруднен имеющимися объемными заместителями, и процесс идет по другому механизму:
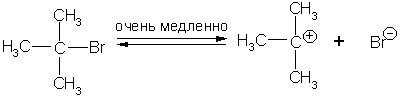
Хотя и в очень малой степени, но все же происходит процесс диссоциации третичного бромистого бутила. Образующийся третичный бутилкатион мгновенно реагирует с находящимися в растворе нуклеофильными частицами:
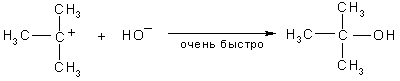
В этом случае скорость реакции зависит только от процесса диссоциации и, следовательно, от концентрации в реакционной смеси третичного бромистого бутила и реакция в целом называется реакцией нуклеофильного замещения первого порядка SN1.
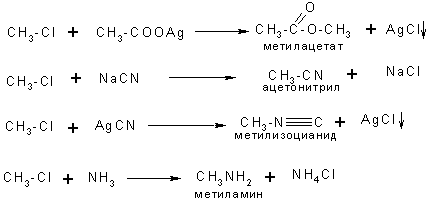
Реакции замещения
К реакциям замещения, протекающим по нуклеофильному механизму, относятся реакции замещения галогена на CN-группу, аминогруппу, нитрогруппу, водород и т. д.

Реакция β-элиминирования (отщепления).
При действии на алкилгалогениды спиртовыми растворами щелочей образуются алкены
![]()
Получение магнийорганических соединений.
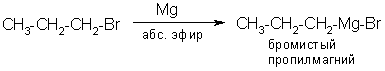
Реакции по бензольному кольцу
Галогены ведут себя как ориентанты первого рода, хотя и затрудняют реакции электрофильного замещения
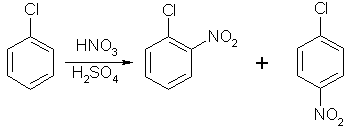
Реакции замещения галогена в бензольном ядре.
Галоген в бензольном кольце малоподвижен, но его способность к реакциям нуклеофильного замещения резко увеличивается при наличии в ядре сильных электроноакцепторных заместителей.

Понятие об инсектицидах
Некоторые галогенопроизводные: 4,4′-дихлордифенилтрихлорэтан (ДДТ), гексахлорциклогексан (гексахлоран) и другие относятся к так называемым инсектицидам – химическим веществам, применяемым для борьбы с вредными насекомыми. Инсектициды в виде порошков или растворов вносят в почву вместе с семенами или распыляют с самолетов. Они являются эффективным средством борьбы с вредителями с\х растений. В то же время их применение требует большой осторожности, так как они могут уничтожить полезную микрофлору, а попадая в организм человека и животных, оказывают вредное воздействие.
Фреоны
Большое применение в технике охлаждения получили полифторхлоруглероды (фреоны).
Производные метана обозначаются двухзначными, а производные этана – трехзначными цифрами. Последняя цифра обозначает число атомов фтора, предпоследняя водорода, причем 1 обозначает отсутствие атомов водорода, Например:
F-12: дифтордихлорметан CCl2F2
F-114: 1,1,2,2,- тетрафтордихлорэтан CClF2-CClF2
Фреоны – очень устойчивые соединения, они не гидролизуются, поэтому не корродируют металлы, используются как хладоагенты, как растворители инсектофунгицидов и как промежуточные продукты в синтезе фторпроизводных.
Наиболее распространенный фреон-12 получают из СCl4 и HF в присутствии SbF5 как катализатора:
![]()
Важное применение получил фторотан СF3-CHClBr – бесцветная тяжелая жидкость с запахом, напоминающим хлороформ. Это одно из самых эффективных средств для общего наркоза.
Широкое применение фреонов в технике и в быту создало угрозу для существования в стратосфере озонового слоя, защищающего Землю от жесткого ультрафиолетового излучения. Пары галогенопроизводных фотохимически расщепляются в стратосфере с образованием атомов галогенов, которые вызывают превращение озона в кислород.
Задачи для самопроверки
1. К раствору 20 г кристаллической соды в 100 см3 воды прибавили 8 г этилового спирта и нагрели на водяной бане до 70 оС. В нагретую смесь при перемешивании внесли небольшими порциями 10 г измельченного йода. После внесения всего йода и полного обесцвечивания смеси нагрев прекратили. Через несколько часов из охлажденной смеси выделился осадок йодоформа, который промыли водой до отрицательной реакции на йодид-ион и высушили в темном месте при температуре не выше 30 оС. Выход целевого продукта составил 25 % от теоретического. Сколько г йодоформа было получено?
2. Вицинальные дигалогенопроизводные можно получить действием пентагалогенида фосфора на соответсвующие кетоны или альдегиды. Определить выход 1,1-дихлорэтана, если при взаимодействии 20 г ацетальдегида со 100 г пентахлорида фосфора было получено 20 г дихлорэтана.
3. В двугорлой колбе с обратным холодильником и капельной воронкой тщательно смешали 20 г нитрита серебра с 50 г мелкого песка. Затем постепенно добавили из капельной воронки 20 г 2-йодпропана. Добавление йодпропана проводили таким образом, чтобы реакционная смесь все время слабо кипела. Для доведения реакции до конца смесь прогрели еще 30 минут, затем охладили колбу, заменили обратный холодильник на нисходящий и отогнали на водяной бане 2-нитропропан. Сколько г целевого продукта получилось, если его выход составил 30%.
4. Смесь, состоящую из 20 г хлористого бензила, 30 г диэтиламина и 15 г поташа, прокипятили в течение 3 часов на водяной бане в колбе с обратным холодильником. Избыток диэтиламина отогнали, к остатку добавили 120 см3 воды и перемешали до растворения минеральных солей. Диэтилбензиламин экстрагировали 40 см3 бензола и высушили над прокаленным К2СО3. Бензол отогнали на водяной бане, а остаток в вакууме (tкип = 92 оС при 13 мм. рт. ст). Получили 8 г диэтилбензиламина. Определить выход в %.
5. Назовите соединение по международной номенклатуре:
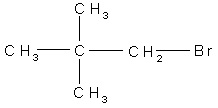
6. Сравните подвижность атома галогена в реакциях щелочного гидролиза для следующих соединений:
![]()
В ответе укажите относительную молекулярную массу соединения с наиболее подвижным атомом галогена.
