- •Глава 1 введение
- •1.2 Основные сырьевые источники органических соединений
- •1.3 Классификация органических соединений
- •1.4 Номенклатура органических соединений
- •1.4.1 Тривиальная номенклатура
- •1.4.2 Рациональная номенклатура
- •1.4.3 Номенклатура июпак
- •1.4.3.1. Номенклатура июпак для алифатических углеводородов.
- •Глава 2 теоретические представления в органической химии
- •2.1 Типы химических связей
- •2.2 Образование ковалентных связей атомами углерода (σ- и π-ковалентные связи)
- •2.3 Общие представления о механизмах химических реакций
- •2.3.1 Свободнорадикальные реакции
- •2.3.2 Ионные реакции
- •2.4 Пространственное расположение атомов в молекуле. Конформация молекул
- •Глава 3 алифатические углеводороды алканы,алкены, алкины и алкадиены
- •3.1 Алканы: определениек,изомерия и номенклатура
- •3.1.2 Способы получения алканов
- •3.1.3 Химические свойства
- •Радикальное галогенирование
- •Нитрование
- •Сульфирование, сульфоокисление, сульфохлорирование
- •Окисление
- •Крекинг углеводородов при высоких температурах
- •Задачи для самопроверки
- •3.2 Алкены: определение, изомерия, номенклатура
- •3.2.1 Способы получения
- •3.2.2 Химические свойства
- •3.3. Алкадиены: определение, изомерия, номенклатура
- •3.3.1 Способы получения важнейших диенов
- •3.3.2 Химические особенности 1,3-алкадиенов
- •3.4. Алкины: определение, изомерия, номенклатура
- •3.4.1. Способы получения.
- •3.4.2. Химические свойства
- •Глава 4 карбоциклические соединения
- •4.1. Алициклический ряд: определение, изомерия, номенклатура
- •4.1.1 Способы получения
- •4.1.2. Химические свойства
- •4.1.3. Современные представления о строении моноциклоалканов.
- •4.2. Ароматические углеводороды
- •4.2.1. Строение бензола
- •4.2.2. Способы получения
- •4.2.3. Химические свойства
- •4.3.4. Правила ориентации в бензольном кольце
- •4.2.5. Механизм ориентирующего влияния заместителей
- •4.3. Многоядерные ароматические соединения с неконденсированными и конденсированными бензольными ядрами
- •4.3.1. Основные способы получения
- •4.3.2. Химические особенности
- •Функциональные производные углеводородов
- •Глава 5 галогенопроизводные
- •5.1. Галогенопроизводные: определение, изомерия, номенклатура
- •5.2. Способы получения
- •5..3 Химические свойства
- •Глава 6 кислородсодержащие органические соединения
- •6.1. Спирты: определение, изомерия, номенклатура
- •6.1.1. Способы получения
- •6.1.2 Физические свойства спиртов
- •6.1.3. Химические свойства
- •6.1.4 Понятие о непредельных и многоатомных спиртах
- •6.2. Фенолы: определение, изомерия, номенклатура
- •16.2.1. Способы получения
- •6.2.2. Химические свойства
- •6.3. Простые эфиры: определение, изомерия, номенклатура
- •6.3.1. Способы получения
- •6.3.2. Химические свойства
- •6.3.3. Окись этилена (эпоксисоединения)
- •6.4. Оксосоединения (альдегиды и кетоны)
- •6.4.1. Определение, изомерия и номенклатура оксосоединений
- •6.4.2. Способы получения
- •6.4.3. Химические свойства
- •6.4.4. Понятие о непредельных альдегидах и кетонах
- •6.4.5. Особенности получения и химические свойства хинонов
- •Задачи для самопроверки
- •6.5. Одно и многоосновные карбоновые кислоты и их производные: определение, изомерия, номенклатура
- •6.5.1. Способы получения
- •6.5.2. Химические свойства
- •6.5.3. Особенности предельных и непредельных кислот
- •Задачи для самопроверки
- •Глава 7. Серосодержащие соединения
- •7.1. Органические соединения двухвалентной серы (Тиолы, сульфиды, дисульфиды)
- •7.2. Сульфиновые кислоты и их производные
- •7.3. Сульфоновые кислоты и их производные. Сульфоны.
- •Глава 8. Азотсодержащие органические соединения
- •8.1 Нитросоединения: определение, изомерия, номенклатура.
- •8.1.1. Способы получения
- •8.1.2. Химические свойства
- •Задачи для самопроверки
- •8.2 Амины: определение, изомерия, номенклатура
- •8.2.1 Способы получения
- •8.2.2. Химические свойства
- •8.2.3. Понятие о диаминах
- •Задачи для самопроверки
- •8.3. Диазо- и азосоединения: определение, изомерия, номенклатура
- •8.3.1. Способы получения
- •8.3.2 Физические и химические свойства
- •II. Реакции без выделения азота
- •Задачи для самопроверки
- •Глава 9 . Гетерофункциональные соединеия
- •9.1. Гидроксикислоты: определение, изомерия, номенклатура
- •9.1.1. Способы получения
- •9.1.2. Химические свойства
- •9.1.3. Оптическая изомерия гидроксикислот
- •9.1.4. Ароматические гидроксикислоты и их производные
- •Задачи для самопроверки
- •9.2. Альдегидо- и кетокислоты: определение, изомерия, номенклатура
- •9.2.1. Способы получения
- •9.2.2. Химические особенности
- •9.2.3. Применение ацетоуксусного эфира в органическом синтезе
- •Задачи для самопроверки
- •9.3. Аминокислоты: определение, изомерия, номенклатура
- •9.3.1. Способы получения
- •9.3.2. Химические свойства
- •Задачи для самопроверки
- •Глава 10. Гетероциклические соединения
- •10.1. Определение и классификация гетероциклических соединений.
- •10.2. Пятичленные гетероциклические соединения: изомерия, номенклатура, ароматический характер.
- •10.2.1. Способы получения пятичленных гетероциклических соединений.
- •10.2.3. Химические свойства
- •10.3. Понятие о конденсированных гетероциклах (индол)
- •10.4. Шестичленные гетероциклические соединения: изомерия, номенклатура
- •10.4.1. Химические свойства.
- •Глава 11. Липиды
- •11.1.Определение, классификация изомерия, номенклатура
- •11.2. Простые липиды. (Жиры, масла)
- •10.3. Сложные липиды. Понятие о фосфолипидах.
- •10.4. Понятие о циклических липидах
- •Глава 12. Углеводы
- •12.1. Определение, классификация, изомерия, номенклатура.
- •12.2. Моносахариды: строение, оптическая изомерия.
- •12.3.Химические свойства моносахаридов.
- •12.4. Олигосахариды: особенности строения, химические свойства
- •12.5. Несахароподобные полисахариды: крахмал, гликоген, клетчатка.
- •Глава 13. Пептиды и белки
- •13.1. Протеиногенные аминокислоты
- •13.2. Понятие о строении пептидов.
- •13.3. Особенности строения белков
- •Глава 14. Нуклеиновые кислоты
- •14.1. Понятие о составе и строении нуклеиновых кислот
- •14.2. Классификация и биологическая роль нуклеиновых кислот
Глава 9 . Гетерофункциональные соединеия
9.1. Гидроксикислоты: определение, изомерия, номенклатура
Вещества, в молекулах которых содержится несколько разных функциональных групп, принято называть соединениями с разнородными (смешанными) функциями или гетерофункциональными.
Наибольшее значение среди классов соединений со смешанными функциями имеют функционально замещенные кислоты (гидроксикислоты, альдо- и кетокислоты, аминокислоты). Эти вещества играют значительную роль в процессах жизнедеятельности, а также в технологических процессах, используемых в пищевой промышленности.
Отдельные функциональные группы, входящие в состав гетерофункциональных соединений обычно проявляют типичную для них реакционную способность. Вместе с тем, в этих соединениях проявляется взаимное влияние функций друг на друга, зависящее от их взаимного расположения. Это влияние является главным при изучении химии соединений со смешанными функциями. Рассмотрим кислородсодержащие соединения со смешанными функциями.
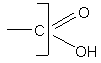
Гидроксикислоты.
Гидроксикислотами называют вещества, в молекулах которых присутствуют две функции – гидроксильная и карбоксильная.
У гетерофункциональных соединений, и в том числе у оксикислот, возможно несколько типов структурной изомерии:
- изомерия углеродного скелета;
- изомерия положения;
- изомерия взаимного положения.
Например, для гидроксибутановой кислоты существует пять структурных изомеров

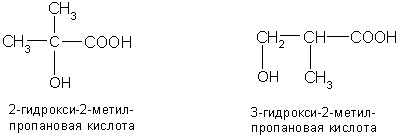
В
зависимости от числа карбоксильных
групп гидроксикислоты бывают одноосновными,
двухосновными и т. д. В зависимости от
числа гидроксильных групп –
двухатомными, трехатомными и т.д., причем
учитывается и гидроксил, входящий в
состав карбоксила. Таким образом,
молочная кислота
![]() является
одноосновной двухатомной кислотой.
является
одноосновной двухатомной кислотой.
В зависимости от положения гидроксильной группы по отношению к карбоксильной, различают α, β, и другие кислоты.
Номенклатура гидрокси- и оксокислот.
В настоящее время названия гетерофункциональных соединений строятся на основе названий монофункциональных соединений (систематических или рациональных), причем дополнительная функциональная группа показывается как заместитель с указанием ее положения в углеродной цепи.
Простейшие соединения сохранили тривиальные названия.

Таблица – Название функциональных групп в гетерофункциональных соединениях
Функциональная группа |
Название группы |
|
Как дополнительной |
Как основной |
|
|
карбокси |
−овая кислота |
|
оксо |
аль |
|
оксо |
он |
|
гидрокси (окси) |
ол |
] – углерод функциональной группы входит в состав основной углеродной цепи.
9.1.1. Способы получения
Гидроксикислоты можно получить из кислот введением гидроксильной группы и из спиртов введением карбоксильной группы. Разберем наиболее важные способы:
1. Гидролиз галогензамещенных кислот. При нагревании с водой галоген легко замещается гидроксилом:

2. Получение из карбонильных соединений через стадию образования оксинитрилов:

3. β-Гидроксикислоты чаще всего получают из эфиров α-галогензамещенных кислот по реакции Реформатского. Действием цинка на смесь карбонильного соединения с эфиром α-галогензамещенной кислоты получают цинковый алкоголят эфира β-гидроксикислоты, который легко гидролизуется:

4. β-гидроксикислоты получают присоединением воды к непредельным кислотам:
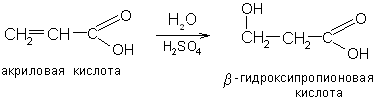
5. Окислением оксиальдегидов или гликолей

Физические свойства
Гидроксикислоты большей частью кристаллические вещества, и только простейшие из них жидкости. В воде они растворимы лучше, чем соответствующие карбоновые кислоты, не содержащие гидроокисла. Низшие гидроксикислоты смешиваются с водой в любых соотношениях. Гидроксикислоты плавятся при значительно более высоких температурах, чем жирные кислоты. По сравнению с последними гидроксикислоты (особенно α-гидроксикислоты) имеют более высокую константу диссоциации.