
- •Глава 1 введение
- •1.2 Основные сырьевые источники органических соединений
- •1.3 Классификация органических соединений
- •1.4 Номенклатура органических соединений
- •1.4.1 Тривиальная номенклатура
- •1.4.2 Рациональная номенклатура
- •1.4.3 Номенклатура июпак
- •1.4.3.1. Номенклатура июпак для алифатических углеводородов.
- •Глава 2 теоретические представления в органической химии
- •2.1 Типы химических связей
- •2.2 Образование ковалентных связей атомами углерода (σ- и π-ковалентные связи)
- •2.3 Общие представления о механизмах химических реакций
- •2.3.1 Свободнорадикальные реакции
- •2.3.2 Ионные реакции
- •2.4 Пространственное расположение атомов в молекуле. Конформация молекул
- •Глава 3 алифатические углеводороды алканы,алкены, алкины и алкадиены
- •3.1 Алканы: определениек,изомерия и номенклатура
- •3.1.2 Способы получения алканов
- •3.1.3 Химические свойства
- •Радикальное галогенирование
- •Нитрование
- •Сульфирование, сульфоокисление, сульфохлорирование
- •Окисление
- •Крекинг углеводородов при высоких температурах
- •Задачи для самопроверки
- •3.2 Алкены: определение, изомерия, номенклатура
- •3.2.1 Способы получения
- •3.2.2 Химические свойства
- •3.3. Алкадиены: определение, изомерия, номенклатура
- •3.3.1 Способы получения важнейших диенов
- •3.3.2 Химические особенности 1,3-алкадиенов
- •3.4. Алкины: определение, изомерия, номенклатура
- •3.4.1. Способы получения.
- •3.4.2. Химические свойства
- •Глава 4 карбоциклические соединения
- •4.1. Алициклический ряд: определение, изомерия, номенклатура
- •4.1.1 Способы получения
- •4.1.2. Химические свойства
- •4.1.3. Современные представления о строении моноциклоалканов.
- •4.2. Ароматические углеводороды
- •4.2.1. Строение бензола
- •4.2.2. Способы получения
- •4.2.3. Химические свойства
- •4.3.4. Правила ориентации в бензольном кольце
- •4.2.5. Механизм ориентирующего влияния заместителей
- •4.3. Многоядерные ароматические соединения с неконденсированными и конденсированными бензольными ядрами
- •4.3.1. Основные способы получения
- •4.3.2. Химические особенности
- •Функциональные производные углеводородов
- •Глава 5 галогенопроизводные
- •5.1. Галогенопроизводные: определение, изомерия, номенклатура
- •5.2. Способы получения
- •5..3 Химические свойства
- •Глава 6 кислородсодержащие органические соединения
- •6.1. Спирты: определение, изомерия, номенклатура
- •6.1.1. Способы получения
- •6.1.2 Физические свойства спиртов
- •6.1.3. Химические свойства
- •6.1.4 Понятие о непредельных и многоатомных спиртах
- •6.2. Фенолы: определение, изомерия, номенклатура
- •16.2.1. Способы получения
- •6.2.2. Химические свойства
- •6.3. Простые эфиры: определение, изомерия, номенклатура
- •6.3.1. Способы получения
- •6.3.2. Химические свойства
- •6.3.3. Окись этилена (эпоксисоединения)
- •6.4. Оксосоединения (альдегиды и кетоны)
- •6.4.1. Определение, изомерия и номенклатура оксосоединений
- •6.4.2. Способы получения
- •6.4.3. Химические свойства
- •6.4.4. Понятие о непредельных альдегидах и кетонах
- •6.4.5. Особенности получения и химические свойства хинонов
- •Задачи для самопроверки
- •6.5. Одно и многоосновные карбоновые кислоты и их производные: определение, изомерия, номенклатура
- •6.5.1. Способы получения
- •6.5.2. Химические свойства
- •6.5.3. Особенности предельных и непредельных кислот
- •Задачи для самопроверки
- •Глава 7. Серосодержащие соединения
- •7.1. Органические соединения двухвалентной серы (Тиолы, сульфиды, дисульфиды)
- •7.2. Сульфиновые кислоты и их производные
- •7.3. Сульфоновые кислоты и их производные. Сульфоны.
- •Глава 8. Азотсодержащие органические соединения
- •8.1 Нитросоединения: определение, изомерия, номенклатура.
- •8.1.1. Способы получения
- •8.1.2. Химические свойства
- •Задачи для самопроверки
- •8.2 Амины: определение, изомерия, номенклатура
- •8.2.1 Способы получения
- •8.2.2. Химические свойства
- •8.2.3. Понятие о диаминах
- •Задачи для самопроверки
- •8.3. Диазо- и азосоединения: определение, изомерия, номенклатура
- •8.3.1. Способы получения
- •8.3.2 Физические и химические свойства
- •II. Реакции без выделения азота
- •Задачи для самопроверки
- •Глава 9 . Гетерофункциональные соединеия
- •9.1. Гидроксикислоты: определение, изомерия, номенклатура
- •9.1.1. Способы получения
- •9.1.2. Химические свойства
- •9.1.3. Оптическая изомерия гидроксикислот
- •9.1.4. Ароматические гидроксикислоты и их производные
- •Задачи для самопроверки
- •9.2. Альдегидо- и кетокислоты: определение, изомерия, номенклатура
- •9.2.1. Способы получения
- •9.2.2. Химические особенности
- •9.2.3. Применение ацетоуксусного эфира в органическом синтезе
- •Задачи для самопроверки
- •9.3. Аминокислоты: определение, изомерия, номенклатура
- •9.3.1. Способы получения
- •9.3.2. Химические свойства
- •Задачи для самопроверки
- •Глава 10. Гетероциклические соединения
- •10.1. Определение и классификация гетероциклических соединений.
- •10.2. Пятичленные гетероциклические соединения: изомерия, номенклатура, ароматический характер.
- •10.2.1. Способы получения пятичленных гетероциклических соединений.
- •10.2.3. Химические свойства
- •10.3. Понятие о конденсированных гетероциклах (индол)
- •10.4. Шестичленные гетероциклические соединения: изомерия, номенклатура
- •10.4.1. Химические свойства.
- •Глава 11. Липиды
- •11.1.Определение, классификация изомерия, номенклатура
- •11.2. Простые липиды. (Жиры, масла)
- •10.3. Сложные липиды. Понятие о фосфолипидах.
- •10.4. Понятие о циклических липидах
- •Глава 12. Углеводы
- •12.1. Определение, классификация, изомерия, номенклатура.
- •12.2. Моносахариды: строение, оптическая изомерия.
- •12.3.Химические свойства моносахаридов.
- •12.4. Олигосахариды: особенности строения, химические свойства
- •12.5. Несахароподобные полисахариды: крахмал, гликоген, клетчатка.
- •Глава 13. Пептиды и белки
- •13.1. Протеиногенные аминокислоты
- •13.2. Понятие о строении пептидов.
- •13.3. Особенности строения белков
- •Глава 14. Нуклеиновые кислоты
- •14.1. Понятие о составе и строении нуклеиновых кислот
- •14.2. Классификация и биологическая роль нуклеиновых кислот
Функциональные производные углеводородов
Глава 5 галогенопроизводные
5.1. Галогенопроизводные: определение, изомерия, номенклатура
Галогенопроизводными называются органические соединения, образующиеся при замене атомов водорода в углеводородах на атомы галогенов.
В зависимости от числа атомов водорода, замещенных галогеном, различают моно-, ди-, три- и поли - галогенопроизводные.
СН3Cl, CH2Cl2, CHCl3 CCl4
хлористый метил хлористый метилен хлороформ четыреххлористый
углерод
В зависимости от характера органического радикала, связанного с галогеном, различают насыщенные, ненасыщенные, алифатические, алициклические, ароматические галогенопроизводные:

Названия простейших моногалогенопроизводных производят от названий соответствующих одновалентных радикалов прибавлением слова хлористый, бромистый, фтористый, йодистый.
Изомерия моногалогенопроизводных обусловлена строением углеродного скелета и положением атома галогена. В полигалогенопроизводных появляется еще одна причина: взаимное расположение галогенов в молекуле.
Галогенопроизводное считается первичным, если галоген связан с первичным атомом углерода, вторичным – если связан со вторичным, третичным - если с третичным.
Галогенопроизводные, у которых все имеющиеся в молекуле атомы водорода замещены на галоген, называется – пергалогенпроизводными :
CF3-CF3, CF2=CF2
перфторэтан перфторэтилен
По номенклатуре ИЮПАК галоген в названии указывается как заместитель с обозначением его положения в цепи цифрой (см. главу 1).
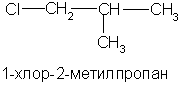
5.2. Способы получения
1. Замещение атомов водорода в углеводородах на галоген
а) галогенирование предельных углеводородов протекает по радикальному механизму при облучении:
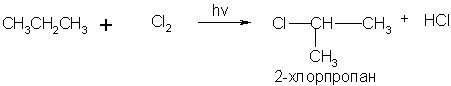
Замещение может идти и дальше.
Фтористые алкилы получают обычно действием фтористого серебра на йодистые алкилы:

или действием на алканы CoF3 – последний при 200 оС медленно выделяет F2 :
2CoF3
![]() →
2CoF2
+ F2
→
2CoF2
+ F2
CH3-CН3 + 12CоF3 → CF3-CF3 + 6HF + 12 CоF2
б) бензол и его гомологи галогенируются легче, чем алканы. Причем на холоде и в присутствии катализатора (хлоридов тяжелых металлов) галоген замещает атомы водорода в бензольном ядре, а при нагревании или на свету в отсутствии катализатора замещаются атомы водорода в боковой цепи:

в). При высоких температурах (400 – 600 оС) удается заместить атомы водорода в алкенах, не нарушая кратной связи:
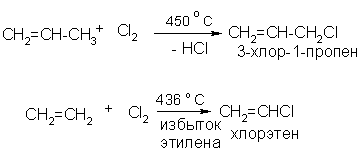
2. Присоединение галогенов или галогеноводородов к ненасыщенным углеводородам:

3. Получение галогенопроизводных из спиртов. Чаще всего на спирты действуют галогенидами фосфора, серы, а также галогеноводородными кислотами в присутствии водоотнимающих средств:
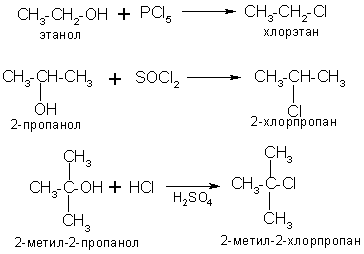
4. Общий метод синтеза дигалогенопроизводных – это действие пентахлорида или пентабромида фосфора на альдегиды и кетоны:
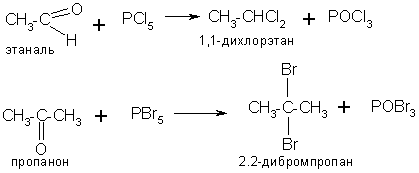
При этом получаются соединения с двумя атомами галогена при одном атоме углерода.
5. Хлороформ, бромоформ, йодоформ можно получить действием соответствующего галогена в щелочном растворе на ацетальдегид
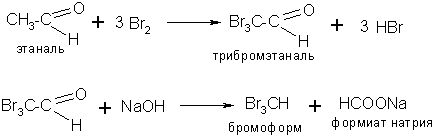
Физические свойства
Низшие алкилгалогениды – газообразные вещества, средние – жидкости, высшие – твердые тела. Физические свойства галогенопроизводных зависят от строения радикала, вида и количества атомов галогена в молекуле. С увеличением длины углеродной цепочки и с переходом от фтора к йоду температура кипения и плотность моногалогенопроизводных возрастает. Дигалогенопроизводные – тяжелые масла или твердые вещества. Все галогенопроизводные практически нерастворимы в воде, хорошо растворимы в органических растворителях, большинство имеют специфический, часто резкий запах, раздражающий слизистую оболочку, некоторые обладают анестезирующим действием (СН2Сl2, СНСl3), токсичны, являются антисептиками (СНJ3).
