
- •Глава 1 введение
- •1.2 Основные сырьевые источники органических соединений
- •1.3 Классификация органических соединений
- •1.4 Номенклатура органических соединений
- •1.4.1 Тривиальная номенклатура
- •1.4.2 Рациональная номенклатура
- •1.4.3 Номенклатура июпак
- •1.4.3.1. Номенклатура июпак для алифатических углеводородов.
- •Глава 2 теоретические представления в органической химии
- •2.1 Типы химических связей
- •2.2 Образование ковалентных связей атомами углерода (σ- и π-ковалентные связи)
- •2.3 Общие представления о механизмах химических реакций
- •2.3.1 Свободнорадикальные реакции
- •2.3.2 Ионные реакции
- •2.4 Пространственное расположение атомов в молекуле. Конформация молекул
- •Глава 3 алифатические углеводороды алканы,алкены, алкины и алкадиены
- •3.1 Алканы: определениек,изомерия и номенклатура
- •3.1.2 Способы получения алканов
- •3.1.3 Химические свойства
- •Радикальное галогенирование
- •Нитрование
- •Сульфирование, сульфоокисление, сульфохлорирование
- •Окисление
- •Крекинг углеводородов при высоких температурах
- •Задачи для самопроверки
- •3.2 Алкены: определение, изомерия, номенклатура
- •3.2.1 Способы получения
- •3.2.2 Химические свойства
- •3.3. Алкадиены: определение, изомерия, номенклатура
- •3.3.1 Способы получения важнейших диенов
- •3.3.2 Химические особенности 1,3-алкадиенов
- •3.4. Алкины: определение, изомерия, номенклатура
- •3.4.1. Способы получения.
- •3.4.2. Химические свойства
- •Глава 4 карбоциклические соединения
- •4.1. Алициклический ряд: определение, изомерия, номенклатура
- •4.1.1 Способы получения
- •4.1.2. Химические свойства
- •4.1.3. Современные представления о строении моноциклоалканов.
- •4.2. Ароматические углеводороды
- •4.2.1. Строение бензола
- •4.2.2. Способы получения
- •4.2.3. Химические свойства
- •4.3.4. Правила ориентации в бензольном кольце
- •4.2.5. Механизм ориентирующего влияния заместителей
- •4.3. Многоядерные ароматические соединения с неконденсированными и конденсированными бензольными ядрами
- •4.3.1. Основные способы получения
- •4.3.2. Химические особенности
- •Функциональные производные углеводородов
- •Глава 5 галогенопроизводные
- •5.1. Галогенопроизводные: определение, изомерия, номенклатура
- •5.2. Способы получения
- •5..3 Химические свойства
- •Глава 6 кислородсодержащие органические соединения
- •6.1. Спирты: определение, изомерия, номенклатура
- •6.1.1. Способы получения
- •6.1.2 Физические свойства спиртов
- •6.1.3. Химические свойства
- •6.1.4 Понятие о непредельных и многоатомных спиртах
- •6.2. Фенолы: определение, изомерия, номенклатура
- •16.2.1. Способы получения
- •6.2.2. Химические свойства
- •6.3. Простые эфиры: определение, изомерия, номенклатура
- •6.3.1. Способы получения
- •6.3.2. Химические свойства
- •6.3.3. Окись этилена (эпоксисоединения)
- •6.4. Оксосоединения (альдегиды и кетоны)
- •6.4.1. Определение, изомерия и номенклатура оксосоединений
- •6.4.2. Способы получения
- •6.4.3. Химические свойства
- •6.4.4. Понятие о непредельных альдегидах и кетонах
- •6.4.5. Особенности получения и химические свойства хинонов
- •Задачи для самопроверки
- •6.5. Одно и многоосновные карбоновые кислоты и их производные: определение, изомерия, номенклатура
- •6.5.1. Способы получения
- •6.5.2. Химические свойства
- •6.5.3. Особенности предельных и непредельных кислот
- •Задачи для самопроверки
- •Глава 7. Серосодержащие соединения
- •7.1. Органические соединения двухвалентной серы (Тиолы, сульфиды, дисульфиды)
- •7.2. Сульфиновые кислоты и их производные
- •7.3. Сульфоновые кислоты и их производные. Сульфоны.
- •Глава 8. Азотсодержащие органические соединения
- •8.1 Нитросоединения: определение, изомерия, номенклатура.
- •8.1.1. Способы получения
- •8.1.2. Химические свойства
- •Задачи для самопроверки
- •8.2 Амины: определение, изомерия, номенклатура
- •8.2.1 Способы получения
- •8.2.2. Химические свойства
- •8.2.3. Понятие о диаминах
- •Задачи для самопроверки
- •8.3. Диазо- и азосоединения: определение, изомерия, номенклатура
- •8.3.1. Способы получения
- •8.3.2 Физические и химические свойства
- •II. Реакции без выделения азота
- •Задачи для самопроверки
- •Глава 9 . Гетерофункциональные соединеия
- •9.1. Гидроксикислоты: определение, изомерия, номенклатура
- •9.1.1. Способы получения
- •9.1.2. Химические свойства
- •9.1.3. Оптическая изомерия гидроксикислот
- •9.1.4. Ароматические гидроксикислоты и их производные
- •Задачи для самопроверки
- •9.2. Альдегидо- и кетокислоты: определение, изомерия, номенклатура
- •9.2.1. Способы получения
- •9.2.2. Химические особенности
- •9.2.3. Применение ацетоуксусного эфира в органическом синтезе
- •Задачи для самопроверки
- •9.3. Аминокислоты: определение, изомерия, номенклатура
- •9.3.1. Способы получения
- •9.3.2. Химические свойства
- •Задачи для самопроверки
- •Глава 10. Гетероциклические соединения
- •10.1. Определение и классификация гетероциклических соединений.
- •10.2. Пятичленные гетероциклические соединения: изомерия, номенклатура, ароматический характер.
- •10.2.1. Способы получения пятичленных гетероциклических соединений.
- •10.2.3. Химические свойства
- •10.3. Понятие о конденсированных гетероциклах (индол)
- •10.4. Шестичленные гетероциклические соединения: изомерия, номенклатура
- •10.4.1. Химические свойства.
- •Глава 11. Липиды
- •11.1.Определение, классификация изомерия, номенклатура
- •11.2. Простые липиды. (Жиры, масла)
- •10.3. Сложные липиды. Понятие о фосфолипидах.
- •10.4. Понятие о циклических липидах
- •Глава 12. Углеводы
- •12.1. Определение, классификация, изомерия, номенклатура.
- •12.2. Моносахариды: строение, оптическая изомерия.
- •12.3.Химические свойства моносахаридов.
- •12.4. Олигосахариды: особенности строения, химические свойства
- •12.5. Несахароподобные полисахариды: крахмал, гликоген, клетчатка.
- •Глава 13. Пептиды и белки
- •13.1. Протеиногенные аминокислоты
- •13.2. Понятие о строении пептидов.
- •13.3. Особенности строения белков
- •Глава 14. Нуклеиновые кислоты
- •14.1. Понятие о составе и строении нуклеиновых кислот
- •14.2. Классификация и биологическая роль нуклеиновых кислот
6.5.3. Особенности предельных и непредельных кислот
К двухосновным предельным кислотам относятся:

Эти кислоты получают теми же методами, что и одноосновные: окислением гликолей, омылением динитрилов и т.д.
Двухосновные кислоты – бесцветные кристаллические вещества, растворимые в воде.
Для многоосновных кислот характерны все реакции протекающие с одноосновными кислотами, причем возможно взаимодействие как по одной функциональной группе, так и по всем имеющимся группам. Например, двухосновные кислоты содержат две карбоксильные группы, поэтому они дают два ряда производных; средние и кислые соли, полные и неполные сложные эфиры.
Вместе с тем наличие двух карбоксилов в одной молекуле обусловливает некоторые особенности в химических свойствах двухосновных кислот.
1. В зависимости от взаимного расположения карбоксильных групп в углеродной цепи. Они по разному ведут себя при нагревании.
а) Щавелевая и малоновая кислоты и одно- и двухзамещенные гомологи последней при нагревании декарбоксилируются:
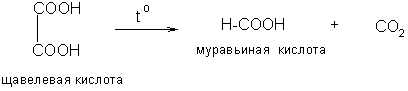

б) янтарная и глутаровая кислоты и их гомологи при нагревании образуют циклические ангидриды
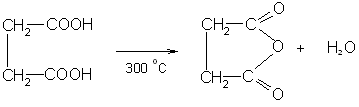
в) полный амид янтарной кислоты и ее гомологов при нагревании образуют имид:
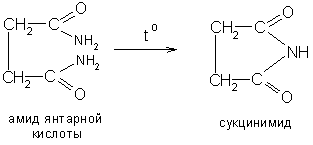
г) при пиролизе кальциевых или бариевых солей адипиновой, пимелиновой, пробковой кислот образуются циклические кетоны с отщеплением СО2:

2. В малоновой кислоте две карбоксильные группы, связанные с метиленовой группой, обуславливают на последней значительный недостаток электронной плотности, что приводит к повышению реакционной способности атомов водорода в этой группе. С участием этих атомов малоновая кислота вступает в различные реакции замещения.
В эфирах малоновой кислоты они легко замещаются атомами щелочных металлов:

Натриймалоновый эфир весьма устойчив и способен реагировать с различными галогенсодержащими соединениями. Это его свойство используется для синтеза различных карбоновых кислот.

Непредельные карбоновые кислоты
Появление кратной связи в радикале кислоты приводит к появлению свойств непредельных соединений. Т.е. эти кислоты способны как к превращениям по карбоксильной группе (диссоциация, образование солей, эфиров, ангидридов, галогенангидридов, амидов, нитрилов), так и по кратной связи (присоединение водорода, галогена, галогеноводорода, мягкое окисление и т.д.).
Простейшими представителями непредельных кислот являются:
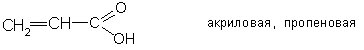


Вследствие взаимного влияния карбоксила и кратной связи присоединение галогеноводородов к α, β-непредельным кислотам происходит против правила Марковникова:
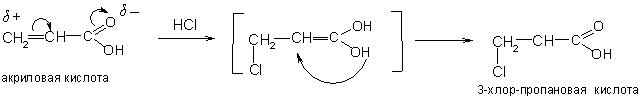
Наиболее простые ненасыщенные двухосновные кислоты – фумаровая и малеиновая. Они имеют одну и ту же структурную формулу, но разные пространственные конфигурации. Фумаровая – транс-, а малеиновая – цис- изомер:

Обе могут получаться при нагревании яблочной кислоты в зависимости от условий:
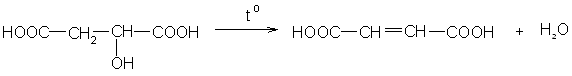
Малеиновую кислоту в промышленных масштабах получают при каталитическом окислении бензола или нафталина кислородом воздуха (см. главу «Ароматические углеводороды»).
Эти кислоты резко отличаются по физическим и некоторым химическим свойствам. Фумаровая кислота имеет температуру плавления 287-288оС, малеиновая кислота плавится при 130оС. Фумаровая кислота плохо растворима в воде, малеиновая – очень хорошо.
Эти кислоты сходны между собой по реакциям присоединения по месту двойной связи (водорода, галогена, галогеноводорода). Окисление фумаровой и малеиновой кислот слабыми окислителями (разбавленный раствор перманганата калия) приводит к винным кислотам.
Обе кислоты способны за счет карбоксильных групп образовывать соли, сложные эфиры, амиды и некоторые другие производные кислот. Однако фумаровая кислота не дает циклического ангидрида, а малеиновая его образует:

Малеиновая кислота под действием брома, йода, азотной кислоты легко переходит в более устойчивую форму – фумаровую кислоту. Обратный переход осуществляется под действием ультрафиолетовых лучей.
