
- •Глава 1 введение
- •1.2 Основные сырьевые источники органических соединений
- •1.3 Классификация органических соединений
- •1.4 Номенклатура органических соединений
- •1.4.1 Тривиальная номенклатура
- •1.4.2 Рациональная номенклатура
- •1.4.3 Номенклатура июпак
- •1.4.3.1. Номенклатура июпак для алифатических углеводородов.
- •Глава 2 теоретические представления в органической химии
- •2.1 Типы химических связей
- •2.2 Образование ковалентных связей атомами углерода (σ- и π-ковалентные связи)
- •2.3 Общие представления о механизмах химических реакций
- •2.3.1 Свободнорадикальные реакции
- •2.3.2 Ионные реакции
- •2.4 Пространственное расположение атомов в молекуле. Конформация молекул
- •Глава 3 алифатические углеводороды алканы,алкены, алкины и алкадиены
- •3.1 Алканы: определениек,изомерия и номенклатура
- •3.1.2 Способы получения алканов
- •3.1.3 Химические свойства
- •Радикальное галогенирование
- •Нитрование
- •Сульфирование, сульфоокисление, сульфохлорирование
- •Окисление
- •Крекинг углеводородов при высоких температурах
- •Задачи для самопроверки
- •3.2 Алкены: определение, изомерия, номенклатура
- •3.2.1 Способы получения
- •3.2.2 Химические свойства
- •3.3. Алкадиены: определение, изомерия, номенклатура
- •3.3.1 Способы получения важнейших диенов
- •3.3.2 Химические особенности 1,3-алкадиенов
- •3.4. Алкины: определение, изомерия, номенклатура
- •3.4.1. Способы получения.
- •3.4.2. Химические свойства
- •Глава 4 карбоциклические соединения
- •4.1. Алициклический ряд: определение, изомерия, номенклатура
- •4.1.1 Способы получения
- •4.1.2. Химические свойства
- •4.1.3. Современные представления о строении моноциклоалканов.
- •4.2. Ароматические углеводороды
- •4.2.1. Строение бензола
- •4.2.2. Способы получения
- •4.2.3. Химические свойства
- •4.3.4. Правила ориентации в бензольном кольце
- •4.2.5. Механизм ориентирующего влияния заместителей
- •4.3. Многоядерные ароматические соединения с неконденсированными и конденсированными бензольными ядрами
- •4.3.1. Основные способы получения
- •4.3.2. Химические особенности
- •Функциональные производные углеводородов
- •Глава 5 галогенопроизводные
- •5.1. Галогенопроизводные: определение, изомерия, номенклатура
- •5.2. Способы получения
- •5..3 Химические свойства
- •Глава 6 кислородсодержащие органические соединения
- •6.1. Спирты: определение, изомерия, номенклатура
- •6.1.1. Способы получения
- •6.1.2 Физические свойства спиртов
- •6.1.3. Химические свойства
- •6.1.4 Понятие о непредельных и многоатомных спиртах
- •6.2. Фенолы: определение, изомерия, номенклатура
- •16.2.1. Способы получения
- •6.2.2. Химические свойства
- •6.3. Простые эфиры: определение, изомерия, номенклатура
- •6.3.1. Способы получения
- •6.3.2. Химические свойства
- •6.3.3. Окись этилена (эпоксисоединения)
- •6.4. Оксосоединения (альдегиды и кетоны)
- •6.4.1. Определение, изомерия и номенклатура оксосоединений
- •6.4.2. Способы получения
- •6.4.3. Химические свойства
- •6.4.4. Понятие о непредельных альдегидах и кетонах
- •6.4.5. Особенности получения и химические свойства хинонов
- •Задачи для самопроверки
- •6.5. Одно и многоосновные карбоновые кислоты и их производные: определение, изомерия, номенклатура
- •6.5.1. Способы получения
- •6.5.2. Химические свойства
- •6.5.3. Особенности предельных и непредельных кислот
- •Задачи для самопроверки
- •Глава 7. Серосодержащие соединения
- •7.1. Органические соединения двухвалентной серы (Тиолы, сульфиды, дисульфиды)
- •7.2. Сульфиновые кислоты и их производные
- •7.3. Сульфоновые кислоты и их производные. Сульфоны.
- •Глава 8. Азотсодержащие органические соединения
- •8.1 Нитросоединения: определение, изомерия, номенклатура.
- •8.1.1. Способы получения
- •8.1.2. Химические свойства
- •Задачи для самопроверки
- •8.2 Амины: определение, изомерия, номенклатура
- •8.2.1 Способы получения
- •8.2.2. Химические свойства
- •8.2.3. Понятие о диаминах
- •Задачи для самопроверки
- •8.3. Диазо- и азосоединения: определение, изомерия, номенклатура
- •8.3.1. Способы получения
- •8.3.2 Физические и химические свойства
- •II. Реакции без выделения азота
- •Задачи для самопроверки
- •Глава 9 . Гетерофункциональные соединеия
- •9.1. Гидроксикислоты: определение, изомерия, номенклатура
- •9.1.1. Способы получения
- •9.1.2. Химические свойства
- •9.1.3. Оптическая изомерия гидроксикислот
- •9.1.4. Ароматические гидроксикислоты и их производные
- •Задачи для самопроверки
- •9.2. Альдегидо- и кетокислоты: определение, изомерия, номенклатура
- •9.2.1. Способы получения
- •9.2.2. Химические особенности
- •9.2.3. Применение ацетоуксусного эфира в органическом синтезе
- •Задачи для самопроверки
- •9.3. Аминокислоты: определение, изомерия, номенклатура
- •9.3.1. Способы получения
- •9.3.2. Химические свойства
- •Задачи для самопроверки
- •Глава 10. Гетероциклические соединения
- •10.1. Определение и классификация гетероциклических соединений.
- •10.2. Пятичленные гетероциклические соединения: изомерия, номенклатура, ароматический характер.
- •10.2.1. Способы получения пятичленных гетероциклических соединений.
- •10.2.3. Химические свойства
- •10.3. Понятие о конденсированных гетероциклах (индол)
- •10.4. Шестичленные гетероциклические соединения: изомерия, номенклатура
- •10.4.1. Химические свойства.
- •Глава 11. Липиды
- •11.1.Определение, классификация изомерия, номенклатура
- •11.2. Простые липиды. (Жиры, масла)
- •10.3. Сложные липиды. Понятие о фосфолипидах.
- •10.4. Понятие о циклических липидах
- •Глава 12. Углеводы
- •12.1. Определение, классификация, изомерия, номенклатура.
- •12.2. Моносахариды: строение, оптическая изомерия.
- •12.3.Химические свойства моносахаридов.
- •12.4. Олигосахариды: особенности строения, химические свойства
- •12.5. Несахароподобные полисахариды: крахмал, гликоген, клетчатка.
- •Глава 13. Пептиды и белки
- •13.1. Протеиногенные аминокислоты
- •13.2. Понятие о строении пептидов.
- •13.3. Особенности строения белков
- •Глава 14. Нуклеиновые кислоты
- •14.1. Понятие о составе и строении нуклеиновых кислот
- •14.2. Классификация и биологическая роль нуклеиновых кислот
6.3.1. Способы получения
Простые эфиры обычно получают следующими способами:
1) Реакция галогенопроизводных с алкоголятами – реакция Вильямсона:

2) Дегидратацией спиртов под влиянием кислот, чаще всего серной:
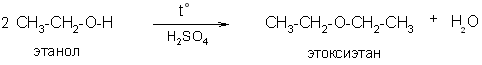
Физические свойства
Два первых представителя эфиров, демитиловый и метилэтиловый, при обычных условиях – газы. Все остальные простые эфиры – жидкости, которые кипят при температурах значительно более низких, чем соответствующие спирты. Это связано с отсутствием водородной связи между молекулами эфиров.
Эфиры плохо растворимы в воде, их плотность ниже единицы, они обладают приятным запахом.
6.3.2. Химические свойства
Реакционная способность эфиров невелика. Они не изменяются при нагревании с водой, щелочами, разбавленными кислотами.
1) Эфиры, в отличие от спиртов, с металлическим натрием реагируют только при нагревании и без выделения водорода:

2) Концентрированные йодистоводородная и серная кислоты разлагают простые эфиры:

3) Эфиры растворяются в концентрированных протонных кислотах (HCl, HBr) с выделением тепла. При этом образуются непрочные соединения солеобразного характера – оксониевые соединеия.

Образующиеся комплексные соли напоминают соли аммония.
4) При хранении простые эфиры медленно окисляются кислородом воздуха, образуя крайне взрывчатые гидропероксиды:
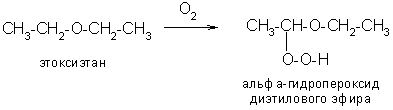
Эфиры перед использованием всегда необходимо проверять на присутствие перекиси реакцией с KI в присутствии крахмала.
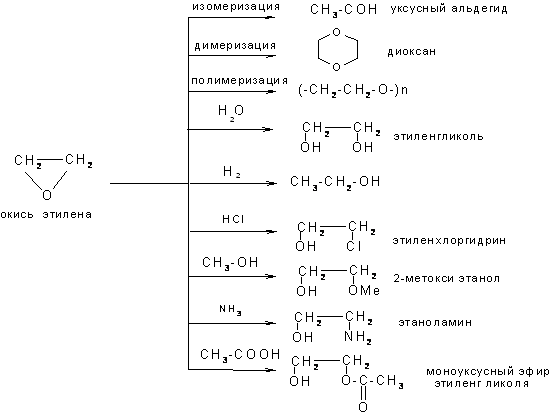
6.3.3. Окись этилена (эпоксисоединения)
Оксид этилена имеет важное техническое значение. Его получают главным образом из этилена двумя способами:
1) Окислением этилена на серебряном катализаторе

2) Через стадию образования этиленхлоргидрина

Окись этилена – низкокипящее вещество (tкип=10,70С) с эфирным запахом. В отличие от простых эфиров она очень реакционноспособна. Это объясняется большой напряженностью цикла (как в циклопропане). Атака так нуклеофильного, так и электрофильного агента приводит к разрыву связи С–О:
Задачи для самопроверки
1. Напишите структурные формулы 2-метил-3-пентанола, 2-метил-1-бутанола, глицерина, о-крезола, фенетола, анизола, пирокатехина.
2. Напишите структурные формулы α-гликолей состава С5Н12О2 и назовите их по систематической номенклатуре.
3. Получите тремя разными способами 2-пропанол.
4. Получите из пропилового спирта: пропилпропиловый эфир, 1-пропоксибутан, пропиленгликоль, пропилпропионат, глицерин.
5.При взаимодействии бутилового спирта с С2Н5MgBr выделилось 112 мл этана (объем приведен к нормальным условиям). Рассчитайте сколько граммов спирта вступило в реакцию.
6. Сколько % спирта содержалось в 0,33 г смеси диизоамилового эфира и изоамилового спирта, если при действии на смесь бромистого метилмагния выделилось 6,8 мл метана (при н.у)?
7. Какие химические реакции используются для получения из этилового спирта диэтилового эфира, хлористого этила, диэтилсульфата, дивинила, хлораля?
8. Напишите уравнения реакций, соответствующие схеме, назовите органические вещества:

9. Получите любым способом п-крезол. Напишите для него реакции с гидроксидом натрия, хлористым ацетилом, диметилсульфатом в присутствии NaOH.
10. Напишите структурную формулу ароматического соединения состава С6H6SO4, которое с FeCl3 дает фиолетовое окрашивание. При сплавлении со щелочью и последующим подкислением оно образует соединение С6H6O2, при окислении которого получается о-бензохинон.
