
- •Глава 1 введение
- •1.2 Основные сырьевые источники органических соединений
- •1.3 Классификация органических соединений
- •1.4 Номенклатура органических соединений
- •1.4.1 Тривиальная номенклатура
- •1.4.2 Рациональная номенклатура
- •1.4.3 Номенклатура июпак
- •1.4.3.1. Номенклатура июпак для алифатических углеводородов.
- •Глава 2 теоретические представления в органической химии
- •2.1 Типы химических связей
- •2.2 Образование ковалентных связей атомами углерода (σ- и π-ковалентные связи)
- •2.3 Общие представления о механизмах химических реакций
- •2.3.1 Свободнорадикальные реакции
- •2.3.2 Ионные реакции
- •2.4 Пространственное расположение атомов в молекуле. Конформация молекул
- •Глава 3 алифатические углеводороды алканы,алкены, алкины и алкадиены
- •3.1 Алканы: определениек,изомерия и номенклатура
- •3.1.2 Способы получения алканов
- •3.1.3 Химические свойства
- •Радикальное галогенирование
- •Нитрование
- •Сульфирование, сульфоокисление, сульфохлорирование
- •Окисление
- •Крекинг углеводородов при высоких температурах
- •Задачи для самопроверки
- •3.2 Алкены: определение, изомерия, номенклатура
- •3.2.1 Способы получения
- •3.2.2 Химические свойства
- •3.3. Алкадиены: определение, изомерия, номенклатура
- •3.3.1 Способы получения важнейших диенов
- •3.3.2 Химические особенности 1,3-алкадиенов
- •3.4. Алкины: определение, изомерия, номенклатура
- •3.4.1. Способы получения.
- •3.4.2. Химические свойства
- •Глава 4 карбоциклические соединения
- •4.1. Алициклический ряд: определение, изомерия, номенклатура
- •4.1.1 Способы получения
- •4.1.2. Химические свойства
- •4.1.3. Современные представления о строении моноциклоалканов.
- •4.2. Ароматические углеводороды
- •4.2.1. Строение бензола
- •4.2.2. Способы получения
- •4.2.3. Химические свойства
- •4.3.4. Правила ориентации в бензольном кольце
- •4.2.5. Механизм ориентирующего влияния заместителей
- •4.3. Многоядерные ароматические соединения с неконденсированными и конденсированными бензольными ядрами
- •4.3.1. Основные способы получения
- •4.3.2. Химические особенности
- •Функциональные производные углеводородов
- •Глава 5 галогенопроизводные
- •5.1. Галогенопроизводные: определение, изомерия, номенклатура
- •5.2. Способы получения
- •5..3 Химические свойства
- •Глава 6 кислородсодержащие органические соединения
- •6.1. Спирты: определение, изомерия, номенклатура
- •6.1.1. Способы получения
- •6.1.2 Физические свойства спиртов
- •6.1.3. Химические свойства
- •6.1.4 Понятие о непредельных и многоатомных спиртах
- •6.2. Фенолы: определение, изомерия, номенклатура
- •16.2.1. Способы получения
- •6.2.2. Химические свойства
- •6.3. Простые эфиры: определение, изомерия, номенклатура
- •6.3.1. Способы получения
- •6.3.2. Химические свойства
- •6.3.3. Окись этилена (эпоксисоединения)
- •6.4. Оксосоединения (альдегиды и кетоны)
- •6.4.1. Определение, изомерия и номенклатура оксосоединений
- •6.4.2. Способы получения
- •6.4.3. Химические свойства
- •6.4.4. Понятие о непредельных альдегидах и кетонах
- •6.4.5. Особенности получения и химические свойства хинонов
- •Задачи для самопроверки
- •6.5. Одно и многоосновные карбоновые кислоты и их производные: определение, изомерия, номенклатура
- •6.5.1. Способы получения
- •6.5.2. Химические свойства
- •6.5.3. Особенности предельных и непредельных кислот
- •Задачи для самопроверки
- •Глава 7. Серосодержащие соединения
- •7.1. Органические соединения двухвалентной серы (Тиолы, сульфиды, дисульфиды)
- •7.2. Сульфиновые кислоты и их производные
- •7.3. Сульфоновые кислоты и их производные. Сульфоны.
- •Глава 8. Азотсодержащие органические соединения
- •8.1 Нитросоединения: определение, изомерия, номенклатура.
- •8.1.1. Способы получения
- •8.1.2. Химические свойства
- •Задачи для самопроверки
- •8.2 Амины: определение, изомерия, номенклатура
- •8.2.1 Способы получения
- •8.2.2. Химические свойства
- •8.2.3. Понятие о диаминах
- •Задачи для самопроверки
- •8.3. Диазо- и азосоединения: определение, изомерия, номенклатура
- •8.3.1. Способы получения
- •8.3.2 Физические и химические свойства
- •II. Реакции без выделения азота
- •Задачи для самопроверки
- •Глава 9 . Гетерофункциональные соединеия
- •9.1. Гидроксикислоты: определение, изомерия, номенклатура
- •9.1.1. Способы получения
- •9.1.2. Химические свойства
- •9.1.3. Оптическая изомерия гидроксикислот
- •9.1.4. Ароматические гидроксикислоты и их производные
- •Задачи для самопроверки
- •9.2. Альдегидо- и кетокислоты: определение, изомерия, номенклатура
- •9.2.1. Способы получения
- •9.2.2. Химические особенности
- •9.2.3. Применение ацетоуксусного эфира в органическом синтезе
- •Задачи для самопроверки
- •9.3. Аминокислоты: определение, изомерия, номенклатура
- •9.3.1. Способы получения
- •9.3.2. Химические свойства
- •Задачи для самопроверки
- •Глава 10. Гетероциклические соединения
- •10.1. Определение и классификация гетероциклических соединений.
- •10.2. Пятичленные гетероциклические соединения: изомерия, номенклатура, ароматический характер.
- •10.2.1. Способы получения пятичленных гетероциклических соединений.
- •10.2.3. Химические свойства
- •10.3. Понятие о конденсированных гетероциклах (индол)
- •10.4. Шестичленные гетероциклические соединения: изомерия, номенклатура
- •10.4.1. Химические свойства.
- •Глава 11. Липиды
- •11.1.Определение, классификация изомерия, номенклатура
- •11.2. Простые липиды. (Жиры, масла)
- •10.3. Сложные липиды. Понятие о фосфолипидах.
- •10.4. Понятие о циклических липидах
- •Глава 12. Углеводы
- •12.1. Определение, классификация, изомерия, номенклатура.
- •12.2. Моносахариды: строение, оптическая изомерия.
- •12.3.Химические свойства моносахаридов.
- •12.4. Олигосахариды: особенности строения, химические свойства
- •12.5. Несахароподобные полисахариды: крахмал, гликоген, клетчатка.
- •Глава 13. Пептиды и белки
- •13.1. Протеиногенные аминокислоты
- •13.2. Понятие о строении пептидов.
- •13.3. Особенности строения белков
- •Глава 14. Нуклеиновые кислоты
- •14.1. Понятие о составе и строении нуклеиновых кислот
- •14.2. Классификация и биологическая роль нуклеиновых кислот
Глава 8. Азотсодержащие органические соединения
8.1 Нитросоединения: определение, изомерия, номенклатура.
Нитросоединениями называются органические вещества, содержащие в качестве функциональной группы нитрогруппу –NO2. Атом азота нитрогруппы непосредственно связан с углеродом в отличие от эфиров азотистой кислоты, содержащих функциональную группу –ОNO, где связь осуществляется через кислород. Эфиры азотистой кислоты изомерны нитросоединениям:
R–NO2 – нитросоединение
R–ONO – эфир азотистой кислоты
Изомерия. Номенклатура. Строение нитрогруппы
В зависимости от природы органического радикала, с которым соединена нитрогруппа, различают нитросоединения алифатические (предельные и непредельные), алициклические, ароматические и гетероциклические. По характеру углеродного атома, связанного с нитрогруппой, нитросоединения подразделяются на первичные, вторичные и третичные (подобно галогенопроизводным и спиртам). В состав молекулы может входить одна или несколько нитрогрупп.
По номенклатуре ИЮПАК нитрогруппа обозначается как заместитель с указанием ее положения в углеродной цепи цифрой:

Строение нитрогруппы может быть обозначено следующими формулами, в соответствии с которыми один из атомов кислорода образует с азотом двойную, другой – семиполярную связь:
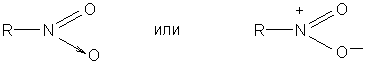
Эти формулы вскрывают причину полярности нитросоединений, однако в реальной молекуле связи обоих атомов кислорода с азотом не отличаются друг от друга. В нитрогруппе появляется мезомерия: связи имеют промежуточный характер, распределение электронной плотности выравнивается. Поэтому более точное строение нитрогруппы передают следующие формулы:
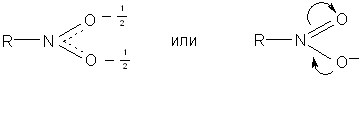
8.1.1. Способы получения
Получение нитросоединений, по М. И. Коновалову, нитрованием в газовой фазе; из галогенопроизводных, а также в ароматическом ряду действием нитрующей смеси рассмотрено в гл.3,8,9
Физические свойства
Нитросоединения жирного ряда – жидкости, обладающие приятным запахом, перегоняющиеся без разложения.
Мононитросоединения ароматических углеводородородов – жидкие или твердые вещества, бесцветные или бледно желтые. Ароматические нитросоединения, а также алифатические с числом углеродных атомов менее четырех – тяжелее воды, а алифатические нитросоединения с числом атомов углерода 4 и более – легче воды. Все нитросоединения малорастворимы в воде, ядовиты, не вызывают коррозии металлов, их водные растворы имеют нейтральную реакцию. Нитросоединения – полярные вещества; их дипольные моменты порядка 1,17÷1,34∙10-29 Кл/м (3,5÷4,0 Д). Поэтому они кипят при более высоких температурах, чем спирты или карбонильные соединения.
В ИК-спектрах нитросоединений имеются интенсивные полосы в области длин волн 1375 и 1580 см-1.
8.1.2. Химические свойства
1. Восстановление. Конечными продуктами восстановления нитросоединений являются первичные амины.
![]()
2. Действие щелочей. Таутомерия нитросоединений.
Нитрогруппа, обладая сильным положительным зарядом на атоме азота, оттягивает на себя электронную плотность и увеличивает подвижность водородов у соседнего атома углерода – их способность отщепляться в виде протона. Подвижность α-водородных атомов первичных и вторичных нитросоединений проявляется в их способности реагировать со щелочами с образованием солей. Это объясняется тем, что в щелочной среде нитросоединения перегруппировываются в аци-нитроформу (кислотную):
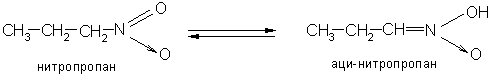
Таким образом, нитросоединения следует рассматривать как таутомерные вещества, реагирующие в нитро- и аци-нитроформах.
Если щелочные растворы нитросоединений обработать минеральной кислотой, то происходит медленный обратный сдвиг равновесия:

Поэтому нитросоединения относят к псевдокислотам. Для псевдокислот характерно, что сами они нейтральны, не обладают электропроводностью, тем не менее, образуют нейтральные соли щелочных металлов. «Нейтрализация» нитросоединений основаниями (образование нейтральных солей) идет медленно, а нейтрализация истинных кислот происходит, как известно, мгновенно.
3. Подвижность α-водородных атомов проявляется при взаимодействии первичных и вторичных нитросоединений с альдегидами:
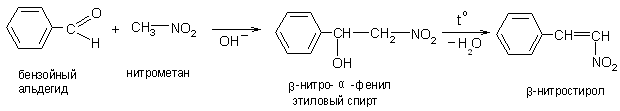
Эта конденсация идет по альдольно-кротоновому типу.
4. Первичные и вторичные нитросоединения реагируют с азотистой кислотой, а третичные не реагируют:

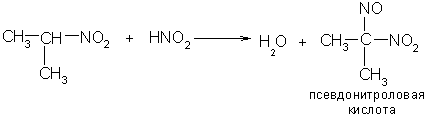
Щелочные соли нитроловых кислот в растворе имеют красный цвет. Псевдонитролы в растворах и в расплавах окрашены в синий или зеленовато-синий цвет.
5. Соли аци-формы первичных и вторичных нитросоединений на холоду в водных растворах при действии минеральных кислот образуют альдегиды или кетоны (в момент выделения аци-форма подвергается гидролизу):

6. Влияние нитрогруппы в ароматическом ядре.
Нитрогруппа относится к заместителям второго рода: оттягивая электроны из ароматического ядра она уменьшает его активность в реакциях электрофильного замещения. Вступающий заместитель направляется в мета-положение:

Электронная плотность особенно сильно уменьшается в орто- и пара-положениях к нитрогруппе. Обедненные электронной плотностью орто- и пара-положения ядра приобретают частичный положительный заряд, а вместе с тем и способность к необычным для ароматических соединений реакциям нуклеофильного замещения:

Оттягивая электронную плотность из ядра, нитрогруппа повышает кислотность стоящих в орто- и пара-положениях гидроксильных групп. Пикриновая кислота ведет себя, как настоящая кислота (сила ее превышает силу угольной кислоты) – образует соли, эфиры со спиртами.
Под влиянием нитрогруппы увеличивается реакционная способность галогена, стоящего в орто- и пара-положениях:

