
- •Isbn 978 617 00 0662 2
- •2 Уроки
- •1. Передумови розвитку науки
- •2. Зародження і розвиток фізики як науки
- •3. Роль фізичного знання в житті людини й розвитку суспільства
- •1. Спостереження, наукова гіпотеза й експеримент
- •2. Наукові моделі й наукова ідеалізація
- •3. Науковий закон і наукова теорія
- •4. Принцип відповідності
- •5. Сучасна фізична картина світу
- •1. Основне завдання механіки
- •2. Система відліку
- •3. Матеріальна точка
- •4. Траєкторія, шлях і переміщення
- •5. Векторні величини
- •2. Контрольні запитання
- •1. Початковий рівень (1 бал)
- •2. Середній рівень (2 бали)
- •3. Достатній рівень (4 бали)
- •4. Високий рівень (5 балів)
- •1. Швидкість прямолінійного рівномірного руху
- •2. Графік залежності шляху від часу в разі прямолінійного рівномірного руху
- •3. Графік залежності модуля швидкості від часу
- •4. Закон додавання швидкостей
- •3. Достатній рівень (4 бали)
- •4. Високий рівень (5 балів)
- •1. Миттєва швидкість
- •2. Прямолінійний рівноприскорений рух
- •3. Прискорення
- •4. Швидкість у випадку прямолінійного рівноприскореного руху
- •2. Контрольні запитання
- •1. Рух без початкової швидкості
- •2. Рух із початковою швидкістю
- •3. Співвідношення між шляхом і швидкістю
- •2. Контрольні запитання
- •1. Вільне падіння
- •2. Рух тіла, кинутого вертикально вгору
- •3. Вільне падіння як окремий випадок рівноприскореного руху
- •2. Контрольні запитання
- •1. Початковий рівень (1 бал)
- •2. Середній рівень (2 бали)
- •3. Достатній рівень (4 бали)
- •4. Високий рівень (5 балів)
- •1. Особливості криволінійного руху
- •2. Модуль і напрямок швидкості в разі рівномірного руху по колу
- •3. Період обертання і обертова частота
- •4. Прискорення в разі рівномірного руху по колу
- •5. Кутова швидкість
- •2. Контрольні запитання
- •1. Початковий рівень (1 бал)
- •2. Середній рівень (2 бали)
- •3. Достатній рівень (4 бали)
- •4. Високий рівень (5 балів)
- •1. Закон інерції і явище інерції
- •2. Інерціальні системи відліку і перший закон Ньютона
- •3. Застосування явища інерції
- •4. Чи є очевидним перший закон Ньютона?
- •2. Контрольні запитання
- •1. Сили в механіці
- •2. Сила пружності. Вимірювання сил
- •3. Додавання сил
- •1. Учимося розв'язувати задачі
- •2. Контрольні запитання
- •1. Співвідношення між силою і прискоренням
- •2. Маса тіла
- •3. Другий закон Ньютона
- •2. Контрольні запитання
- •1. Чому дорівнює сила тяжіння?
- •2. Рух тіла, кинутого вертикально вгору
- •3. Рух тіла, кинутого під кутом до горизонту
- •1. Учимося розв'язувати задачі
- •2. Контрольні запитання
- •1. Третій закон Ньютона
- •2. Властивості сил, із якими тіла взаємодіють
- •3. Приклади прояву третього закону Ньютона
- •2. Контрольні запитання
- •1. Початковий рівень (1 бал)
- •2. Середній рівень (2 бали)
- •3. Достатній рівень (4 бали)
- •2. Вага тіла, яке рухається з прискоренням
- •3. Невагомість. Перевантаження
- •4. Закон всесвітнього тяжіння
- •2. Контрольні запитання
- •1. Перша і друга космічні швидкості
- •2. Розрахунок орбітальної швидкості супутників
- •3. Закон всесвітнього тяжіння і пояснення деяких явищ природи
- •2. Контрольні запитання
- •1. Сила тертя ковзання
- •2. Сила тертя спокою
- •3. Сила тертя кочення
- •4. Чи завжди сила тертя спокою перешкоджає руху?
- •2. Контрольні запитання
- •1. Початковий рівень (1 бал)
- •2. Середній рівень (2 бали)
- •3. Достатній рівень (4 бали)
- •4. Високий рівень (5 балів)
- •1. Умова рівноваги тіла для поступального руху
- •2. Умова рівноваги тіла, закріпленого на осі
- •1. Учимося розв'язувати задачі
- •2. Контрольні запитання
- •2. Закон збереження імпульсу
- •1. Учимося розв'язувати задачі
- •2. Контрольні запитання
- •1. Початковий рівень (1 бал)
- •2. Середній рівень (2 бали)
- •3. Достатній рівень (4 бали)
- •4. Високий рівень (5 балів)
- •1. Реактивний рух
- •2. Принцип дії ракети
- •3. Освоєння космосу
- •1. Механічна робота
- •2. Робота різних сил
- •3. Потужність
- •1. Початковий рівень (1 бал)
- •2. Середній рівень (2 бали)
- •3. Достатній рівень (4 бали)
- •4. Високий рівень (5 балів)
- •1. Механічна енергія
- •2. Потенційна енергія
- •3. Кінетична енергія
- •4. Закон збереження енергії
- •1. Початковий рівень (1 бал)
- •2. Середній рівень (2 бали)
- •3. Достатній рівень (4 бали)
- •4. Високий рівень (5 балів)
- •1. Принцип відносності Галілея
- •2. Передумови теорії відносності
- •2. Основні положення спеціальної теорії відносності
- •1. Досліди Галілея
- •4. Сталість швидкості світла у вакуумі
- •1. Відносність одночасності
- •1. Повна енергія тіла, яке рухається вільно
- •2. Контрольні запитання
- •18 Уроків
- •1. Основні положення молекулярно-кінетичної теорії
- •2. Дослідні підтвердження мкт
- •2. Основне завдання мкт
- •1. Учимося розв'язувати задачі
- •2. Контрольні запитання
- •2. Кількість речовини
- •3. Стала Авогадро
- •4. Молярна маса
- •1. Учимося розв'язувати задачі
- •2. Контрольні запитання
- •1. Початковий рівень (1 бал)
- •3. Достатній рівень (4 бали)
- •4. Високий рівень (5 балів)
- •1. Теплова рівновага й температура
- •2. Вимірювання температури
- •3. Абсолютна шкала температур
- •1. Учимося розв'язувати задачі
- •2. Контрольні запитання
- •1. Ізопроцеси
- •2. Ізобарний процес
- •3. Ізохорний процес
- •4. Ізотермічний процес
- •2. Контрольні запитання
- •1. Рівняння Клапейрона
- •2. Закон Авогадро
- •3. Рівняння Менделєєва-Клапейрона
- •2. Контрольні запитання
- •1. Початковий рівень (1 бал)
- •2. Середній рівень (2 бали)
- •3. Достатній рівень (4 бали)
- •4. Високий рівень (5 балів)
- •1. Порівняння газів, рідин і твердих тіл
- •2. Чи може та сама речовина перебувати в різних агрегатних станах?
- •3. Чому властивості всіх газів майже однакові,
- •4. Як розташовані молекули й атоми в газах, рідинах і твердих тілах?
- •1. Модель рідкого стану
- •2. Поверхневий натяг рідин
- •3. Змочування
- •2. Контрольні запитання
- •1. Капілярні явища
- •2. Капілярні явища в природі й техніці
- •1. Кристалічні тіла
- •2. Аморфні тіла
- •1. Рідкі кристали
- •2. Полімери
- •3. Молекулярна будова живих організмів
- •1. Пароутворення
- •2. Молекулярна картина випаровування
- •4. Насичена й ненасичена пара
- •2. Контрольні запитання
- •2. Точка роси
- •3. Способи визначення вологості повітря
- •1. Учимося розв'язувати задачі
- •2. Контрольні запитання
- •1. Внутрішня енергія
- •2. Два способи зміни внутрішньої енергії
- •1. Обчислення роботи в ізобарному процесі
- •2. Графічне визначення роботи газу
- •3. Фізичний зміст газової сталої
- •1. Учимося розв'язувати задачі
- •2. Контрольні запитання
- •1. Закон збереження енергії в теплових явищах
- •2. Перший закон термодинаміки
- •3. Хто відкрив перший закон термодинаміки?
- •1. Учимося розв'язувати задачі
- •2. Контрольні запитання
- •1. Ізохорний процес
- •2. Ізотермічний процес
- •3. Адіабатний процес
- •4. Ізобарний процес
- •2. Контрольні запитання
- •1. За яких умов за рахунок внутрішньої енергії може бути здійснена максимальна робота?
- •2. Як знизити температуру робочого тіла перед стисканням?
- •3. Принцип роботи теплових двигунів
- •4. Ккд теплового двигуна
- •5. Холодильники й кондиціонери
- •2. Контрольні запитання
- •1. Початковий рівень (1 бал)
- •2. Середній рівень (2 бали)
- •3. Достатній рівень (4 бали)
- •4. Високий рівень (5 балів)
2. Контрольні запитання
-
Як забезпечується ізобарність процесу в газі?
-
Як забезпечується ізохорність процесу в газі?
-
Як забезпечується ізотермічність процесу в газі?
-
Окресліть межі застосовності газових законів.
Про що ми дізналися на уроці
• Ізопроцесами називаються процеси, що протікають з певною масою газу за постійного значення одного з трьох параметрів — тиску, об'єму або температури.
• Закон Гей Люссака:
у разі ізобарного процесу об'єм певної маси газу прямо пропор ційний його абсолютній температурі:
V Т —і. = —
Закон Шарля:
у разі ізохорного процесу тиск певної маси газу прямо пропор ційний його абсолютній температурі:
А_ = Т
• Закон Бойля Маріотта:
у разі ізотермічного процесу тиск певної маси газу обернено пропорційний його об'єму:
Р2 VI
Домашнє завдання
-
П.:
-
Зб.: р1 — № 15.4; 15.6; 15.17; 15.18;
р2 — № 15.25; 15.26; 15.27; 15.34; р3 — 15.54; 15.55; 15.58; 15.59.
УРОК 5/41
Тема. Лабораторна робота № 4.
Дослідна перевірка закону Бойля-Маріотта
Мета уроку: експериментальна перевірка газових законів.
Тип уроку: урок контролю й оцінювання знань.
Обладнання: скляний циліндр заввишки 50 см, скляна трубка завдовжки 50-60 см, закоркована з одного кінця, склянка, пластилін, термометр, лінійка, барометр-анероїд (один на клас), штатив із лапкою, холодна і гаряча вода.
ОПИС РОБОТИ
У циліндр із водою занурюють відкритим кінцем униз трубку (див. рис.). Якщо рівень води в трубці нижчий від рівня води в по судині на h, то тиск повітря в трубці дорівнює сумі атмосферного й гідростатичного тиску стовпа води висотою h. Для спрощення розрахунків можна вимірювати тиск у міліметрах ртутного стовпа. Тоді, з урахуванням того, що густина води в 13,6 разів менша від густини ртуті, для повітря в трубці можна записати:
„ h
р = H+136'
де H — атмосферний тиск у міліметрах ртутного стовпа;
h — різниця рівнів води в циліндрі й трубці, вимірювана в мілі метрах.
У трубці міститься постійна маса повітря, яку можна вважати такою, що перебуває за постійної (кімнатної) температури. Об'єм і тиск повітря, що міститься в трубці, можна змінювати, змінюючи глибину занурення трубки. Об'єм повітря в трубці — V = l ■ S, де l — довжина стовпа повітря; S — площа перерізу трубки.
Оскільки площа поперечного перерізу трубки постійна, довжи на стовпа повітря в трубці пропорційна об'єму повітря. Отже, для перевірки закону Бойля Маріотта достатньо перевірити справедли вість рівності:
U h Л,
H + ■ l = const.
I 13,6 I
-
ХІД РОБОТИ 1. Зберіть установку (див. рис.).
Виміряйте барометром атмосферний тиск у міліметрах ртутно го стовпа.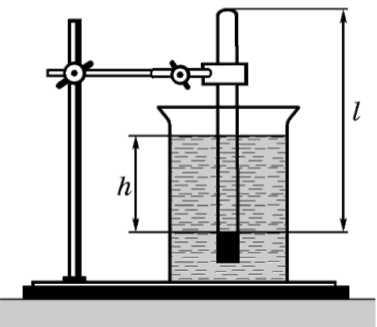
-
Занурюючи у воду трубку відкритим кінцем униз, виміряйте Н (повторіть дослід не менш ніж тричі).
-
Результати вимірювань та обчислень запишіть у таблицю.
|
№ досліду |
Н, мм рт. ст. |
Н, мм |
1, см |
с = Н + • 1 1 13,6 J |
|
1 |
|
|
|
|
|
2 |
|
|
|
|
|
3 |
|
|
|
|
5. Запишіть висновок: що ви вимірювали та який отримали ре зультат.
Домашнє завдання
-
П.:
-
Зб.: р1 — № 15.9; 15.10; 15.19; 15.23;
р2 — № 15.28; 15.29; 15.30; 15.31.
УРОК 6/42
Тема. Розв'язання задач за графіками ізопроцесів Мета уроку: повторити, поглибити й закріпити знання учнів про газові закони в процесі розв'язання графічних задач. Тип уроку: урок закріплення знань.
РЕКОМЕНДАЦІЇ ЩОДО ПРОВЕДЕННЯ УРОКУ
Засвоєнню і закріпленню знань у разі розв'язання задач за гра фіками ізопроцесів допомагає якісний підбір графічних задач. За лежно від рівня підготовки класу вчитель повинен підібрати такі задачі, щоб учням було цікаво працювати на уроці. Нижче наво диться орієнтовний перелік задач, з яких учитель може вибрати необхідні для конкретного уроку.
Чималу методичну цінність мають графічні задачі.
Рекомендується розв'язувати задачі із застосуванням зобра жень ізопроцесів у різних координатних осях р(Т), р (V) і У(Т); ана лізувати явища, що зображуються замкненими циклами, які скла даються з перелічених ізопроцесів; зображувати на координатній площині сім'ю кривих тих самих процесів газу й аналізувати умо ви переходу газу з одного рівноважного стану в інший, що відпо відають різним кривим.

 ЗАДАЧІ
ДЛЯ РОЗВ'ЯЗАННЯ НА УРОЦІ
ЗАДАЧІ
ДЛЯ РОЗВ'ЯЗАННЯ НА УРОЦІ
1. Як змінювався тиск ідеального газу в про цесі, графік якого зображено на рисунку? Укажіть точки на графіку, що відповіда ють найбільшому і найменшому тиску.
Розв Проведемо через різні точ
ки графіка ізобари (див. рис.). Найбіль шому тиску відповідає найнижча ізоба ра, тому найбільший тиск досягається в нижній точці дотику В. Найменший тиск відповідає верхній точці дотику А. У переході від точки А до точки В тиск газу зростає, а в переході від точки В до точки А тиск зменшується.
2. Побудуйте графіки процесу, що протікає з ідеальним газом (див. рис.), у коорди натах ^Т) і р (V). Маса газу постійна.
Розв Перш ніж будувати гра
фіки, слід з'ясувати, що являє собою
0
0
Т
Р
0
1
2
T
 ожен
етап замкненого процесу, який про тікає
з газом. (Скориставшись газовими законами,
можна зробити висновок також про характер
зміни об'єму газу на кожному з етапів.)
Етап 1-2 — це ізотермічне розши рення
(температура постійна, тиск зменшу
ється), етап 2-3 — ізобарне остигання
(тиск постійний, температура
зменшується), етап 3-1 — ізохорне нагрівання
(тиск під вищується прямо пропорційно
абсолютній температурі газу). Етап 1-2:
T
= const,
p
—
убуває, V
—
зростає (пропорційно 1/p).
Етап 2-3: T
—
убуває, p
= const,
V
—
зменшується (пропорцій но T).
Етап 3-1: T
—
зростає, p
—
зростає (пропорційно T),
V
= const.
Будуючи графіки в координатах (V,T)
і (p,V),
слід ураховувати, що ці графіки мають
бути замкненими (див. рис.).
ожен
етап замкненого процесу, який про тікає
з газом. (Скориставшись газовими законами,
можна зробити висновок також про характер
зміни об'єму газу на кожному з етапів.)
Етап 1-2 — це ізотермічне розши рення
(температура постійна, тиск зменшу
ється), етап 2-3 — ізобарне остигання
(тиск постійний, температура
зменшується), етап 3-1 — ізохорне нагрівання
(тиск під вищується прямо пропорційно
абсолютній температурі газу). Етап 1-2:
T
= const,
p
—
убуває, V
—
зростає (пропорційно 1/p).
Етап 2-3: T
—
убуває, p
= const,
V
—
зменшується (пропорцій но T).
Етап 3-1: T
—
зростає, p
—
зростає (пропорційно T),
V
= const.
Будуючи графіки в координатах (V,T)
і (p,V),
слід ураховувати, що ці графіки мають
бути замкненими (див. рис.).
2
3
Р
1
3
2
0
T
0
V
Р
V
3. На рисунку зображено дві ізохори для двох ідеальних газів. Порівняйте об'єми
Ух і V2. Маси газів постійні.
Ідеальний газ переведено зі стану 1 у стан 2 (див. рис. внизу ліворуч). Де газ заданої маси мав більший об'єм: у точці 1 чи в точці 2?
Р0 А
0
1
2
T
T
5. Ідеальний газ пе реведено зі стану 1 у стан 2 (див. рис. внизу праворуч). Збільшувався чи зменшувався тиск газу заданої маси протягом процесу 1-2?
Р
0
1
2
T
УРОК 7/43
Тема. Рівняння стану ідеального газу
Мета уроку: вивести залежність між макроскопічними параметрами
(р, V, Т), що характеризують стан газу. Тип уроку: урок вивчення нового матеріалу.
ПЛАН УРОКУ
|
Контроль знань |
5 хв |
1. Закон Гей Люссака. 2. Закон Шарля. 3. Закон Бойля Маріотта. 4. Графіки ізопроцесів |
|
Демонстрації |
3 хв |
Залежність між об'ємом, тиском і темпера турою газу |
|
Вивчення нового матеріалу |
25 хв |
1. Рівняння Клапейрона. 2. Закон Авогадро. 3. Рівняння Менделєєва—Клапейрона |
|
Закріплення вивченого матеріалу |
12 хв |
1. Учимося розв'язувати задачі. 2. Контрольні запитання |
ВИВЧЕННЯ НОВОГО МАТЕРІАЛУ
