
- •Isbn 978 617 00 0662 2
- •2 Уроки
- •1. Передумови розвитку науки
- •2. Зародження і розвиток фізики як науки
- •3. Роль фізичного знання в житті людини й розвитку суспільства
- •1. Спостереження, наукова гіпотеза й експеримент
- •2. Наукові моделі й наукова ідеалізація
- •3. Науковий закон і наукова теорія
- •4. Принцип відповідності
- •5. Сучасна фізична картина світу
- •1. Основне завдання механіки
- •2. Система відліку
- •3. Матеріальна точка
- •4. Траєкторія, шлях і переміщення
- •5. Векторні величини
- •2. Контрольні запитання
- •1. Початковий рівень (1 бал)
- •2. Середній рівень (2 бали)
- •3. Достатній рівень (4 бали)
- •4. Високий рівень (5 балів)
- •1. Швидкість прямолінійного рівномірного руху
- •2. Графік залежності шляху від часу в разі прямолінійного рівномірного руху
- •3. Графік залежності модуля швидкості від часу
- •4. Закон додавання швидкостей
- •3. Достатній рівень (4 бали)
- •4. Високий рівень (5 балів)
- •1. Миттєва швидкість
- •2. Прямолінійний рівноприскорений рух
- •3. Прискорення
- •4. Швидкість у випадку прямолінійного рівноприскореного руху
- •2. Контрольні запитання
- •1. Рух без початкової швидкості
- •2. Рух із початковою швидкістю
- •3. Співвідношення між шляхом і швидкістю
- •2. Контрольні запитання
- •1. Вільне падіння
- •2. Рух тіла, кинутого вертикально вгору
- •3. Вільне падіння як окремий випадок рівноприскореного руху
- •2. Контрольні запитання
- •1. Початковий рівень (1 бал)
- •2. Середній рівень (2 бали)
- •3. Достатній рівень (4 бали)
- •4. Високий рівень (5 балів)
- •1. Особливості криволінійного руху
- •2. Модуль і напрямок швидкості в разі рівномірного руху по колу
- •3. Період обертання і обертова частота
- •4. Прискорення в разі рівномірного руху по колу
- •5. Кутова швидкість
- •2. Контрольні запитання
- •1. Початковий рівень (1 бал)
- •2. Середній рівень (2 бали)
- •3. Достатній рівень (4 бали)
- •4. Високий рівень (5 балів)
- •1. Закон інерції і явище інерції
- •2. Інерціальні системи відліку і перший закон Ньютона
- •3. Застосування явища інерції
- •4. Чи є очевидним перший закон Ньютона?
- •2. Контрольні запитання
- •1. Сили в механіці
- •2. Сила пружності. Вимірювання сил
- •3. Додавання сил
- •1. Учимося розв'язувати задачі
- •2. Контрольні запитання
- •1. Співвідношення між силою і прискоренням
- •2. Маса тіла
- •3. Другий закон Ньютона
- •2. Контрольні запитання
- •1. Чому дорівнює сила тяжіння?
- •2. Рух тіла, кинутого вертикально вгору
- •3. Рух тіла, кинутого під кутом до горизонту
- •1. Учимося розв'язувати задачі
- •2. Контрольні запитання
- •1. Третій закон Ньютона
- •2. Властивості сил, із якими тіла взаємодіють
- •3. Приклади прояву третього закону Ньютона
- •2. Контрольні запитання
- •1. Початковий рівень (1 бал)
- •2. Середній рівень (2 бали)
- •3. Достатній рівень (4 бали)
- •2. Вага тіла, яке рухається з прискоренням
- •3. Невагомість. Перевантаження
- •4. Закон всесвітнього тяжіння
- •2. Контрольні запитання
- •1. Перша і друга космічні швидкості
- •2. Розрахунок орбітальної швидкості супутників
- •3. Закон всесвітнього тяжіння і пояснення деяких явищ природи
- •2. Контрольні запитання
- •1. Сила тертя ковзання
- •2. Сила тертя спокою
- •3. Сила тертя кочення
- •4. Чи завжди сила тертя спокою перешкоджає руху?
- •2. Контрольні запитання
- •1. Початковий рівень (1 бал)
- •2. Середній рівень (2 бали)
- •3. Достатній рівень (4 бали)
- •4. Високий рівень (5 балів)
- •1. Умова рівноваги тіла для поступального руху
- •2. Умова рівноваги тіла, закріпленого на осі
- •1. Учимося розв'язувати задачі
- •2. Контрольні запитання
- •2. Закон збереження імпульсу
- •1. Учимося розв'язувати задачі
- •2. Контрольні запитання
- •1. Початковий рівень (1 бал)
- •2. Середній рівень (2 бали)
- •3. Достатній рівень (4 бали)
- •4. Високий рівень (5 балів)
- •1. Реактивний рух
- •2. Принцип дії ракети
- •3. Освоєння космосу
- •1. Механічна робота
- •2. Робота різних сил
- •3. Потужність
- •1. Початковий рівень (1 бал)
- •2. Середній рівень (2 бали)
- •3. Достатній рівень (4 бали)
- •4. Високий рівень (5 балів)
- •1. Механічна енергія
- •2. Потенційна енергія
- •3. Кінетична енергія
- •4. Закон збереження енергії
- •1. Початковий рівень (1 бал)
- •2. Середній рівень (2 бали)
- •3. Достатній рівень (4 бали)
- •4. Високий рівень (5 балів)
- •1. Принцип відносності Галілея
- •2. Передумови теорії відносності
- •2. Основні положення спеціальної теорії відносності
- •1. Досліди Галілея
- •4. Сталість швидкості світла у вакуумі
- •1. Відносність одночасності
- •1. Повна енергія тіла, яке рухається вільно
- •2. Контрольні запитання
- •18 Уроків
- •1. Основні положення молекулярно-кінетичної теорії
- •2. Дослідні підтвердження мкт
- •2. Основне завдання мкт
- •1. Учимося розв'язувати задачі
- •2. Контрольні запитання
- •2. Кількість речовини
- •3. Стала Авогадро
- •4. Молярна маса
- •1. Учимося розв'язувати задачі
- •2. Контрольні запитання
- •1. Початковий рівень (1 бал)
- •3. Достатній рівень (4 бали)
- •4. Високий рівень (5 балів)
- •1. Теплова рівновага й температура
- •2. Вимірювання температури
- •3. Абсолютна шкала температур
- •1. Учимося розв'язувати задачі
- •2. Контрольні запитання
- •1. Ізопроцеси
- •2. Ізобарний процес
- •3. Ізохорний процес
- •4. Ізотермічний процес
- •2. Контрольні запитання
- •1. Рівняння Клапейрона
- •2. Закон Авогадро
- •3. Рівняння Менделєєва-Клапейрона
- •2. Контрольні запитання
- •1. Початковий рівень (1 бал)
- •2. Середній рівень (2 бали)
- •3. Достатній рівень (4 бали)
- •4. Високий рівень (5 балів)
- •1. Порівняння газів, рідин і твердих тіл
- •2. Чи може та сама речовина перебувати в різних агрегатних станах?
- •3. Чому властивості всіх газів майже однакові,
- •4. Як розташовані молекули й атоми в газах, рідинах і твердих тілах?
- •1. Модель рідкого стану
- •2. Поверхневий натяг рідин
- •3. Змочування
- •2. Контрольні запитання
- •1. Капілярні явища
- •2. Капілярні явища в природі й техніці
- •1. Кристалічні тіла
- •2. Аморфні тіла
- •1. Рідкі кристали
- •2. Полімери
- •3. Молекулярна будова живих організмів
- •1. Пароутворення
- •2. Молекулярна картина випаровування
- •4. Насичена й ненасичена пара
- •2. Контрольні запитання
- •2. Точка роси
- •3. Способи визначення вологості повітря
- •1. Учимося розв'язувати задачі
- •2. Контрольні запитання
- •1. Внутрішня енергія
- •2. Два способи зміни внутрішньої енергії
- •1. Обчислення роботи в ізобарному процесі
- •2. Графічне визначення роботи газу
- •3. Фізичний зміст газової сталої
- •1. Учимося розв'язувати задачі
- •2. Контрольні запитання
- •1. Закон збереження енергії в теплових явищах
- •2. Перший закон термодинаміки
- •3. Хто відкрив перший закон термодинаміки?
- •1. Учимося розв'язувати задачі
- •2. Контрольні запитання
- •1. Ізохорний процес
- •2. Ізотермічний процес
- •3. Адіабатний процес
- •4. Ізобарний процес
- •2. Контрольні запитання
- •1. За яких умов за рахунок внутрішньої енергії може бути здійснена максимальна робота?
- •2. Як знизити температуру робочого тіла перед стисканням?
- •3. Принцип роботи теплових двигунів
- •4. Ккд теплового двигуна
- •5. Холодильники й кондиціонери
- •2. Контрольні запитання
- •1. Початковий рівень (1 бал)
- •2. Середній рівень (2 бали)
- •3. Достатній рівень (4 бали)
- •4. Високий рівень (5 балів)
2. Ізобарний процес
Зміна об'єму й температури газу за постійного тиску називаєть ся ізобарним процесом.
Під час ізобарного процесу об'єм газу прямо пропорційний його
абсолютній температурі: V = const за p = const. Це співвідношення
називають законом Гей Люссака — на честь французького вченого, який відкрив його на початку ХІХ ст.
Закон Гей Люссака дозволяє пов'язати значення об'єму і тем ператури певної маси газу у двох різних станах, якщо тиск газу в обох станах однаковий. Позначимо Vj і Tj значення об'єму й тем ператури газу в стані 1, а V2 і T2 — у стані 2. Тоді зі співвідношення
V V V V T
— = const маємо: — = —, або інакше: — = —.
t t t2 v2 t2
> Під час ізобарного процесу об'єм певної маси газу прямо пропор ційний його абсолютній температурі.
Співвідношення між об'ємом певної маси газу й абсолютною температурою за постійного тиску зображено графічно на рисунку.

п ^ ►
0 T
Цей графік називають ізобарою. Він показує, що за постійного тиску об'єм газу прямо пропорційний його абсолютній температурі.
3. Ізохорний процес
Зміну тиску й температури газу за постійного об'єму називають ізохорним процесом.
Досвідпоказує:якщонагріватигаззапостійногооб'єму,тискгазу збільшуватиметься прямо пропорційно абсолютній температурі.
Це означає, що під час ізохорного процесу тиск газу прямо про порційно його абсолютній температурі: ^ = const за V = const.
Залежність тиску газу від температури було досліджено напри кінці XVIII ст. французьким ученим Шарлем, тому наведене спів відношення називають законом Шарля.
^ У разі ізохорного процесу тиск певної маси газу прямо пропор ційний його абсолютній температурі:
Pi T2 '
Графік залежності p (T) за V = const називають ізохорою
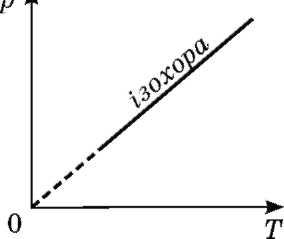
Цей графік показує, що за постійного об'єму тиск газу прямо пропорційний його абсолютній температурі.
4. Ізотермічний процес
Зміну тиску й об'єму газу за постійної температури називають ізотермічним процесом.
Досвід показує: якщо стискати газ за постійної температури, тиск зростає обернено пропорційно об'єму. Це означає, що під час ізотермічного процесу тиск газу обернено пропорційний його об'єму: pV = const за T = const.
Це співвідношення було виявлено на досліді в другій половині XVII ст. англійським ученим Бойлем і французьким ученим Марі оттом, тому його називають законом Бойля Маріотта.
разі ізотермічного процесу тиск певної маси газу обернено
пропорційний його об'єму:
 А
=
Vl
А
=
Vl
Цей графік показує, що за постійної температури тиск газу обернено пропорційний його об'єму.
Запитання до учнів під час викладу нового матеріалу
1. Накресліть графік ізобарного процесу в координатах (р, Т)
і (Р, V).
2. Накресліть графік ізохорного процесу в координатах (V, Т)
і (Р, V).
3. Накресліть графік ізотермічного процесу в координатах (V, Т) і (р Т) •
ЗАКРІПЛЕННЯ ВИВЧЕНОГО МАТЕРІАЛУ 1. Учимося розв'язувати задачі
1. Дано два графіки того самого ізопроцесу. Що це за процес? У яких осях він зображений?
? 4 ? 4

-
Газ ізотермічно стисли від об'єму 8 л до об'єму 6 л. Тиск при цьому зріс на 4 кПа. Яким був початковий тиск?
-
За температури -23 °С газ займає об'єм 60 л. Яким буде об'єм газу за температури 127 °С? Тиск газу не змінився.
