
- •ГЛАВА 1
- •ГЛАВА 2
- •МОРФОЛОГИЯ РАНЕВОГО ПРОЦЕССА
- •2.2.1 МОРФОЛОГИЯ ОГНЕСТРЕЛЬНОЙ РАНЫ
- •2.2.2. МОРФОЛОГИЯ ГНОЙНОЙ РАНЫ, ЗАКРЫТОЙ ШВАМИ
- •ГЛАВА 3
- •3. 1. МИКРОЦИРКУЛЯЦИЯ ПРИ РАНЕВОМ ПРОЦЕССЕ
- •3.2.1 КАЛЛИКРЕИН-КИНИНОВАЯ СИСТЕМА
- •3.2.2. БИОГЕННЫЕ АМИНЫ
- •3.2.3 СИСТЕМА КОМПЛЕМЕНТА
- •3.3. ОБМЕН ВЕЩЕСТВ И ЭНЕРГИИ В РАНЕ
- •3.3.2. ГЛИКОЗАМИНОГЛИКАНЫ (МУКОПОЛИСАХАРИДЫ)
- •ГЛАВА 4
- •СИСТЕМА ГЕМОСТАЗА ПРИ РАНЕВОЙ ИНФЕКЦИИ
- •4.1. РОЛЬ ОБЩИХ И МЕСТНЫХ ФАКТОРОВ ГЕМОСТАЗА ПРИ РАНЕВОМ ПРОЦЕССЕ
- •4.2. ЛОКАЛЬНАЯ ГНОЙНАЯ ИНФЕКЦИЯ И СИСТЕМА ГЕМОКОАГУЛЯЦИИ
- •4.3. ХИРУРГИЧЕСКИЙ СЕПСИС И СИСТЕМА ГЕМОКОАГУЛЯЦИИ
- •ГЛАВА 5
- •5.1. МИКРОБИОЛОГИЧЕСКИЕ АСПЕКТЫ РАНЕВОЙ ИНФЕКЦИИ
- •5.2.3. СЛУЧАЙНЫЕ РАНЫ
- •5.3. ХАРАКТЕРИСТИКА ОСНОВНЫХ ВОЗБУДИТЕЛЕЙ РАНЕВОЙ ИНФЕКЦИИ
- •5.4. КОМПЛЕКСНОЕ БАКТЕРИОЛОГИЧЕСКОЕ ИССЛЕДОВАНИЕ БИОПТАТОВ ГНОЙНЫХ РАН
- •5.4.1. БАКТЕРИОЛОГИЧЕСКИЙ КОНТРОЛЬ МИКРОФЛОРЫ ПРИ ХИРУРГИЧЕСКОЙ ОБРАБОТКЕ ГНОЙНЫХ РАН
- •ГЛАВА 6
- •6.2.2. ОПСОНИЗАЦИЯ
- •6.2.3. ФАГОЦИТОЗ
- •6.2.4. ФУНКЦИЯ ЛИМФОЦИТОВ
- •6.2.5. СЫВОРОТОЧНЫЕ ФАКТОРЫ
- •ГЛАВА 7
- •КЛИНИКА РАНЕВОГО ПРОЦЕССА
- •7.1. КЛАССИФИКАЦИЯ РАН
- •7.2. КЛАССИФИКАЦИЯ РАНЕВОГО ПРОЦЕССА
- •7.4. ОБЪЕКТИВНЫЕ КРИТЕРИИ ОЦЕНКИ ТЕЧЕНИЯ РАНЕВОГО ПРОЦЕССА
- •7.4.1. КЛИНИЧЕСКАЯ КАРТИНА
- •7.4.2. СКОРОСТЬ ЗАЖИВЛЕНИЯ РАНЫ
- •7.4.3. БАКТЕРИОЛОГИЧЕСКОЕ ИССЛЕДОВАНИЕ
- •7.4.5. МЕСТНАЯ ГЕМОСТАТИЧЕСКАЯ РЕАКЦИЯ
- •7.4.6. БИОХИМИЧЕСКОЕ ИССЛЕДОВАНИЕ РАНЕВОГО ЭКССУДАТА
- •7.4.7. ИССЛЕДОВАНИЕ ЭЛЕКТРОПОТЕНЦИАЛОВ ОБЛАСТИ РАНЫ
- •7.4.8. ИНФРАКРАСНАЯ ТЕРМОГРАФИЯ РАНЫ
- •7.4.9. СОСТОЯНИЕ МИКРОЦИРКУЛЯЦИИ
- •7.4.10. КРИТЕРИИ ЖИЗНЕСПОСОБНОСТИ ТКАНЕЙ РАНЫ
- •7.4.11. СИЛА НАТЯЖЕНИЯ РАНЫ
- •7.4.12. НАПРЯЖЕНИЕ РЕСПИРАТОРНЫХ ГАЗОВ В ОБЛАСТИ РАНЫ
- •7.4.14. ФЕРМЕНТАТИВНЫЕ ИЗМЕНЕНИЯ
- •7.5. ЗАЖИВЛЕНИЕ РАНЫ ПЕРВИЧНЫМ НАТЯЖЕНИЕМ
- •7.5.1. КЛИНИЧЕСКАЯ КАРТИНА
- •7.6. ЗАЖИВЛЕНИЕ ГНОЙНОЙ РАНЫ, ЗАКРЫТОЙ ШВАМИ
- •7.6.1. КЛИНИЧЕСКАЯ КАРТИНА
- •7.6.2. ОБЪЕКТИВНЫЕ КРИТЕРИИ ОЦЕНКИ ТЕЧЕНИЯ РАНЕВОГО ПРОЦЕССА
- •7.7 ЗАЖИВЛЕНИЕ РАНЫ ВТОРИЧНЫМ НАТЯЖЕНИЕМ
- •7.7.1. КЛИНИЧЕСКАЯ КАРТИНА
- •7.7.2. ОБЪЕКТИВНЫЕ КРИТЕРИИ ОЦЕНКИ ТЕЧЕНИЯ РАНЕВОГО ПРОЦЕССА
- •ГЛАВА 8
- •МЕСТНОЕ ЛЕЧЕНИЕ ГНОЙНЫХ РАН
- •8.1. ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ
- •8.1.1. ХИРУРГИЧЕСКАЯ ОБРАБОТКА ГНОЙНОЙ РАНЫ
- •8.1.1.1. Терминология и основные понятия
- •8.1.1.3. Предоперационная подготовка и обезболивание
- •8.1.1.4. Техника хирургической обработки гнойного очага
- •8.1.2.3. Обработка гнойной раны лучами лазера
- •8.1.2.4. Обработка гнойной раны ультразвуком
- •8.1.4. ЗАКРЫТИЕ ГНОЙНОЙ РАНЫ
- •8.1.4.1. Наложение швов на гнойную рану
- •8.1.4.2. Кожная пластика гнойной раны
- •8.2. МЕСТНАЯ ЛЕКАРСТВЕННАЯ ТЕРАПИЯ
- •8.2.1. ПРЕПАРАТЫ ДЛЯ ЛЕЧЕНИЯ ГНОЙНОЙ РАНЫ В I ФАЗЕ РАНЕВОГО ПРОЦЕССА
- •8.2.1.1. Антимикробные препараты
- •8.2.1.2. Некролитические препараты
- •8.2.2. ПРЕПАРАТЫ ДЛЯ ЛЕЧЕНИЯ ГНОЙНОЙ РАНЫ ВО II ФАЗЕ РАНЕВОГО ПРОЦЕССА
- •ОБЩЕЕ ЛЕЧЕНИЕ РАНЕВОЙ ИНФЕКЦИИ
- •9.1 ХИМИОТЕРАПИЯ РАНЕВОЙ ИНФЕКЦИИ
- •9.1.2. ВЫБОР АНТИБИОТИКА
- •9.1.3. КРИТЕРИИ ОЦЕНКИ ЭФФЕКТИВНОСТИ ЛЕЧЕНИЯ
- •9.1.4. ОСЛОЖНЕНИЯ АНТИБАКТЕРИАЛЬНОЙ ТЕРАПИИ
- •9.2. ИММУНОТЕРАПИЯ РАНЕВОЙ ИНФЕКЦИИ
- •9.2.1. ОБЩИЕ ПРИНЦИПЫ ИММУНОТЕРАПИИ ГНОЙНОЙ ХИРУРГИЧЕСКОЙ ИНФЕКЦИИ
- •9.2.3. ИММУНОКОРРЕКЦИЯ КЛЕТОЧНЫМИ ПРЕПАРАТАМИ КРОВИ
- •9.2.4. АКТИВНАЯ ИММУНИЗАЦИЯ
- •9.2.5. ИММУНОМОДУЛЯЦИЯ
- •9.3.2. ПРИМЕНЕНИЕ ИНГИБИТОРОВ ПРОТЕАЗ
- •9.3.4. ПРИМЕНЕНИЕ ГЕМОСТАТИЧЕСКИХ ПРЕПАРАТОВ
- •10.1. ИСТОРИЯ ВОПРОСА
- •10.2. МЕТОДИКА ЛЕЧЕНИЯ
- •10.4. ЛЕЧЕНИЕ РАН РАЗЛИЧНОЙ ЭТИОЛОГИИ
- •10.4.1. ОБШИРНЫЕ ГНОЙНЫЕ РАНЫ
- •10.4.2. ЛОКАЛЬНЫЕ ОЖОГИ
- •10.4.7. РОЖИСТОЕ ВОСПАЛЕНИЕ
- •10.5. РЕЗУЛЬТАТЫ ЛЕЧЕНИЯ
- •ГЛАВА 11
- •ОСОБЫЕ ВИДЫ РАНЕВОЙ ИНФЕКЦИИ
- •11.1. КЛОСТРИДИАЛЬНАЯ РАНЕВАЯ ИНФЕКЦИЯ
- •11.2. АНАЭРОБНАЯ НЕКЛОСТРИДИАЛЬНАЯ ИНФЕКЦИЯ
- •11.4. СТОЛБНЯК
- •11.5. РОЖА
- •11.6. АКТИНОМИКОЗ
- •11.7. СИБИРСКАЯ ЯЗВА
- •11.8. ДИФТЕРИЯ РАН
- •11.9. СИФИЛИС РАН
- •11.10. ТУБЕРКУЛЕЗ РАН
- •ГЛАВА 12
- •12.2.1. ВОЗБУДИТЕЛИ
- •12.3. МОРФОЛОГИЯ
- •12.5. ОСЛОЖНЕНИЯ СЕПСИСА
- •12.6. ЛЕЧЕНИЕ
- •12.6.1. АКТИВНОЕ ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ ГНОЙНЫХ ОЧАГОВ
- •12.7. ИНТЕНСИВНАЯ ТЕРАПИЯ БОЛЬНЫХ С ТЯЖЕЛОЙ ГНОЙНОЙ ИНФЕКЦИЕЙ
- •12.7.1. ОБЩИЕ ПРИНЦИПЫ
- •12.7.2. ПРЕДОПЕРАЦИОННАЯ ПОДГОТОВКА И ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ
- •12.7.3.3. Детоксикация при тяжелой гнойной инфекции
- •12.7.3.5. Коррекция нарушений системы гемокоагуляции
- •12.7.3.6. Коррекция функций жизненно важных органов
- •12.7.5. ЛЕТАЛЬНОСТЬ ПРИ СЕПСИСЕ
- •ГЛАВА 13
- •ИЗМЕНЕНИЯ НЕРВНОЙ СИСТЕМЫ ПРИ ТЯЖЕЛОЙ РАНЕВОЙ ИНФЕКЦИИ
- •14.1. ОСОБЕННОСТИ ТЕЧЕНИЯ ГНОЙНОЙ ХИРУРГИЧЕСКОЙ ИНФЕКЦИИ
- •14.2. НАРУШЕНИЯ ОБМЕНА
- •14.3. АКТИВНОЕ ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ
- •14.4. КОМПЛЕКСНАЯ ТЕРАПИЯ
- •ГЛАВА 15
- •ОБЩИЕ ПРИНЦИПЫ АКТИВНОГО ХИРУРГИЧЕСКОГО ЛЕЧЕНИЯ ГНОЙНЫХ РАН И ГНОЙНЫХ ХИРУРГИЧЕСКИХ ЗАБОЛЕВАНИЙ
ГЛАВА У
ОБЩЕЕ ЛЕЧЕНИЕ РАНЕВОЙ ИНФЕКЦИИ
В основе современной антимикробной химиотерапии лежит активное вмешательство в течение инфекционного процесса путем воздействия на жизнедеятельность болезнетворного агента при помощи различных химических веществ. Эра антимикробной химиотерапии началась с введения в практику стрептоцида. Затем появился сульфидин, в 1935—1946 гг. создано большое количество высокоактивных сульфаниламидных препаратов. В 1929 г. А. Флемингом был открыт пенициллин. Однако в то время в медицине существовало мнение, согласно которому препарат, токсичный для микроорганизма, в равной степени токсичен и для макроорганизма. Авторитет сторонников этого мнения в то время был настолько велик, что пенициллин был забыт более чем на 10 лет. Только проведенные С. N. Florey в 1940 г. исследования свойств этого препарата, успешное лечение 5 больных, а также заинтересованность военно-полевых хирургов послужили толчком к усовершенствованию пенициллина и широкому использованию его в медицине. В дальнейшем было создано значительное число антибиотиков и химиопрепаратов (нитрофураны, диоксидин и др.).
Подавление одного вида организмов други ми (явление антибиоза) широко распространено в природе. Антибиоз связан или с выделением клеткой химического вещества —
9.1 ХИМИОТЕРАПИЯ РАНЕВОЙ ИНФЕКЦИИ
антибиотика, угнетающего жизнедеятельность другой, являющейся антагонистом данного вида живой клетки, либо с действием литических ферментов, разрушающих клеточные стенки бактерий, грибов, высших растений.
Первым ферментом, обладающим литическим действием на клеточные стенки микроорганизмов, был лизоцим, открытый А. Флемингом в начале 30-х годов. В начале 50-х годов появились первые сообщения о бактериальных литических ферментах. В настоящее время можно считать, что данные ферменты обнаружены у всех представителей микроорганизмов.
Разница в действии литических ферментов на грамотрицательные и грамположительные микроорганизмы связана с различиями в строении их клеточной оболочки [Кулаев И. С. и др., 1984]. На рис. 9.1, 9.2 представлены схемы строения оболочек этих двух типов микроорганизмов. В их состав входят цитоплазматическая мембрана и пептидогликан. Между этими структурами лежит периплазматическое пространство с большим набором ферментов, в первую очередь гидролаз. Наряду с общими чертами имеются существенные различия в строении клеточной оболочки. Пептидогликан грамположительных микроорганизмов является многослойной структурой толщиной 70—80 мкм, и он составляет до 80% массы клеточной оболочки. У грамотрицательных микроорганизмов этот компонент расположен в 1—2 слоя, толщина его не превышает 8 мкм.
Основное |
различие в строении |
оболочек |
этих двух |
типов микроорганизмов |
заключа- |
ется в наличии у грамотрицательных форм внешней мембраны. Литические ферменты не могут гидролизовать нептидогликаповый слой в целых клетках бактерий без удаления внешней мембраны, которое достигается хелатирующими агентами, детергентами или физи ческими методами.
Механизм действия антибиотиков различен. Чтобы воздействовать на микробную клетку,
антибиотик |
должен: 1) |
проникнуть в нее; |
2) связаться |
с той или |
иной внутриклеточной |

ОБЩЕЕ ЛЕЧЕНИЕ РАНЕВОЙ ИНФЕКЦИИ
1
2
Рис. 9.1. Строение клеточной оболочки грамотрицательных микроорга низмов (схема) [Кулаев И. С. и др., 1984].
а — внешняя мембрана; б — пептидогликан; в — периплазма, г — цитоплазматическая мембрана.
Рис. 9.2. Строение клеточной оболочки грамположительных микроорганизмов (схема) [Кулаев И. С. и др., 1984].
С — клеточная стенка; М — цитонлазматическая мембрана; 1 — пептидогликан; 2 —липотейхоевые кислоты; 3 — тейхоевые кислоты.
РАНЫ И РАНЕВАЯ ИНФЕКЦИЯ
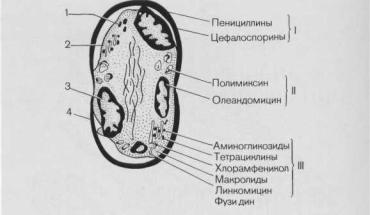
Рис. 9.3. Механизм действия основных антибактериальных препаратов, применяемых в клинической практике (по В. М. Мельниковой с изменениями). Объяснение в тексте.
1 — рибосомы; 2 — цитоплазматическая мембрана; 3 — митохондрии; 4 — оболочка; I — антибиотики, ингибирующие синтез клеточной оболочки; II — антибиотики, нарушающие функции мембран; III — антибиотики, ингибирующие синтез белка и нарушающие обмен РНК.
структурой, участвующей в каком-либо процессе, необходимом для поддержания жизне деятельности или роста клетки; 3) полностью подавить этот процесс [Lancini J., Parenti F., 1982]. На рис. 9.3 схематически представлен механизм действия на клетку некоторых антибактериальных препаратов, применяемых в клинической практике.
Как видно из этой схемы, все препараты могут быть разделены на четыре группы: 1) подавляющие синтез клеточной оболочки,— пенициллины, цефалоспорины, ристомицин, циклосерин; 2) участвующие в нарушении проницаемости клеточной мембраны,— полимиксины (В, Е, М), полнены (нистатин, амфотерицин В); 3) подавляющие синтез белка и нарушающие функцию рибосом,— аминогликозиды (стрептомицин, мономицин, канамицин, гентамицин, тобрамицин, сизомицин, нетилмицин, амикацин), тетрациклины, хлорамфеникол (левомицетин), эритромицин, линкомицин; 4) ингибирующие синтез и метаболизм нуклеи новых кислот,— противоопухолевые антибиотики, рифамницин.
Механизм действия сульфаниламидов бактериостатический. Нарушая синтез парааминобензойной кислоты, необходимый для существования микробной клетки, они подавляют рост ее и действуют только в стадии деления клетки. В человеческом организме сульфаниламиды могут частично инактивироваться путем ацетилирования, окисления. Ацетилированная форма обладает плохой растворимостью, в связи с чем может возникнуть кристаллурия. Способностью к диффузии в тканевые жидкости и ткани обладают только свободные сульфаниламиды, не связанные с белками сыворотки крови.
Разнообразие возбудителей неспецифических и специфических воспалительных процессов, различная чувствительность их к антибиотикам определили появление очень большого числа антибактериальных препаратов, предлагаемых для использования в клинической практике. Растет также количество химиопрепаратов. Отечественная промышленность в настоящее время выпускает более 50 антибиотиков и около 200 лекарственных форм на их основе.
В клинической практике широко применяются беталактамовые антибиотики, включающие пенициллины и цефалоепорины и особенно полусинтетические пенициллины:
1) производные 6-аминоненицил- лоновой кислоты (6-АПК) — оксациллин и диклоксациллин, высокоактивные по отношению к пенициллиназообразующим стафилококкам;
2)производные а-аминобензилпе- нициллина — ампициллин. Ампициллин и комбинированный препарат ампиокс — пенициллины с широким спектром действия;
3)производные а-карбоксибензил-
пенициллина — карбенициллин, пре-
парат, активный к некоторым штаммам синегнойной палочки.
Для борьбы с пенициллиназорезистентными штаммами стафилококка большое значение приобрели (5-лактамные антибиотики из группы цефалоспоринов, являющиеся производными 7-аминоцефалоспориновой кислоты (7-АЦК),— препараты с широким спектром действия, устойчивые к пенициллиназам. В связи с изменением этиологической структуры хирургических инфекций и учащением случаев грамотрицательных бактериальных инфекций, особое значение приобретают в последние годы аминогликозидные антибиотики: гентамицин, тобрамицин, сизомицин, амикацин (производное канамицина А), дибекацин (производное канамицина В) и нетилмицин (производное неомицина) [Лобусева А. Н. и др., 1985; Sanderson P. J., 1984].
Для борьбы с гнойными процессами, вызванными неспорообразующими анаэробами (Bacteroides fragilis, Fusobacterium, Peptococcus magnus, Peptostreptococcus и др.), препаратами выбора остаются метронидизол (флагил, метрагил), тинидазол (триканикс), клиндамицин (далацин С), хлорамфеникол, цефокситин, диоксидин [Трескина О. С. и др., 1982; Ку-
зин М. И. |
и др., 1983; |
Пономаре- |
||
ва |
Т. |
Р. и др., 1984; Колесов А. П. |
||
и |
др., |
1985; |
Anderson С. |
В. et al., |
1979; Kirby W. M., 1983; Jepahani P., 1983].
При недостаточной эффективности или непереносимости антибактериальных препаратов широко используются внутривенно нитрофураны (фурагин К) [Алксне-Крауле И. Я. и др., 1968; Курбангалеев С. М. и др., 1977; Венгер И. К., 1984] и диоксидин (производное ди-1Ч-оксихиноксалина) [Падейская Е. Н., 1984]. Не утратили своего значения макролиды, рифам - пицины, фузидин-натрий, полимиксины.
Антибиотики и химиопрепараты играют большую роль в различных областях медицины, особенно при лечении раневых инфекций. Но одновре-
менно они обусловили и ряд отрицательных явлений.
При широком применении антибиотиков выяснилось, что в ряде случаев они вызывают токсические и аллергические реакции, иногда тяжелые — до анафилактического шока включительно [Купчинскас Ю. К. и др., 1972; Грачева Н. М., 1978; Королев Ю. Ф., Пильтиенко Л. Ф., 1978; Lancini J., Parenti F., 1982].
Бичом антибактериальной терапии стала антибиотикоустойчивость большинства представителей раневой микрофлоры к наиболее распространенным антибиотикам первого поколения (пенициллин, стрептомицин, тетрациклин, хлорамфеникол [Змушко Л. С. и др., 1980; Ревенко Т. А. и др., 1980; Фурманенко Н. Ф. и др., 1984]. По данным С. М. Навашина и И. П. Фоминой (1983), коэффициент активности перечисленных антибактериальных препаратов сейчас не превышает 40%. В то же время коэффициент эффективности полусинтетических пенициллинов, цефалоспоринов, аминогликозидов, фузидина, линкомицина достигает 80—90%, что подтверждается и нашими данными.
Увеличение числа устойчивых штаммов объясняют появлением внехромосомных генетических частиц — R-плазмидов, переходящих из одной бактериальной клетки в другую (как
в |
различных типах бактерий, так и в |
|
одном и том |
же типе). С переходом |
|
в |
другую |
бактериальную клетку |
R-плазмиды |
переносят генетическую |
|
информацию механизма устойчивости. Кроме того, с помощью плазмид бактерии выделяют энзимы, разлагающие антибиотики. Благодаря присутствию плазмид увеличивается вирулентность бактерий. Такие бактерии способны выделять эндотоксин и образовывать большое количество мутантов, более устойчивых к антибактериальным препаратам [Генчиков Л. А. и др., 1984; Петровская В. Г.,
1984; |
Lacy R. |
W., |
1980; |
Rich- |
mond М. Н., Petrocheilon V., |
1981; |
|||
Brian L. E., 1982; Mitsuhashi S., Ka- |
||||
nabe |
H., 1982; |
Kirby |
W. M., |
1983]. |
Антибиотики сыграли также отри- |
метод дисков. В последние годы в |
||||||||||||||||||
цательную |
роль |
в |
|
распространении |
практику внедряется метод диффу- |
||||||||||||||
внутригоспитальной |
|
инфекции. |
Все |
зии, основанный на принципе быстрой |
|||||||||||||||
это |
значительно |
ухудшает |
результаты |
элюции |
антибиотика |
с пропитанных |
|||||||||||||
лечения и является причиной охлаж- |
им бумажных дисков. Метод диффу- |
||||||||||||||||||
дения отношения |
ряда |
клиницистов |
зии |
применяется |
для |
диагностики |
|||||||||||||
к |
антибиотикотерапии |
или |
поводом |
анаэробных бактерий и в автомати- |
|||||||||||||||
к применению низких дозировок, со- |
зированных диагностических системах |
||||||||||||||||||
кращению сроков лечения (из-за бояз- |
[Washington |
J. А., |
1980]. |
|
|
||||||||||||||
ни осложнений) и отказу от назна- |
Определение видового состава мик- |
||||||||||||||||||
чения |
антибактериального |
лечения |
рофлоры и ее чувствительности к |
||||||||||||||||
больных с так называемой малой |
антибиотикам является обязательным. |
||||||||||||||||||
инфекцией. |
|
|
|
|
|
|
|
|
В экстренных ситуациях до уточне- |
||||||||||
Наш многолетний опыт применения |
ния этих данных нужно ориентиро- |
||||||||||||||||||
новых антибиотиков в гнойной хи- |
ваться на локализацию ранения или |
||||||||||||||||||
рургии, в том числе при лечении ран |
гнойного |
процесса, |
на |
|
«тропизм» |
||||||||||||||
и раневой инфекции, и испытание |
определенных антибиотиков к тканям, |
||||||||||||||||||
новых |
препаратов |
показывают, |
что |
на |
распространенность |
и |
характер |
||||||||||||
при правильном подборе антибиоти- |
поражения [Мельникова В. М., 1975; |
||||||||||||||||||
ка, адекватной дозировке и способе |
Маршак А. М., Костюченок Б. М., 1977], |
||||||||||||||||||
его введения, а также при соответ- |
на вид и характер гноя, которые в |
||||||||||||||||||
ствующем контроле за эффектив- |
определенной мере говорят о виде |
||||||||||||||||||
ностью и безопасностью лечения к |
микроба [Черномордик А. Б., 1980]. |
||||||||||||||||||
такому |
охлаждению |
нет |
оснований. |
Как показывают наши исследова- |
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
ния, в группе больных с острыми |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
гнойными |
хирургическими |
заболе- |
|||||
9.1.1. ПРИНЦИПЫ ВЫБОРА |
|
|
|
ваниями |
|
основным |
возбудителем |
||||||||||||
ПРЕПАРАТА |
|
|
|
|
|
|
|
|
раневой инфекции были стафилококки |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
(79,7%), причем при посттравмати- |
|||||||
Как считает большинство специа- |
ческих |
гнойных |
ранах |
патогенный |
|||||||||||||||
листов, |
занимающихся |
химиотера- |
стафилококк в монокультуре выявлен |
||||||||||||||||
пией раневой инфекции, выбор анти- |
только у 57,8%, у остальных больных |
||||||||||||||||||
биотика |
|
должен |
|
осуществляться |
с |
этой группы высевалась грамотри- |
|||||||||||||
учетом |
чувствительности |
|
предпола- |
цательная микрофлора как в моно- |
|||||||||||||||
гаемого |
возбудителя |
инфекции, |
его |
культуре, так и в ассоциациях с |
|||||||||||||||
распределения в органах и тканях, |
грамположительной флорой. |
|
|||||||||||||||||
токсичности |
антибиотика, |
|
совмести- |
У больных сепсисом раневая мик- |
|||||||||||||||
мости его как с другими антибакте- |
рофлора носит полиморфный харак- |
||||||||||||||||||
риальными препаратами, так и с ле- |
тер и у большинства из них (72,1%) |
||||||||||||||||||
карственными веществами, используе- |
представлена грамотрицательной мик- |
||||||||||||||||||
мыми в схеме лечения [Черномор- |
робной |
флорой |
с |
преобладанием |
|||||||||||||||
дик А. Б., 1973; Стручков В. И. и др., |
синегнойной палочки (43,7%). |
||||||||||||||||||
1975; Навашин С. М., Фомина И. П., |
Чувствительность |
возбудителя ин- |
|||||||||||||||||
1983; Мельникова В. М., 1975; Беля- |
фекции к данному антибиотику явля- |
||||||||||||||||||
ков В. Д. и др., 1976; Маршак А. М., |
ется одним из основных показаний к |
||||||||||||||||||
Костюченок Б. М., 1977]. |
|
|
|
его применению. Чем выше чувст- |
|||||||||||||||
Рациональный подход к антими- |
вительность, тем эффективнее ле- |
||||||||||||||||||
кробной терапии инфекции основы- |
чение. |
|
|
|
|
|
|
||||||||||||
вается на изоляции и идентификации |
На рис. 9.4 показано соотношение |
||||||||||||||||||
микроорганизма, определении его чув- |
эффективности лечения в зависи- |
||||||||||||||||||
ствительности к антимикробным пре- |
мости от препарата, к которому |
||||||||||||||||||
паратам. |
Существуют |
два |
|
основных |
микроб был высокоили малочув- |
||||||||||||||
метода |
определения |
чувствительно- |
ствителен. Степенью чувствительности |
||||||||||||||||
сти — метод |
серийных |
разведений и |
принято считать величину минималь- |
||||||||||||||||

Рис. 9.4. Эффективность лечения в зависимости от минимальной подавляющей концентрации препарата (МПК) (В числителе дробей указано число больных, леченных успешно, в знаменателе — общее число больных).
ной подавляющей концентрации антибиотика (МПК). При МПК до 3 мкг/мл, создаваемой при обычных терапевтических дозах препарата, можно добиться успеха у 60% больных. При МПК 30 мкг/мл и выше лечение данным препаратом безрезультатно. Однако это не означает, что таких больных не следует лечить антибиотиками. Наоборот, следует использовать максимально допустимые дозы препаратов и проводить комбинированное лечение несколькими антибиотиками.
При тяжелом течении инфекционного процесса используют метод разведения для выявления минимальной концентрации антибиотика, подавляющей рост выделенного возбудителя, что позволяет правильно выбрать не только антибактериальный препарат, но и его дозу.
Обычные методы определения чувствительности возбудителя к антибиотику в хирургической практике недостаточно информативны, так как ответ клиницисты получают на 3—7-и сутки, когда в препарате уже нет надобности или когда уже произошла смена возбудителя раневого процесса более патогенным госпитальным штаммом микроба. Экспресс-методы определения чувствительности позволяют уже на следующие сутки получить ответ и целенаправленно проводить антибактериальную терапию. Эти ускоренные методы основаны на:
1) способности антибиотиков подавлять ферментативную активность
чувствительных к ним микробов, что сопровождается изменением цвета соответствующего индикатора;
2) изменении окислительно-восста- новительного потенциала питательной среды в процессе роста микроорганизмов, о чем судят по изменению цвета добавляемых к среде индикаторов;
3) обнаружении образования инволюционных форм бактерий под воздействием антибиотика при фазовоконтрастной микроскопии [Навашин С. М., Фомина И. П., 1982];
4)применении методов целлюлознофлюоресцирующих антител и ускоренной биохимической диагностики возбудителя по 12 рациональным признакам, учитываемым на 4 комплексных средах [Бондаренко В. М. и ДР-, 1983];
5)способности дезаминировать фенилаланин и триптофандезаминазу протеев [Куланча А. П. и др., 1983];
6)более высокой протеолитической активности синегнойной палочки [Валигура Я. С. и др., 1983];
7)выявлении меченных радионук-
лидами | 2 5 1 антител [Молокост А. А.
идр., 1983].
Для экспресс-диагностики анаэроб-
ной инфекции используются люминесцентная и фазово-контрастная микроскопия [Тышко А. Г., 1983; Махмудов Ю. И. и др., 1983].
С целью одноступенчатого выделения бактерий рода Proteus и экспрессопределения их антибиотикограмм применяется сухая селективная среда (ССС) [Газиумарова Л. Д. и др., 1983].
