
- •ГЛАВА 1
- •ГЛАВА 2
- •МОРФОЛОГИЯ РАНЕВОГО ПРОЦЕССА
- •2.2.1 МОРФОЛОГИЯ ОГНЕСТРЕЛЬНОЙ РАНЫ
- •2.2.2. МОРФОЛОГИЯ ГНОЙНОЙ РАНЫ, ЗАКРЫТОЙ ШВАМИ
- •ГЛАВА 3
- •3. 1. МИКРОЦИРКУЛЯЦИЯ ПРИ РАНЕВОМ ПРОЦЕССЕ
- •3.2.1 КАЛЛИКРЕИН-КИНИНОВАЯ СИСТЕМА
- •3.2.2. БИОГЕННЫЕ АМИНЫ
- •3.2.3 СИСТЕМА КОМПЛЕМЕНТА
- •3.3. ОБМЕН ВЕЩЕСТВ И ЭНЕРГИИ В РАНЕ
- •3.3.2. ГЛИКОЗАМИНОГЛИКАНЫ (МУКОПОЛИСАХАРИДЫ)
- •ГЛАВА 4
- •СИСТЕМА ГЕМОСТАЗА ПРИ РАНЕВОЙ ИНФЕКЦИИ
- •4.1. РОЛЬ ОБЩИХ И МЕСТНЫХ ФАКТОРОВ ГЕМОСТАЗА ПРИ РАНЕВОМ ПРОЦЕССЕ
- •4.2. ЛОКАЛЬНАЯ ГНОЙНАЯ ИНФЕКЦИЯ И СИСТЕМА ГЕМОКОАГУЛЯЦИИ
- •4.3. ХИРУРГИЧЕСКИЙ СЕПСИС И СИСТЕМА ГЕМОКОАГУЛЯЦИИ
- •ГЛАВА 5
- •5.1. МИКРОБИОЛОГИЧЕСКИЕ АСПЕКТЫ РАНЕВОЙ ИНФЕКЦИИ
- •5.2.3. СЛУЧАЙНЫЕ РАНЫ
- •5.3. ХАРАКТЕРИСТИКА ОСНОВНЫХ ВОЗБУДИТЕЛЕЙ РАНЕВОЙ ИНФЕКЦИИ
- •5.4. КОМПЛЕКСНОЕ БАКТЕРИОЛОГИЧЕСКОЕ ИССЛЕДОВАНИЕ БИОПТАТОВ ГНОЙНЫХ РАН
- •5.4.1. БАКТЕРИОЛОГИЧЕСКИЙ КОНТРОЛЬ МИКРОФЛОРЫ ПРИ ХИРУРГИЧЕСКОЙ ОБРАБОТКЕ ГНОЙНЫХ РАН
- •ГЛАВА 6
- •6.2.2. ОПСОНИЗАЦИЯ
- •6.2.3. ФАГОЦИТОЗ
- •6.2.4. ФУНКЦИЯ ЛИМФОЦИТОВ
- •6.2.5. СЫВОРОТОЧНЫЕ ФАКТОРЫ
- •ГЛАВА 7
- •КЛИНИКА РАНЕВОГО ПРОЦЕССА
- •7.1. КЛАССИФИКАЦИЯ РАН
- •7.2. КЛАССИФИКАЦИЯ РАНЕВОГО ПРОЦЕССА
- •7.4. ОБЪЕКТИВНЫЕ КРИТЕРИИ ОЦЕНКИ ТЕЧЕНИЯ РАНЕВОГО ПРОЦЕССА
- •7.4.1. КЛИНИЧЕСКАЯ КАРТИНА
- •7.4.2. СКОРОСТЬ ЗАЖИВЛЕНИЯ РАНЫ
- •7.4.3. БАКТЕРИОЛОГИЧЕСКОЕ ИССЛЕДОВАНИЕ
- •7.4.5. МЕСТНАЯ ГЕМОСТАТИЧЕСКАЯ РЕАКЦИЯ
- •7.4.6. БИОХИМИЧЕСКОЕ ИССЛЕДОВАНИЕ РАНЕВОГО ЭКССУДАТА
- •7.4.7. ИССЛЕДОВАНИЕ ЭЛЕКТРОПОТЕНЦИАЛОВ ОБЛАСТИ РАНЫ
- •7.4.8. ИНФРАКРАСНАЯ ТЕРМОГРАФИЯ РАНЫ
- •7.4.9. СОСТОЯНИЕ МИКРОЦИРКУЛЯЦИИ
- •7.4.10. КРИТЕРИИ ЖИЗНЕСПОСОБНОСТИ ТКАНЕЙ РАНЫ
- •7.4.11. СИЛА НАТЯЖЕНИЯ РАНЫ
- •7.4.12. НАПРЯЖЕНИЕ РЕСПИРАТОРНЫХ ГАЗОВ В ОБЛАСТИ РАНЫ
- •7.4.14. ФЕРМЕНТАТИВНЫЕ ИЗМЕНЕНИЯ
- •7.5. ЗАЖИВЛЕНИЕ РАНЫ ПЕРВИЧНЫМ НАТЯЖЕНИЕМ
- •7.5.1. КЛИНИЧЕСКАЯ КАРТИНА
- •7.6. ЗАЖИВЛЕНИЕ ГНОЙНОЙ РАНЫ, ЗАКРЫТОЙ ШВАМИ
- •7.6.1. КЛИНИЧЕСКАЯ КАРТИНА
- •7.6.2. ОБЪЕКТИВНЫЕ КРИТЕРИИ ОЦЕНКИ ТЕЧЕНИЯ РАНЕВОГО ПРОЦЕССА
- •7.7 ЗАЖИВЛЕНИЕ РАНЫ ВТОРИЧНЫМ НАТЯЖЕНИЕМ
- •7.7.1. КЛИНИЧЕСКАЯ КАРТИНА
- •7.7.2. ОБЪЕКТИВНЫЕ КРИТЕРИИ ОЦЕНКИ ТЕЧЕНИЯ РАНЕВОГО ПРОЦЕССА
- •ГЛАВА 8
- •МЕСТНОЕ ЛЕЧЕНИЕ ГНОЙНЫХ РАН
- •8.1. ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ
- •8.1.1. ХИРУРГИЧЕСКАЯ ОБРАБОТКА ГНОЙНОЙ РАНЫ
- •8.1.1.1. Терминология и основные понятия
- •8.1.1.3. Предоперационная подготовка и обезболивание
- •8.1.1.4. Техника хирургической обработки гнойного очага
- •8.1.2.3. Обработка гнойной раны лучами лазера
- •8.1.2.4. Обработка гнойной раны ультразвуком
- •8.1.4. ЗАКРЫТИЕ ГНОЙНОЙ РАНЫ
- •8.1.4.1. Наложение швов на гнойную рану
- •8.1.4.2. Кожная пластика гнойной раны
- •8.2. МЕСТНАЯ ЛЕКАРСТВЕННАЯ ТЕРАПИЯ
- •8.2.1. ПРЕПАРАТЫ ДЛЯ ЛЕЧЕНИЯ ГНОЙНОЙ РАНЫ В I ФАЗЕ РАНЕВОГО ПРОЦЕССА
- •8.2.1.1. Антимикробные препараты
- •8.2.1.2. Некролитические препараты
- •8.2.2. ПРЕПАРАТЫ ДЛЯ ЛЕЧЕНИЯ ГНОЙНОЙ РАНЫ ВО II ФАЗЕ РАНЕВОГО ПРОЦЕССА
- •ОБЩЕЕ ЛЕЧЕНИЕ РАНЕВОЙ ИНФЕКЦИИ
- •9.1 ХИМИОТЕРАПИЯ РАНЕВОЙ ИНФЕКЦИИ
- •9.1.2. ВЫБОР АНТИБИОТИКА
- •9.1.3. КРИТЕРИИ ОЦЕНКИ ЭФФЕКТИВНОСТИ ЛЕЧЕНИЯ
- •9.1.4. ОСЛОЖНЕНИЯ АНТИБАКТЕРИАЛЬНОЙ ТЕРАПИИ
- •9.2. ИММУНОТЕРАПИЯ РАНЕВОЙ ИНФЕКЦИИ
- •9.2.1. ОБЩИЕ ПРИНЦИПЫ ИММУНОТЕРАПИИ ГНОЙНОЙ ХИРУРГИЧЕСКОЙ ИНФЕКЦИИ
- •9.2.3. ИММУНОКОРРЕКЦИЯ КЛЕТОЧНЫМИ ПРЕПАРАТАМИ КРОВИ
- •9.2.4. АКТИВНАЯ ИММУНИЗАЦИЯ
- •9.2.5. ИММУНОМОДУЛЯЦИЯ
- •9.3.2. ПРИМЕНЕНИЕ ИНГИБИТОРОВ ПРОТЕАЗ
- •9.3.4. ПРИМЕНЕНИЕ ГЕМОСТАТИЧЕСКИХ ПРЕПАРАТОВ
- •10.1. ИСТОРИЯ ВОПРОСА
- •10.2. МЕТОДИКА ЛЕЧЕНИЯ
- •10.4. ЛЕЧЕНИЕ РАН РАЗЛИЧНОЙ ЭТИОЛОГИИ
- •10.4.1. ОБШИРНЫЕ ГНОЙНЫЕ РАНЫ
- •10.4.2. ЛОКАЛЬНЫЕ ОЖОГИ
- •10.4.7. РОЖИСТОЕ ВОСПАЛЕНИЕ
- •10.5. РЕЗУЛЬТАТЫ ЛЕЧЕНИЯ
- •ГЛАВА 11
- •ОСОБЫЕ ВИДЫ РАНЕВОЙ ИНФЕКЦИИ
- •11.1. КЛОСТРИДИАЛЬНАЯ РАНЕВАЯ ИНФЕКЦИЯ
- •11.2. АНАЭРОБНАЯ НЕКЛОСТРИДИАЛЬНАЯ ИНФЕКЦИЯ
- •11.4. СТОЛБНЯК
- •11.5. РОЖА
- •11.6. АКТИНОМИКОЗ
- •11.7. СИБИРСКАЯ ЯЗВА
- •11.8. ДИФТЕРИЯ РАН
- •11.9. СИФИЛИС РАН
- •11.10. ТУБЕРКУЛЕЗ РАН
- •ГЛАВА 12
- •12.2.1. ВОЗБУДИТЕЛИ
- •12.3. МОРФОЛОГИЯ
- •12.5. ОСЛОЖНЕНИЯ СЕПСИСА
- •12.6. ЛЕЧЕНИЕ
- •12.6.1. АКТИВНОЕ ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ ГНОЙНЫХ ОЧАГОВ
- •12.7. ИНТЕНСИВНАЯ ТЕРАПИЯ БОЛЬНЫХ С ТЯЖЕЛОЙ ГНОЙНОЙ ИНФЕКЦИЕЙ
- •12.7.1. ОБЩИЕ ПРИНЦИПЫ
- •12.7.2. ПРЕДОПЕРАЦИОННАЯ ПОДГОТОВКА И ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ
- •12.7.3.3. Детоксикация при тяжелой гнойной инфекции
- •12.7.3.5. Коррекция нарушений системы гемокоагуляции
- •12.7.3.6. Коррекция функций жизненно важных органов
- •12.7.5. ЛЕТАЛЬНОСТЬ ПРИ СЕПСИСЕ
- •ГЛАВА 13
- •ИЗМЕНЕНИЯ НЕРВНОЙ СИСТЕМЫ ПРИ ТЯЖЕЛОЙ РАНЕВОЙ ИНФЕКЦИИ
- •14.1. ОСОБЕННОСТИ ТЕЧЕНИЯ ГНОЙНОЙ ХИРУРГИЧЕСКОЙ ИНФЕКЦИИ
- •14.2. НАРУШЕНИЯ ОБМЕНА
- •14.3. АКТИВНОЕ ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ
- •14.4. КОМПЛЕКСНАЯ ТЕРАПИЯ
- •ГЛАВА 15
- •ОБЩИЕ ПРИНЦИПЫ АКТИВНОГО ХИРУРГИЧЕСКОГО ЛЕЧЕНИЯ ГНОЙНЫХ РАН И ГНОЙНЫХ ХИРУРГИЧЕСКИХ ЗАБОЛЕВАНИЙ
ГЛАВА 2
МОРФОЛОГИЯ РАНЕВОГО ПРОЦЕССА
В истории изучения гистогенеза раневого процесса можно наметить три периода. В течение первого, растянувшегося от глубокой древности до середины XIX в., у врачей сложилось общее впечатление о ходе заживления раны, каким оно рисуется невооруженному глазу. Развитие микроскопической техники во второй половине XIX в. и открывшаяся возможность следить за течением раневого процесса уже не только по внешнему виду раны, но и на основании изучения участвующих в этом процессе клеточных элементов положили начало второму периоду, продолжавшемуся примерно до 50-х годов настоящего столетия. Третий, современный, период в истории изучения раневого процесса обусловлен появлением гистохимических, иммунохимических методов исследования, электронной микроскопии, авторадиографии, позволивших дополнить представления о взаимоотношении различных клеток сведениями о тонких и сложных процессах, развертывающихся при этом внутри каждой из них. Материалы, полученные в течение трех отмеченных периодов, взаимно дополняли друг друга и способствовали все более глубокому пониманию сущности процесса заживления ран.
Успехи в изучении динамики раневого процесса имеют теоретическое и прикладное значение. Только имея точное представление о функции и
2.1. ОБЩИЕ ДАННЫЕ О ФУНКЦИОНАЛЬНОЙ МОРФОЛОГИИ РАНЕВОГО ПРОЦЕССА
механизмах взаимодействия каждой из клеток, участвующих в раневом процессе, можно разработать рациональные, высокоэффективные методы лечения ран и предупреждения осложнений в их течении.
Раневой процесс является примером взаимоотношений клеточных элементов, действующих в ограниченной области, но непосредственно не связанных друг с другом. Это дает возможность изучать общие для различных патологических процессов механизмы регулирования работы одних клеток другими посредством их временных контактов или даже дистационно, т. е. когда они находятся на некотором расстоянии друг от друга и осуществляют взаимные влияния гуморальным путем.
Давно сложилось представление о том, что раневой процесс отличается цикличностью, т. е. в своем развитии закономерно проходит несколько стадий или фаз, последовательно сменяющих друг друга. Клиническая, анатомическая и патологическая характеристика этих стадий представлена в многочисленных хорошо известных работах Н. И. Пирогова, М. Н. Никифорова, С. С. Гирголава, И. В. Давыдовского, Н. Н. Аничкова, К. Г. Волковой и В. Г. Гаршина, И. Г. Руфанова, F. Marchand и др. В основном эта характеристика остается незыблемой, и если сегодня мы и ушли вперед в понимании сущности раневого про-
цесса сравнительно с тем, что было |
Собственно раневой процесс разде- |
||||||||||||||||
известно о нем всего 20-—30 лет назад, |
ляют на три основные фазы. Первая |
||||||||||||||||
то только в плане его дальнейшей |
фаза |
заключается |
в |
расплавлении |
|||||||||||||
структурно-функциональной детали- |
некротизированных тканей и очище- |
||||||||||||||||
зации, но не в отношении введения |
нии от них раневого дефекта. Продол- |
||||||||||||||||
новых стадий или замены ими обще- |
жительность этого периода определя- |
||||||||||||||||
принятых. Вот почему в дальнейшем |
ется |
объемом повреждения, |
степенью |
||||||||||||||
при изложении материала мы будем |
инфицированности раны, особенностя- |
||||||||||||||||
придерживаться |
исторически |
сложив- |
ми иммунной защиты организма и др. |
||||||||||||||
шейся периодизации процесса зажив- |
и составляет в среднем 3—6 сут. |
||||||||||||||||
ления ран, а о том, что уже хорошо |
Начальной |
реакцией |
организма на |
||||||||||||||
известно, будем упоминать в общих |
травму является спазм сосудов в об- |
||||||||||||||||
чертах, обращая главное внимание на |
ласти раны, сменяемый их паралити- |
||||||||||||||||
данные об участии и роли различных |
ческим |
расширением, |
повышением |
||||||||||||||
клеточных элементов в течении ране- |
проницаемости |
сосудистой |
стенки и |
||||||||||||||
вого процесса, полученные в послед- |
быстро нарастающим отеком, который |
||||||||||||||||
ние |
10—15 лет. |
|
|
|
|
|
получил |
название |
травматического. |
||||||||
Механическая |
|
травма — сложный |
Развивающиеся под влиянием распада |
||||||||||||||
процесс |
взаимодействия |
организма |
с |
погибших тканей местные нарушения |
|||||||||||||
ранящим снарядом, складывающийся |
обмена |
веществ |
(ацидоз, |
изменение |
|||||||||||||
из двух главных компонентов: измене- |
состояния коллоидов и др.) способст- |
||||||||||||||||
ний, связанных непосредственно с по- |
ствуют |
его |
прогрессированию. |
Отек |
|||||||||||||
вреждением тканей, и тех изменений, |
может быть столь значительным, что |
||||||||||||||||
которые являются реакцией организма |
просвет |
раневого канала суживается |
|||||||||||||||
на это повреждение. Первый компо- |
или даже исчезает, а часть его содер- |
||||||||||||||||
нент определяется особенностями ра- |
жимого, т. е. мертвые ткани, пропи- |
||||||||||||||||
нящего |
снаряда, |
его |
кинетической |
танные кровью, выдавливаются нару- |
|||||||||||||
энергией, |
направлением |
действия |
и |
жу (так называемое первичное очище- |
|||||||||||||
т. д. Различают прямое (местное) и |
ние раны). |
|
|
|
|
|
|
||||||||||
непрямое (отраженное) действие трав- |
Расширение сосудов |
сопровождает- |
|||||||||||||||
мы. Следствием прямого действия ра- |
ся нарушением |
их |
проницаемости. |
||||||||||||||
нящего снаряда являются омертвение |
Оно возникает уже через несколько |
||||||||||||||||
тканей, кровотечение из разрушенных |
минут после повреждения и связано с |
||||||||||||||||
сосудов и повреждения нервного ап- |
выделением |
гистамина |
и |
частично |
|||||||||||||
парата. |
В |
результате механического |
серотонина [Miles A., 1966]. Гистамин |
||||||||||||||
воздействия на ткани, их малокровия, |
расширяет просвет артериол, капилля- |
||||||||||||||||
обусловленного кровотечением, и на- |
ров, |
венул, |
ускоряет |
капиллярный |
|||||||||||||
рушения иннервации возникает свое- |
кровоток и повышает проницаемость |
||||||||||||||||
образный |
«местный раневой |
шок» — |
капилляров. Он стимулирует фагоци- |
||||||||||||||
обратимое пар абиотическое торможе- |
тоз и укорачивает время кровотече- |
||||||||||||||||
ние тканей [Галкин В. С, 1954]. Не- |
ния. Гистамин выделяется при дегра- |
||||||||||||||||
прямое |
действие |
ранящего |
снаряда |
нуляции тучных клеток, а возможно, |
|||||||||||||
заключается прежде всего во влиянии |
и из тромбоцитов [Мовэт Т., 1975]. |
||||||||||||||||
местного очага на центральную нерв- |
Повышенная |
проницаемость |
стенки |
||||||||||||||
ную систему, в изменении ее функ- |
сосудов поддерживается также медиа- |
||||||||||||||||
ционального состояния и в результате |
торами, образующимися из плазмы кро- |
||||||||||||||||
этого |
в |
отраженных |
трофических |
ви [Peacock E., van Winkle W., 1970]. |
|||||||||||||
влияниях как на область травмы, так |
Основную роль в этом отношении в |
||||||||||||||||
и |
на |
другие |
органы |
и |
системы, |
настоящее время придают |
кининам. |
||||||||||
т. е. на общее состояние организма. |
Считают, что кинины вырабатывают- |
||||||||||||||||
Сильное отраженное действие травмы, |
ся кининообразующим энзимом — кал- |
||||||||||||||||
сопровождающееся |
развитием шока, |
ликреином плазмы. Этот энзим дей- |
|||||||||||||||
может сказываться на дальнейшем те- |
ствует на субстрат кининоген [Web- |
||||||||||||||||
чении раневого процесса. |
|
|
ster |
М., |
Pierse |
J., |
1967]. |
В |
увели- |
||||||||

РАНЫ И РАНЕВАЯ ИНФЕКЦИЯ
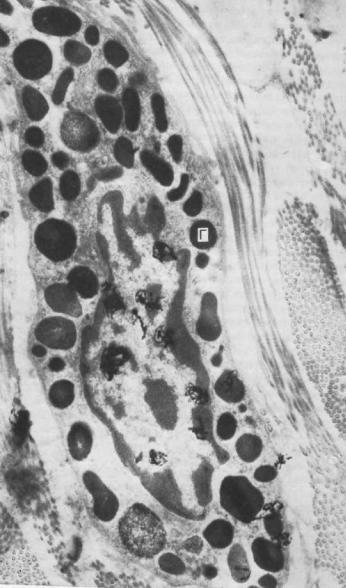
Рис. 2.1. Цитоплазма пейтрофильных лейкоцитов грануляционной ткани, содержащая многочисленные специфические гранулы (Г) (3 сут после нанесения раны). X18 000.

МОРФОЛОГИЯ
РАНЕВОГО
ПРОЦЕССА
Рис. 2.2. Радиоактивный предшественник РНК — уридин — включен макрофагом (большое число зерен серебра над ядром и цитоплазмой этой клетки) и не включен нейтрофильным лейкоцитом (Н), что указывает на прекращение в нем синтеза РНК (3-й сутки раневого процесса). X12 000.

РАНЫ И РАНЕВАЯ ИНФЕКЦИЯ
3
4
Рис. 2.3. Интенсивный синтез РНК (большое число зерен серебра) в ядре неитрофила демаркационного вала раны, содержащего фагосому с тканевым детритом. Х22 000.
Рис. 2.4. Интенсивный синтез РНК (большое число зерен серебра) в ядре неитрофила демаркационного вала раны. Почти вся цитоплаз-
ма |
клетки занята крупными фагосомами с тканевым детритом. |
X18 |
000. |
чении |
сосудистой |
проницаемости |
ются |
«кладовыми» |
бактерицидных |
|||||||||||||
играют роль и другие полипептиды |
белков, |
расходуемых |
на |
подавление |
||||||||||||||
плазмы крови — лейкотоксин, впервые |
фагоцитированных |
бактерий. В этих |
||||||||||||||||
описанный V. Menkin (1950), а также |
гранулах отмечается высокая актив- |
|||||||||||||||||
родственные ему основные и кислые |
ность щелочной фосфатазы. Азуро- |
|||||||||||||||||
пептиды. |
|
Определенное |
значение |
в |
фильные гранулы отличаются высо- |
|||||||||||||
развитии сосудистых нарушений име- |
кой |
активностью |
кислых |
гидролаз; |
||||||||||||||
ют нуклеиновые (РНК) и жирораство- |
в них содержится |
миелопероксидаза, |
||||||||||||||||
римые кислоты. Из последних наибо- |
неферментные катионные белки, лизо- |
|||||||||||||||||
лее |
важны |
простагландины. |
|
|
цим. Эти гранулы некоторые авторы |
|||||||||||||
Повышение |
проницаемости |
стенки |
называют |
первичными |
|
лизосомами |
||||||||||||
сосудов |
сопровождается |
выходом |
в |
[Пигаревский В. Е., 1977]. Фагоцитоз |
||||||||||||||
ткани не только жидкой части крови, |
включает |
в |
себя |
|
внутриклеточный |
|||||||||||||
но и форменных элементов. Уже в |
протеолиз |
(бактериолиз), |
в котором, |
|||||||||||||||
начальных фазах воспаления отмеча- |
очевидно, |
решающую |
роль |
играют |
||||||||||||||
ется активация клеток эндотелия ка- |
азурофильные |
гранулы, |
содержащие |
|||||||||||||||
пилляров: в их цитоплазме появляют- |
кислые |
гидролазы. |
|
|
|
|
|
|||||||||||
ся скопления |
цитогранул, |
образуются |
Принято считать, что нейтрофиль- |
|||||||||||||||
полирибосомы, набухают |
митохонд- |
ные |
лейкоциты представляют |
собой |
||||||||||||||
рии, расширяются полости эндоплаз- |
высокодифференцированные клетки с |
|||||||||||||||||
матического |
ретикулума, |
увеличива- |
низким уровнем биосинтетической ак- |
|||||||||||||||
ется количество пиноцитарных пу- |
тивности и что основная роль их сво- |
|||||||||||||||||
зырьков. |
|
|
|
|
|
|
|
дится к фагоцитозу микробов и вне- |
||||||||||
С помощью электронного микроско- |
клеточному |
|
лизису |
|
окружающих |
|||||||||||||
па прослежены все фазы миграции |
мертвых тканей. Исследования, вы- |
|||||||||||||||||
лейкоцитов [Florey H., Grant L., 1961]. |
полненные |
Д. С. Саркисовым и соавт. |
||||||||||||||||
В раннем периоде воспаления в экссу- |
(1984) с помощью электронно-микро- |
|||||||||||||||||
дате преобладают |
лейкоциты, |
позже |
скопической радиоавтографии, |
суще- |
||||||||||||||
(на 2—3-е сутки) к ним присоединя- |
ственно меняют и расширяют эти |
|||||||||||||||||
ются лимфоциты, макрофаги. |
|
|
представления. Во-первых, установле- |
|||||||||||||||
Нейтрофильные лейкоциты фагоци- |
но неизвестное ранее явление резкого |
|||||||||||||||||
тируют микробов, некротизированные |
усиления синтеза РНК в лейкоцитах |
|||||||||||||||||
массы, |
лизируют |
нежизнеспособные |
раневого экссудата, особенно гнойно- |
|||||||||||||||
ткани, выделяют медиаторы воспале- |
го, что не наблюдается в нейтрофиль- |
|||||||||||||||||
ния. Они имеют округлую форму, ци- |
ных |
лейкоцитах, |
взятых |
из |
крови. |
|||||||||||||
топлазма их обычно содержит боль- |
Во-вторых, нейтрофильные лейкоциты |
|||||||||||||||||
шое количество мелких округлых вклю- |
активно |
фагоцитируют |
|
не |
только |
|||||||||||||
чений различной плотности с мелко- |
микробов, |
но |
и |
некротизированные |
||||||||||||||
зернистым |
содержимым (нейтрофиль- |
ткани, причем именно в таких лей- |
||||||||||||||||
ные гранулы) |
(рис. |
2.1). |
|
|
|
коцитах, содержащих крупные фаго- |
||||||||||||
В околоядерной зоне располагаются |
сомы с тканевым детритом, возобнов- |
|||||||||||||||||
единичные |
митохондрии, |
пластинча- |
ляется |
интенсивный |
синтез |
РНК |
||||||||||||
тый комплекс и очень слабо разви- |
(рис. 2.3, 2.4). |
|
|
|
|
|
|
|||||||||||
тая |
эндоплазматическая |
сеть. При |
Большую роль в очищении раны от |
|||||||||||||||
электронно-авторадиографическом ис- |
некротизированных масс играет и вне- |
|||||||||||||||||
следовании синтез РНК в нейтрофи- |
клеточный |
протеолиз, |
осуществляе- |
|||||||||||||||
лах крови, как правило, не выявляет- |
мый лейкоцитами. Максимум тканево- |
|||||||||||||||||
ся |
(рис. 2.2). |
|
|
|
|
|
го |
протеолиза |
осуществляется |
лишь |
||||||||
D. Banton и соавт. (1971) показали, |
при рН 5,6 [Шимкевич Л. Л., 1977]. |
|||||||||||||||||
что в цитоплазме нейтрофильных лей- |
Очевидно, |
с |
тканевым |
протеолизом |
||||||||||||||
коцитов находятся гранулы двух ти- |
связано |
снижение |
ферментативной |
|||||||||||||||
пов. Специфические гранулы, содер- |
активности в зоне некроза, которое |
|||||||||||||||||
жащие неферментные катионные бел- |
проявляется уже через 1—2 ч после |
|||||||||||||||||
ки и всю систему лактоферина, явля- |
повреждения [Raekallio J., 1970]. В зо- |
|||||||||||||||||

РАНЫ И РАНЕВАЯ ИНФЕКЦИЯ
Рис. 2.5 Распавшийся нейтрофильный лейкоцит. Нейтрофильные гранулы (1 ) в межклеточном пространстве. Х40 000.

МОРФОЛОГИЯ
РАНЕВОГО
ПРОЦЕССА
Рис. 2.6. Макрофаг (М), фагоцитировавший нейтрофильный лейко цит (Н). Х20 000.
не некроза значительно снижается содержание нуклеиновых кислот [Tsanev R., 1964]. Позже наступают деструктивные изменения коллагеновых волокон: старые коллагеновые волокна подвергаются набуханию и частично лизируются, часто наблюдается распад коллагеновых волокон на отдельные фрагменты [Аничков Н. Н. и др., 1951; Давыдовский И. В., 1969].
Из нротеолитической системы ферментов нейтрофилов большую роль играют катепсины, особенно катепсин С [Трусова Н. Ф., Морозова В. Г., 1970; Malik M., 1971]. Из других ферментов, доступных гистохимическому исследованию, в нейтрофилах исследованы щелочная и кислая фосфатазы [Каем Р. И. и др., 1977; Raekallio J., 1970] и лактатдегидрогеназа [Шимкевич Л. Л., 1965], с которой связана интенсивность гликолитических процессов в нейтрофильных лейкоцитах.
Роль гранул нейтрофильных лейкоцитов как медиаторов воспаления подробно изучена G. Weissman (1974). Он установил, что на сосудистую проницаемость влияют катионные белки или полинептиды гранул, медленно реагирующие вещества (МРВ), которые имеют некоторое сходство с простагландинами, и анионовые вещества. Ферменты нейтрофильных гранул — катепсины могут разрушать кининоген плазмы, вызывая выделение кининов.
По мере выполнения своих основных функций (фагоцитоз микробов, некротизированных тканей, протеолиз) нейтрофильные лейкоциты распадаются (рис. 2.5) или фагоцитируются макрофагами (рис. 2.6).
Менее изучена роль эозинофилов в воспалительном процессе. Электронномикроскопические исследования [Сидоркин В. Г., 1969; Рывняк В. В., 1976] свидетельствуют о том, что в цитоплазме эозинофилов содержатся своеобразные гранулы, в центре которых располагается кристаллоидное тело прямоугольной формы (рис. 2.7). В. Г. Сидоркин наблюдал процесс дегрануляции эозинофилов — выход
описанных гранул из клетки в межклеточное пространство. Эндоплазматический ретикулум и пластинчатый комплекс в эозинофилах, как и в нейтрофилах, развиты слабо, однако в отличие от последних в эозинофилах нередко выявляется довольно высокий уровень синтеза РНК (рис. 2.8). Цитоплазматические гранулы эозинофилов содержат кислую фосфатазу, арилсульфатазу, пероксидазу, что указывает на возможную детоксикационную роль этих гранул.
Важную роль на протяжении всего раневого процесса, в том числе в периоде воспаления и очищения раны, играют макрофаги. По современным представлениям, они образуются из моноцитов, т. е. имеют гематогенное происхождение [Чертков И. Л., Фриденштейн А. Я., 1972]. Стимуляция процесса трансформации моноцитарных клеток в макрофаги обусловлена рядом факторов, в том числе интенсивностью ранних фаз воспалительного процесса. Об этом свидетельствует отмеченный G. Weissman (1974) факт стимулирующего действия на процесс моноцитарной трансформации холина и других медиаторов, образующихся при распаде нейтрофильных лейкоцитов. Моноциты, превращающиеся в макрофаги, имеют большое значение не только при непосредственном очищении раны. Они являются одним из важных факторов сложной цепи иммунобиологических реакций организма, обусловливающих течение раневого процесса, и участвуют в переработке антигенного материала и передаче иммунной информации лимфоцитам.
Как показали исследования, проведенные W. Spector и D. Willoughby (1968), трансформация моноцита в макрофаг сопровождается ультраструктурной перестройкой клетки: гиперплазией эндоплазматичеекого ретикулума, митохондрий, появлением хорошо сформированного комплекса, большим количеством лизосом. В макрофагах, находящихся в состоянии активного фагоцитоза, отмечается резкое увеличение числа цитоплазматических выпячиваний (так называе-
мых протуберанцев) и активация лизосомальной системы (рис. 2.9). В цитоплазме клеток увеличивается количество вторичных лизосом и фаголизосом (рис. 2.10), содержащих набор лизосомальных ферментов (гидролаз и протеаз): кислой фосфатазы, кислой РНК-азы, Р-глюкуронидазы, рибонуклеаз, катепсинов и т. д. [Покровский А. А. и др., 1973]. Наиболее четким гистохимическим показателем лизосомальной активности служит кислая фосфатаза, которую можно считать индикатором фагоцитарной активности макрофага. Из других гистохимических особенностей макрофагов следует упомянуть появление крупных капель липидов в цитоплазме в поздние сроки воспаления.
Интрацеллюлярный лизосомальный лизис фагоцитированного материала требует предварительной ферментной обработки его в ранние периоды воспаления и поэтому является как бы второй фазой фагоцитоза. Началом его следует считать воздействие на антиген так называемых killed-систем, к которым относятся лизоцим, неферментные катионные белки и т. д. [Пигаревский В. Е., 1977]. После первичного воздействия на микробные клетки эти системы разрушаются лизосомальными ферментами макрофагов. Таким образом, в процессе очищения раны основная функция макрофагов выражается в фагоцитозе частично разрушенных лейкоцитами некротических тканей, распадающихся нейтрофильных лейкоцитов (нейтрофильного детрита), продуктов бактериального распада и т. д. (рис. 2.11, 2.12).
Помимо упомянутых клеток, в очаге воспаления присутствуют лимфоциты. А. А. Максимов (1927) считал, что эти клетки способны развиваться во все клетки крови и соединительной ткани. В настоящее время известно, что лимфоциты являются источником плазматических клеток. Лимфоциты переносят генетическую иммунную информацию, которая поддерживает или усиливает рост ряда других клеток, в том числе клеток печени и фибробластов [Shilling J., 1968].
Касаясь механизмов лизиса нежизнеспособных тканей и очищения раны, нельзя не упомянуть об участии микробного фактора. Микробиологический и иммунологический аспекты раневого процесса подробно описаны в главах 5 и 6. Здесь мы подчеркнем только, что микробная флора является обязательным участником процесса заживления, особенно в тех случаях, когда он протекает по типу вторичного натяжения. Микроорганизмы, способствуя воспалению и лизису омертвевших тканей, играют важную роль в очищении от них раневого дефекта. Это значение раневой микрофлоры раны (как «биологического очистителя») подчеркивал И. В. Давыдовский.
Однако загрязнение раны микроорганизмами может сказываться отрицательно на течении раневого процесса, что зависит от объема и характера повреждения, вирулентности и количества микробов, заселивших рану и особенностей иммунной системы макроорганизма. В принципе возникновение и прогрессирование раневой инфекции обусловливаются особенностями взаимоотношений между системой гомеостаза, в первую очередь иммунной системой организма, и микрофлорой ран [Смольянников А. В., Саркисов Д. С, 1982].
Воспалительная реакция нарастает стремительно, и уже в течение 1-х суток формируется так называемый лейкоцитарный вал. Принято считать, что он развивается на границе жизнеспособных и омертвевших тканей и, следовательно, отграничивает их друг от друга (демаркационная зона). Однако А. К. Агеев (1960) показал, что воспалительный вал не отделяет жизнеспособные ткани от омертвевших, а всегда тесно связан с зоной расположения микробов. Если, например, последние располагаются в поверхностных слоях зоны некроза, то здесь же концентрируются лейкоциты.
На 3—4-е сутки после ранения начинается II фаза раневого процесса, характеризующаяся развитием грануляционной ткани, постепенно выполняющей раневой дефект. При этом

РАНЫ И РАНЕВАЯ ИНФЕКЦИЯ
Рис. 2.7. Эозинофильный лейкоцит. Кристаллоидные тела в центре специфических гранул (Г). Х40 000.

МОРФОЛОГИЯ
РАНЕВОГО
ПРОЦЕССА
Рис. 2.8. Синтез РНК в эозинофильном лейкоците: зерна серебра над ядром клетки. ХЗО 000.

РАНЫ И РАНЕВАЯ ИНФЕКЦИЯ
Рис. 2.9. Большое количество лизосом (Л) в цитоплазме макрофага, интенсивно синтезирующего РНК (8-е сутки раневого процесса). Х22 000.

МОРФОЛОГИЯ
РАНЕВОГО
ПРОЦЕССА
Рис. 2.10. Цитоплазма макрофага почти целиком заполнена липидными (Л) и миелиноподобными (М) включениями. X15 000.

РАНЫ И РАНЕВАЯ ИНФЕКЦИЯ
Рис. 2.11. В цитоплазме макрофага крупная полость с фрагментами фагоцитированных коллагеновых волокон (К) (3-й сутки раневого процесса). ХЗО 000.

МОРФОЛОГИЯ
РАНЕВОГО
ПРОЦЕССА
Рис. 2.12. Интенсивный синтез РНК в макрофаге (М), фагоцитировавшем лейкоцит (Л) (2-е сутки раневого процесса). X20 000.
резко уменьшается количество лейкоцитов. Макрофаги продолжают играть важную роль, но главное значение в период пролиферации приобретают эндотелий капилляров и фибробласты.
Грануляционная ткань начинает формироваться в виде отдельных очагов в дне раны. Эти очаги характеризуются интенсивным новообразованием капилляров. Эндотелиальные клетки отличаются высоким содержанием ферментов [Raekallio J., 1970] и интенсивностью биосинтетических процессов (рис. 2.13). Вокруг новообразованных капилляров концентрируются тучные клетки, которые секретируя биологически активные вещества, способствуют пролиферации капилляров [Odland G., Ross R., 1968; Shilling J., 1968]. Богатство кровеносными сосудами и клетками делает грануляционную ткань сочной, легко кровоточащей, придает ей розово-красный цвет.
Вторым важнейшим клеточным компонентом грануляционной ткани является фибробласт. Образуя коллагеновые волокна, он обеспечивает заживление, точнее рубцевание раны. Источники происхождения раневых фибробластов окончательно не выяснены. Большинство исследователей считают, что предшественником фибробласта является околососудистый камбий, а именно малодифференцированная клетка соединительной ткани [Аничков Н. Н. и др., 1951; Шимкевич Л. Л., 1965; Grillo H. et al., 1960; Ross R., Odland G., 1968]. Обсуждается вопрос о возможности происхождения раневых фибробластов из гематогенных элементов. М. А. Ланге и Н. Г. Хрущов (1973), Н. Г. Хрущов (1976) и др. в качестве их предшественника называют мононуклеарную кровяную клетку. Однако вопрос о том, является ли гематогенный предшественник фибробласта потомком стволовой клетки или принадлежит к клеточной линии механоцитов, остается неясным, как и вопрос о том, как он попадает в кровь.
В фазе пролиферации количество
фибробластов значительно увеличивается и они становятся преобладающими клетками грануляционной ткани. Возникает вопрос о том, как происходит быстрое накопление такого большого числа фибробластов, возможно ли их митотическое деление? Это остается неясным. Большинство исследователей отмечают незначительное или умеренное количество митозов в фибробластах грануляционной ткани, причем более часты митозы в фибробластах, располагающихся не в самой дерме, а в подлежащих ее слоях. Митозы в фибробластах грануляционной ткани кожной раны кроликов наблюдали Н. Н. Аничков и соавт. (1951) на 4— 5-е сутки заживления, Е. В. Дмитриева (1968) и Н. Д. Яковлева (1969) — на 2—7-е сутки раневого процесса. Нам удалось зарегистрировать митоз в фибробласте при электронно-авто- радиографическом исследовании грануляционной ткани (рис. 2.14). Однако Е. В. Дмитриева отмечает, что быстрый рост числа фибробластов происходит не столько за счет их митотического деления, сколько в результате развития их из мигрирующих от сосудов субэндотелиальных и адвентициальных клеток.
Исследования, выполненные с помощью электронномикроскопической радиоавтографии, свидетельствуют о том, что клетки с интенсивным синтезом ДНК, т. е. подвергающиеся гиперплазии, располагаются преимущественно или исключительно в стенке капилляров или в непосредственной близости от нее, и, вероятнее всего, являются перицитами (рис. 2.15). Это говорит в пользу того, что перициты с достаточным основанием следует рассматривать в качестве клеток— предшественников фибробластов: клетки, возникшие после деления перицитов, выходят за пределы сосудистой стенки и, постепенно дифференцируясь, превращаются в фибробласты грануляционной ткани [Смольянников А. В. и др., 1984].
Фибробласт соединительной ткани представляет собой вытянутую клетку
с узким длинным ядром и слабо развитыми цитоплазматическими структурами. Интенсивность биосинтетических процессов в таких фибробластах невысока (рис. 2.16), вследствие чего их нередко называют фиброцитами. Речь при этом идет не об отсутствии коллагеногенеза, а о низком его уровне.
Однако следует отметить, что и в нормальной соединительной ткани часто встречаются фибробласты с хорошо развитыми цитоплазматическими и ядерными ультраструктурами и с относительно высоким уровнем биосинтеза (рис. 2.17). Но даже эти фибробласты существенно отличаются от тех, которые видны в грануляционной ткани. Последние характеризуются крупным ядром округло-овальной формы с 1—2 ядрышками и большим количеством органелл с особенно сильно развитой гранулярной эндоплазматической сетью (рис. 2.18).
В литературе сложилось мнение, что фибробласты с расширенными канальцами гранулярной эндоплазматической сети являются клетками, интенсивно синтезирующими белок [Болховитинова Л. А., Павлова М. Н., 1977; Хомулло Г. В., Иваненко Т. В., 1977; Яковлева Г. И., 1978; Ross R., Benditt E., 1961, и др.]. Действительно, фибробласты с подобной структурой всегда можно наблюдать при элект- ронно-микроскопическом исследовании ран, келоидных рубцов и других состояний, связанных с усиленным коллагенообразованием. При элект- ронно-радиоавтографическом исследовании заживления ран мы определяли уровень синтеза белка в цитоплазме каждого исследованного фибробласта по интенсивности включения предшественника коллагеновых белков пролина -3,4,5-3Н [Колокольчикова Е. Г. и др., 1980]. По данным количественного анализа, скорость синтеза белка в фибробластах с узкими канальцами гранулярной эндоплазматической сети была выше (рис. 2.19), чем в фибробластах с расширенными канальцами (рис. 2.20). Однако более низкий уровень синтеза белка в фибробластах
с расширенными канальцами не означает, что эти клетки содержат меньшее количество белка. Вполне вероятно, что электронно-плотное содержимое широких канальцев гранулярной эндоплазматической сети представляет собой ранее синтезированный белок, и, такие клетки по содержанию
его |
могут |
превосходить |
фибробласты |
с |
узкими |
канальцами |
гранулярной |
эндоплазматической сети.
Полагают, что фибробласт приобретает способность к интенсивному синтезу коллагена не сразу, а только после определенной внутренней струк- турно-функциональной перестройки. Она заключается в гипертрофии ядра и ядрышка, гиперплазии гранулярной эндоплазматической сети, в рибосомах которой в дальнейшем будут синтезироваться белки, в расширении зоны пластинчатого комплекса,
постепенном повышении |
содержания |
ферментов — щелочной |
фосфатазы, |
р-глюкуронидазы, неспецифической эстеразы и др. [Фукс Б. Б., 1966; Raekallio J., 1970]. Это период наращивания и развертывания материальной базы для последующего интенсивного коллагеногенеза. Фибробласты в подготовительном периоде называются молодыми, незрелыми [Ross R., 1968]. В их цитоплазме нередко можно обнаружить крупные капли липидов, которые в дифференцированных фибро-
бластах |
встречаются |
значительно |
реже (рис. |
2.21). |
|
Н аши электронноавторадиографические исследования свидетельствуют о том, что особенно интенсивный синтез РНК в фибробластах регистрируется в раннем периоде формирования грануляционной ткани, когда коллагеногенез выражен еще слабо (рис. 2.22). В дальнейшем же, когда начинается образование коллагеновых волокон, синтез РНК в фибробластах протекает на среднем уровне. Это можно объяснить тем, что интенсивный синтез РНК в первом периоде обеспечивает гиперплазию эндоплазматической сети, рибосом и других органелл, т. е. идет на формирование структур, которые ответственны за коллагеноге-

РАНЫ И РАНЕВАЯ ИНФЕКЦИЯ
Рис. 2.13. Синтез РНК в клетках эндотелия (Э) (12-день раневого процесса). ХЗО 000.

МОРФОЛОГИЯ
РАНЕВОГО
ПРОЦЕССА
Рис. 2.14. Митоз фибробласта (8-е сутки после нанесения раны). X 28 000.

РАНЫ И РАНЕВАЯ ИНФЕКЦИЯ
Рис. 2.15. Интенсивный синтез ДНК (большое число зерен серебра) в периците капилляра грануляционной ткани человека. ХЮ000.
нез. После того как эти структуры образовались и продукция коллагена началась, уровень синтеза РНК в фибробластах снижается. Соответственно возрастает синтез белков, являющихся основой для построения коллагеновых волокон (рис. 2.23).
Синтез коллагена начинается в рибосомах из аминокислот, поступивших в клетку. Этот процесс контролируется транспортной РНК (тРНК) и информационной РНК (иРНК), передающей в рибосомы информацию, закодированную в ДНК ядра клетки. В рибосомах эндоплазматического ретикулума начинается сборка полипептидных цепочек, которая завершается в его цистернах; здесь же происходит окисление пролина в оксипролин [Lazarides E., LuKens L., 1971].
Процесс синтеза белка был прослежен R. Ross и Е. Benditt (1965), которые установили, что пролин-3Н, введенный внутрибрюшинно морским свинкам, инкорпорируется эндоплаз-
матическим ретикулумом фибробластов уже спустя 15 мин. Через 30 мин изотоп появляется в пластинчатом комплексе, через 1 ч — в периферической цитоплазме фибробласта. В экстр ацеллюлярном пространстве метка определяется спустя 24 ч после введения изотопа. Образованная макромолекула (тропоколлаген) секретируется в межклеточное пространство, вероятнее всего, отпочковывающимися от цистерн эндоплазматического ретикулума мелкими пузырьками. Наличие в них фибриллярного материала доказано R. Tselstad (1971). Пузырьки «склеиваются» с наружной мембраной клетки, и их содержимое выбрасывается в межклеточное пространство.
Возможен и другой путь секреции коллагена, обусловленный наличием между цистернами эндоплазматической сети и межклеточным пространством сообщающихся ходов, по которым синтезированный коллаген выво-

МОРФОЛОГИЯ
РАНЕВОГО
ПРОЦЕССА
Рис. 2.16. Фибробласт (фиброцит) неповрежденной кожи, характеризующийся малым объемом цитоплазмы и сравнительно невысоким уровнем синтеза РНК, главным образом в ядрышке (Я). Х21 000.

РАНЫ И РАНЕВАЯ ИНФЕКЦИЯ
Рис. 2.17. Фибробласт кожи со значительным объемом цитоплазмы ^выраженным синтезом РНК за пределами ядрышка в „у^онл^зм"

МОРФОЛОГИЯ
РАНЕВОГО
ПРОЦЕССА
Рис 2 18 Фибробласт грануляционной ткани на 4-е сутки после нанесения раны. Большое ядро с ядрышком (Я), хорошо развитая гранулярная эндоплазматическая сеть (ГЭС). Х20 000.

РАНЫ И РАНЕВАЯ ИНФЕКЦИЯ
19
20
Рис. 2.19. Фибробласт грануляционной ткани мыши на 3-й сутки заживления раны. Интенсивный синтез белка (черные зерна серебра) в развитой эндоплазматической сети с узкими канальцами. Х20 000.
Рис. 2.20. Фибробласт грануляционной ткани мыши на 3-й сутки заживления раны. Низкий уровень синтеза белка (единичные зерна серебра) в цитоплазме с расширенными канальцами эндоплазматической сети, заполненной гомогенным содержимым. Х15 000.

МОРФОЛОГИЯ
РАНЕВОГО
ПРОЦЕССА
Рис. 2.21. Липидные включения (Л) в цитоплазме фибробласта (3-й сутки раневого процесса). X15 000.

РАНЫ И РАНЕВАЯ ИНФЕКЦИЯ
Рис. 2.22. Интенсивный синтез РНК в фибробласте на 3-й день раневого процесса. Х12 000.

МОРФОЛОГИЯ
РАНЕВОГО
ПРОЦЕССА
Рис. 2.23. Включения в фибробласт радиоактивного предшественника коллагена пролина (8-е сутки раневого процесса). Х28 000.
дится из клетки [Ross R., 1970; Bornstein P., Ehrlich H., 1973].
Молекулы коллагена, синтезированные фибробластами в основном веществе путем линейной агрегации, при которой молекулы соседних агрегатов оказываются сдвинутыми в отношении друг друга на определенную длину, образуют первичные фибриллы с периодичностью в 64—70 нм [Ross R.,
Benditt |
E., |
1961; Bornstein |
P., Ehr- |
lich H., |
1973]. |
|
|
Функция |
фибробластов в |
раневом |
|
процессе не ограничивается продукцией коллагена, но заключается и в синтезе мукополисахаридов (гликозаминогликанов) — важного компонента межуточного вещества соединительной ткани. Впервые гистохимически кислые мукополисахариды в грануляционной ткани выявили J. Dunphy и К. Udupa (1956). Они утверждали, что кислые мукополисахариды секретируются фибробластами, что было подтверждено рядом исследователей[Касавина Б. С, Музыкант Л. И., 1958; van Winkle W., 1967]. В настоящее время установлено, что основное вещество грануляционной ткани содержит следующие гликозаминогликаны: гиалуроновую кислоту, хондроитинсерные кислоты, глюкоз амин, галактозамин, гепарин. Эти мукополисахариды синтезируются фибробластами и тучными клетками. Согласно современной точке зрения, на ранних этапах заживления раны в ней накапливаются несульфатированные мукополисахариды типа гиалуроновой кислоты. При созревании грануляционной ткани повышается содержание сульфатированных мукополисахаридов, главным образом хондроитинсульфатов А и С. Мукополисахариды и коллаген могут синтезироваться одновременно, например в культуре тканей куриных эмбрионов [Conrad G., 1970].
Полисахариды, окружающие молекулы коллагена во внеклеточном пространстве, регулируют образование фибрилл [Wood P., 1962, и др.]. Ограничивая быструю диффузию молекул коллагена во внеклеточном пространстве, полисахариды создают высокую
концентрацию их в определенных участках, а также оказывают влияние на рост и формирование коллагеновых волокон. Окончательное формирование коллагеновых нитей толщиной в несколько десятков нанометров происходит в присутствии АТФ с помощью водородных связей при участии глюкокортикоидов и гликозаминогликанов, роль которых заключается в стабилизации и цементировании волокнистых структур [Мазуров В. И., 1974; Хилькин А. М. и др., 1976].
Вгрануляционной ткани на высоте
ееразвития обнаруживается большое количество аргирофильных волокон, которые концентрируются около коллагеновых. В поверхностном слое грануляций аргирофильные волокна образуют густую сеть, возникающую уже в самые ранние сроки после травмы и сохраняющуюся в поверхностных слоях рубцовой ткани. Очевидно, что в грануляционной ткани большая часть аргирофильных волокон представляет собой преколлагеновые, которые исчезают по мере развития фиброзной ткани. Однако некоторые аргирофильные волокна представляют собой собственно ретикулиновые и сохраняются и в рубцовой ткани, особенно в поверхностных ее слоях.
Примерно, так же, как синтез коллагена, происходит образование эластических волокон. Существует мнение, что эластин синтезируют клетки, носящие название эластобластов [Gakson L., 1968]. Отличить их от фибробластов по морфологическим признакам почти невозможно. По другим данным, допускается участие в этом процессе клеток гладкой мускулатуры [Kador A. et al., 1971]. Первичные фибриллы эластина образуются макромолекулами тропоэластина с массой
от 68 000 до 74 000 [Partridge S., 1973], располагающимися в основном веществе без определенной ориентации. В эластических фибриллах нет поперечной исчерченности.
На ранних этапах формирования эластические волокна состоят из параллельно расположенных скоплений
фибрилл диаметром 10 нм, которые |
тучных |
клеток |
выявляется |
высокая |
||||||||||||||
часто обнаруживаются в непосредст- |
активность |
|
|
АТФ-азы — фермента |
||||||||||||||
венной близости от клеток, имеющих |
энергетического синтеза. В их цито- |
|||||||||||||||||
вид типичных фибробластов с расши- |
плазме |
гистохимически |
идентифици- |
|||||||||||||||
ренными цистернами эндоплазматиче- |
рованы |
цитохромоксидазы, |
кислая и |
|||||||||||||||
ской сети и хорошо развитым пла- |
щелочная фосфатазы, протеазы, эс- |
|||||||||||||||||
стинчатым комплексом. В цитоплазме |
теразы, |
лейцинаминопептидазы |
[Wit- |
|||||||||||||||
их обнаруживается большое количе- |
ting Н., 1969]. Наши электронно- |
|||||||||||||||||
ство |
тонких |
фибрилл. |
Полностью |
авторадиографические |
исследования |
|||||||||||||
сформированные |
эластичные |
волок- |
показали, что тучные клетки харак- |
|||||||||||||||
на в отличие от коллагеновых, беспо- |
теризуются высоким уровнем синтети- |
|||||||||||||||||
рядочно располагаясь, широко анасто- |
ческих процессов (рис. 2.25). Не иск- |
|||||||||||||||||
мозируют друг с другом и образуют |
лючено, однако, что после дегрануля- |
|||||||||||||||||
широкопетлистую |
сеть |
или |
решетку |
ции |
часть |
тучных |
клеток |
погибает. |
||||||||||
[Ross R., 1975], что и определяет их |
В |
процессе заживления содержание |
||||||||||||||||
эластические свойства. |
|
|
|
|
тучных клеток в раневой области из- |
|||||||||||||
Говоря о развитии грануляционной |
меняется: в первые 24 ч после ране- |
|||||||||||||||||
ткани, |
|
мы |
остановились |
главным |
ния число их снижается, к 3—5-м сут- |
|||||||||||||
образом |
на |
эндотелиальных |
клетках |
кам увеличивается и достигает макси- |
||||||||||||||
и фибробластах. Однако новообразо- |
мума к 8-м суткам, т. е. к моменту |
|||||||||||||||||
вание сосудов и волокнистых струк- |
развития грануляционной ткани [Wit- |
|||||||||||||||||
тур обеспечивается не только этими, |
ting Н., 1969]. По нашим данным, наи- |
|||||||||||||||||
но и другими клеточными элементами. |
большее количество тучных клеток об- |
|||||||||||||||||
Важную роль в развитии и созре- |
наруживается на 5—7-е сутки ране- |
|||||||||||||||||
вании |
грануляционной |
ткани |
играют |
вого процесса. S. Ooka-Souda (1974) |
||||||||||||||
тучные клетки. Считают, что в их |
и Т. Мовэт (1975) считают, что туч- |
|||||||||||||||||
цитоплазме синтезируется ряд биоло- |
ные клетки играют основную роль в |
|||||||||||||||||
гически активных веществ — гепарин, |
фазе острого воспаления, когда их |
|||||||||||||||||
серотонин, гистамин. Они накапли- |
дегрануляция |
сопровождается |
выде- |
|||||||||||||||
ваются в метахроматических грану- |
лением медиаторов воспаления. Кон- |
|||||||||||||||||
лах тучных клеток (рис. 2.24) и выде- |
цепция |
о |
выбрасывании |
тучными |
||||||||||||||
ляются в окружающую среду при их |
клетками гистамина на ранних этапах |
|||||||||||||||||
дегрануляции. По-видимому, тучным |
воспаления согласуется с современной |
|||||||||||||||||
клеткам свойствен мерокриновый тип |
точкой |
зрения |
о |
функциональной |
||||||||||||||
секреции, так как секреция их не |
двойственности тучной клетки, т. е. о |
|||||||||||||||||
ведет к гибели клеток, а напротив, |
способности ее секретировать раз- |
|||||||||||||||||
стимулирует перестройку ядра и цито- |
личные биологически активные веще- |
|||||||||||||||||
плазмы опустошенных клеток. Элект- |
ства, главным образом гистамин и ге- |
|||||||||||||||||
ронно-микроскопические |
исследова- |
парин, на разных этапах заживления |
||||||||||||||||
ния, проведенные W. Spector и D. Wil- |
раны. По фармакологическому дейст- |
|||||||||||||||||
loughby |
(1968), |
свидетельствуют |
о |
вию |
гепарин |
является |
антагонистом |
|||||||||||
том, что процесс дегрануляции начи- |
гистамина. На его действии основаны |
|||||||||||||||||
нается с появления вокруг гранул |
инактивация |
ферментов, антитокси- |
||||||||||||||||
мелких |
просветлений — вакуолей, |
ко- |
ческое действие, стимуляция фибрил- |
|||||||||||||||
торые продвигают гранулы к оболочке |
логенеза. |
|
|
|
|
|
|
|
||||||||||
клеток. Оболочка разрывается, и гра- |
Происхождение |
тучных |
|
клеток |
||||||||||||||
нула выталкивается за пределы клет- |
окончательно не выяснено. Полагают, |
|||||||||||||||||
ки. После дегрануляции в тучных |
что они могут образовываться в ре- |
|||||||||||||||||
клетках |
гиперплазируется |
пластин- |
зультате |
дифференцировки |
ретику- |
|||||||||||||
чатый аппарат, шероховатый эндо- |
лярных [Gsaba G. et al., 1967], адвен- |
|||||||||||||||||
плазматический |
ретикулум |
|
[Гу- |
тициальных клеток [Меньшова А. П., |
||||||||||||||
щин И. С, 1974; Padawer J., 1970], |
1955], фибробластов, малых и боль- |
|||||||||||||||||
что свидетельствует о начале очеред- |
ших лимфоцитов. В раневой поверх- |
|||||||||||||||||
ного секреторного цикла. В гранулах |
ности предшественником |
тучных кле- |
||||||||||||||||
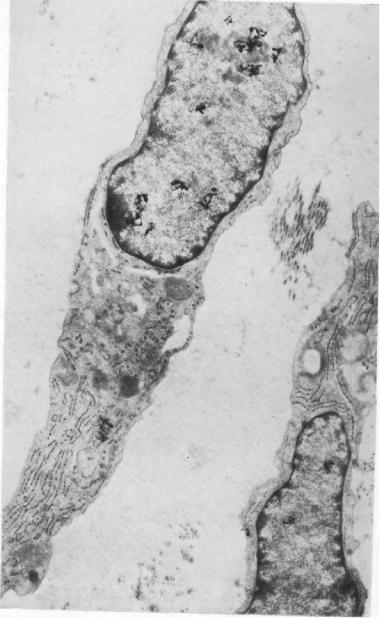
РАНЫ И РАНЕВАЯ ИНФЕКЦИЯ
Рис. 2.24. Тучная клетка с большим числом гранул (Г). Х25 000.

МОРФОЛОГИЯ
РАНЕВОГО
ПРОЦЕССА
Рис. 2.25. Выраженный синтез РНК в тучной клетке. Х28 000.
ток |
является |
макрофаг |
[Виногра- |
здоровых тканей, тщательного поиска |
||||||||||
дов В. В., Воробьева Н. Ф., 1973; |
малейших гнойных затеков и их лик- |
|||||||||||||
Witting Н„ 1969]. |
|
|
|
видации |
как важнейшего |
элемента |
||||||||
В период наиболее полного развития |
в комплексе мероприятий по хирурги- |
|||||||||||||
грануляционной ткани (6—7-е сутки |
ческой обработке раны [Кузин М. И. |
|||||||||||||
после травмы) в ней в большом коли- |
и др., 1979]. |
|
|
|
|
|||||||||
честве |
появляются |
плазматические |
По мере |
нарастания |
|
количества |
||||||||
клетки. |
Они |
концентрируются, |
как |
коллагеновых волокон грануляционная |
||||||||||
правило, около сосудов. Плазматиче- |
ткань становится все более плотной: |
|||||||||||||
ские клетки возникают из лимфоци- |
наступает последний период раневого |
|||||||||||||
тов; последние при этом увеличивают- |
процесса — фаза |
рубцевания |
(12— |
|||||||||||
ся, цитоплазма их окрашивается базо- |
30-е сутки). Она характеризуется про- |
|||||||||||||
фильно, ядро располагается эксцент- |
грессирующим |
уменьшением |
числа |
|||||||||||
рично. |
Цитоплазма |
плазматических |
сосудов |
и |
клеточных |
элементов — |
||||||||
клеток |
содержит большое количество |
макрофагов, тучных клеток, фибро- |
||||||||||||
РНК. Плазматические клетки являют- |
бластов. В |
цитоплазме фибробластов |
||||||||||||
ся носителями аутоиммунной инфор- |
снижаются содержание РНК, актив- |
|||||||||||||
мации. В их цитоплазме присутствуют |
ность кислой и щелочной фосфатазы, |
|||||||||||||
игольчатые белковые кристаллы, ко- |
(3-глюкуронидазы [Афанасьев Ю. И., |
|||||||||||||
торые, |
очевидно, являются |
матрицей |
1971; Vizioli M. et al., 1972], умень- |
|||||||||||
для образования антител. |
|
|
шаются объем эндоплазматической се- |
|||||||||||
В грануляционной ткани присутст- |
ти и пластинчатого комплекса, коли- |
|||||||||||||
вуют гигантские многоядерные клетки. |
чество рибосом [Shilling J., 1968]. |
|||||||||||||
Механизмы их образования и роль в |
Фибробласты приобретают вытянутую |
|||||||||||||
раневом процессе недостаточно ясны. |
форму. В отдельных случаях их цито- |
|||||||||||||
Последняя скорее всего не ограничи- |
плазма имеет вид узкого извилистого |
|||||||||||||
вается фагоцитарной функцией. Ги- |
цитоплазматического отростка, в ко- |
|||||||||||||
стохимические, электронно-микроско- |
тором |
биосинтетические |
процессы |
|||||||||||
пические и авторадиографические ис- |
протекают на низком уровне (рис. 2.28). |
|||||||||||||
следования |
свидетельствуют о |
том, |
По нашим и литературным данным |
|||||||||||
что |
многоядерные |
клетки |
являются |
[М. Vizioli et al., 1976], активность |
||||||||||
высокоэнергетически |
заряженными, |
щелочной фосфатазы в |
фиброцитах |
|||||||||||
отличаются |
интенсивными |
синтети- |
рубцовой ткани на 14—20-е сутки пос- |
|||||||||||
ческими процессами (рис. 2.26) и, |
ле травмы остается высокой, особенно |
|||||||||||||
несомненно, |
|
принимают |
активное |
в участках рубца, расположенных не- |
||||||||||
участие в общем ходе раневого про- |
посредственно под эпидермисом и со- |
|||||||||||||
цесса. |
|
|
|
|
|
|
держащих много клеточных элементов |
|||||||
Электронно-микроскопический ана- |
и тонкие пучки коллагеновых волокон. |
|||||||||||||
лиз микробиологического профиля ра- |
В келоидных рубцах после ожогов |
|||||||||||||
ны, т. е. содержания микробов в раз- |
кожи нормальный переход |
некоторых |
||||||||||||
личных ее слоях, показал, что особен- |
фибробластов в фиброциты задержи- |
|||||||||||||
но большое количество микробов, как |
вается. Такие фибробласты отличают- |
|||||||||||||
жизнеспособных, так и фагоцитиро- |
ся высоким содержанием РНК, глико- |
|||||||||||||
ванных лейкоцитами и макрофагами, |
гена, повышенной ферментативной ак- |
|||||||||||||
располагается в некротических массах |
тивностью цитоплазматических |
струк- |
||||||||||||
и в струпе. В находящемся под ними |
тур, длительно продуцирующих избы- |
|||||||||||||
демаркационном лейкоцитарном |
вале |
точное количество коллагена [Журав- |
||||||||||||
их значительно меньше, а в грануля- |
лева М. В., 1966; Болховитинова Л. А., |
|||||||||||||
ционной ткани они отсутствуют или |
Павлова М. Н., 1977]. Такой извра- |
|||||||||||||
единичны (рис. 2.27) [Д. С. Саркисов |
щенный |
фибриллогенез |
приводит к |
|||||||||||
и др., 1984]. Такой характер распре- |
формированию |
химически |
неполно- |
|||||||||||
деления микробов |
в поврежденных |
ценного коллагена, легко подвергаю- |
||||||||||||
тканях вполне оправдывает необходи- |
щегося дегенерации. |
|
|
|
||||||||||
мость ранней |
некрэтомии в |
пределах |
Хотя |
по |
мере |
созревания грануля- |
||||||||
ций количество макрофагов уменьшается, они и в формирующейся рубцовой ткани сохраняют признаки высокой синтетической активности (рис. 2.29). Какие функции выполняют эти клетки в данном периоде раневого процесса — не вполне ясно. По данным электронно-микроскопических исследований, одной из них, вероятно, является фагоцитоз коллагеновых волокон (рис. 2.30). В молодом сформированном рубце клеточные элементы (фибробласты, макрофаги) располагаются среди толстых пучков коллагеновых волокон. Однако при этом многие из них сохраняют морфологические признаки достаточно высокой функциональной активности: крупное ядро, хорошо развитые эндоплазматическую сеть и пластинчатый аппарат, множество лизосом (рис. 2.31). Все это говорит о том, что рубец представляет собой структуру с достаточно высокой напряженностью биосинтетических процессов.
Согласно современным представлениям, параллельно с формированием коллагеновых волокон происходит частичное их разрушение, в результате чего обеспечивается более тонкая регуляция процесса новообразования фиброзной ткани. Н. И. Краузе (1946) отмечал, что при заживлении раны происходит не только накопление, но и рассасывание рубцовой ткани. По его мнению, рассасывание препятствует накоплению и уплотнению волокнистой основы раны и тем самым поддерживает крово- и лимфообращение в грануляциях на постоянно высоком уровне. Н. И. Краузе считал, что при лечении ран необходимо стимулировать процессы рассасывания рубцовой ткани в период ее формирования. Это может способствовать образованию мягких подвижных рубцов.
Данные Н. И. Краузе нашли подтверждение в современных исследованиях. Так, в грануляционной ткани обнаружена коллагеназа — фермент, расщепляющий коллаген. Установлено, что коллагеназу продуцируют разные клетки грануляционной ткани, в том числе и фибробласты [Штраух Л.,
1971]. На основании этого высказано мнение о том, что фибробласты, повидимому, выступают в роли клеток, как продуцирующих коллаген, так одновременно и разрушающих его, т. е. являются не только фибробластами, но и фиброкластами [Саркисов Д. С, 1972; Шехтер А. Б., Милованова 3. П., 1975]. По мнению A. TenCate и D. Deporter (1975), способность фибробластов к разрушению продуктов собственной секреции является клеточной основой непрерывной перестройки соединительной ткани. Эта точка зрения подтверждается обнаружением в цитоплазме фибробластов грануляционной ткани небольших пучков вполне сформированных коллагеновых волокон, что и расценивается как фагоцитоз их этими клетками.
Фагоцитоз коллагеновых волокон на разных стадиях заживления раны, в том числе в периоде формирования рубца, осуществляют также макрофаги. Поглощение коллагеновых волокон макрофагами при процессах инволюции матки крыс наблюдал Е. Раrakkal (1972). Этот феномен следует расценивать как одно из проявлений процесса перестройки вновь образованного рубца, подобно аналогичному процессу в костной ткани при заживлении перелома.
При обширном повреждении в раневой процесс вовлекается и мышечная ткань. Гибель части мышечных волокон сопровождается регенераторной реакцией сохранившихся, которая выражается в активации так называемых клеток-сателлитов (камбиальные элементы скелетной мышцы), формировании мышечных почек, богатых саркоплазмой и ядрами, и в результате этого новообразования мышечной ткани. Электронно-микроскопическая авторадиография позволяет в деталях проследить взаимоотношение дистрофических и восстановительных процессов внутри отдельных мышечных волокон (рис. 2.32). Даже те из них, которые при заживлении раны оказываются замурованными среди фиброзной ткани, сохраняют высокую напряженность биосинтетических про-

РАНЫ И РАНЕВАЯ ИНФЕКЦИЯ
Рис. 2.26 Синтез РНК в ядрах многоядерной клетки на 15 сутки после нанесения раны Х25000

МОРФОЛОГИЯ
РАНЕВОГО
ПРОЦЕССА
Рис. 2.27. В бактерии,фагоцитированной неитрофилом демаркационного вала раны, продолжается синтез РНК (черные зерна серебра над бактерией). Х22 000.
РАНЫ И РАНЕВАЯ ИНФЕКЦИЯ
ГоИмРНК8 |
' |
^ Т |
В е Р е т е н о о б Р а з « Ь 1 е фибробласты |
с умеренным синте- |
зом ИНН |
|
на 12-е сутки раневого процесса. X17 |
000. |
|

МОРФОЛОГИЯ
РАНЕВОГО
ПРОЦЕССА
Рис. 2.29. Интенсивный синтез РНК и перемещение ее из ядра в цитоплазму в макрофаге (25-е сутки раневого процесса). Х22 000.

РАНЫ И РАНЕВАЯ ИНФЕКЦИЯ
I
Рис 2.30 Макрофаг с большой полостью содержащий коллагеновые волокна (к) на 10-е сутки после нанесения раны Х250000

МОРФОЛОГИЯ
РАНЕВОГО
ПРОЦЕССА
Рис. 2.31. Фибробласт в свежем рубце (15-е сутки заживления раны) среди массивных пучков коллагеновых волокон (К). Крупное ядро с ядрышком, многочисленные каналы ГЭС. XI5 000.

РАНЫ И РАНЕВАЯ ИНФЕКЦИЯ
Рис. 2.32. Включение пролина в мышечное волокно (регенерация миофибрилл) на границе с участками распада саркоплазматических структур (8-е сутки раневого процесса). X28 000.

МОРФОЛОГИЯ
РАНЕВОГО
ПРОЦЕССА
Рис. 2.33. Выраженный синтез РНК в мышечном волокне, расположенном на границе с фиброзной тканью (15-е сутки заживления раны). X 24 000.
цессов (рис. 2.33). Подробные сведения о функциональной морфологии соединительной ткани в норме и патологии можно найти в монографии В. В. Серова и А. Б. Шехтера «Соединительная ткань» (1981).
Параллельно с созреванием грануляционной ткани происходит эпителизация раны. Этот процесс подробно изучен В. Г. Гаршиным (1951). Он начинается уже в первые часы после повреждения. В течение 1-х суток образуется 2—4 слоя клеток базального эпителия. Высокая скорость эпителизации ран обеспечивается тремя процессами: миграцией, делением и дифференцировкой клеток [van Winkle W., 1971, и др.]. Эпителизация небольших но величине ран осуществляется в основном за счет миграции клеток, которая начинается из базального слоя.
R. Ross и G. Odland (1968) отмечали увеличение диаметра мигрирующих клеток и образование значительного количества псевдоподиальных выростов, расположенных параллельно раневой поверхности и содержащих розетки свободных рибосом. С помощью рибосом и псевдоподий мигрирующие клетки прикрепляются к массам фибрина или подлежащим мезенхимальным клеткам. При этом форма клеток становится округлой. По данным авторов, эпителиальные клетки содержат вакуоли, наполненные материалом, по электронной плотности напоминающим белок плазмы крови. Считают, что клетки регенерирующего эпителия могут фагоцитировать обрывки тканей, фибрин и раневой экссудат. Они продуцируют коллагенолитические ферменты и таким образом участвуют в регуляторных процессах и межтканевых корреляциях .
Раны размером более 0,1 см эпителизируются за счет не только миграции, но и митотического деления клеток эпителия. Митозы, как правило, отмечаются в клетках, удаленных от раневой поверхности. Методом авторадиографии показано, что источником регенерации эпителия являются
клетки базального слоя, активно синтезирующие ДНК [Krawczyk W., 1971].
Дифференцировка регенерирующего эпидермиса начинается уже в период миграции и выражается в образовании цистерн шероховатого эндоплазматического ретикулума, агрегации рибосом, увеличении количества митохондрий и тонофибрилл. Этот процесс сопровождается повышением биосинтетической активности, о чем свидетельствует увеличение концентрации РНК, ДНК и гликогена [Адильгиреева Л. X., 1968, и др.]. С регенерацией эпителия связывают уменьшение активности кислой фосфатазы и сукцинатдегидрогеназы и увеличение активности глюкуронидазы [Michael J. et al., 1976]. При этом клетки из округлых становятся призматическими, ядро и цитоплазма уменьшаются.
Новый эпителий образует границу между поврежденными и подлежащими слоями, препятствует обезвоживанию тканей раны, потере электролитов и белков, предупреждает инвазию микроорганизмов.
Степень эпителизации тесно связана с гранулированием и обусловлена состоянием тканей раны, обменом веществ, трофикой, степенью и характером бактериального загрязнения. Эпителизация заканчивается на 7— 10-е сутки, а спустя 10—15 сут после ранения уменьшается толщина образованного эпителия. Однако может происходить и задержка эпителизации, что всегда связано с осложнениями течения раневого процесса, чаще всего с болезнью грануляций (см. главу 7).
По данным В. Г. Гаршина (1951), важнейшим условием нормального хода заживления раны является строгая синхронизация процесса эпителизации, с одной стороны, и созревания грануляционной ткани — с другой.
Равновесие между созреванием и рассасыванием грануляций и рубцовой ткани лежит и в основе феномена раневой контракции — равномерного концентрического сокращения краев и стенок раны [Краузе Н. И., 1946]. Во
II и III фазах заживления раневая |
масс. Регенерирующий эпидермис по- |
|||||||||||||||
контракция, как правило, сочетается с |
степенно продвигается под струпом с |
|||||||||||||||
интенсивной эпителизацией, что сви- |
краев раны, ложась на молодую сое- |
|||||||||||||||
детельствует |
о |
нормальном |
течении |
динительную |
ткань, |
восполняющую |
||||||||||
раневого процесса. |
|
|
|
|
образовавшийся дефект. |
После |
того |
|||||||||
Такова типовая морфология ране- |
как последний покроется тонким сло- |
|||||||||||||||
вого процесса, ее принципиальная схе- |
ем молодого эпителия, струп отпадает. |
|||||||||||||||
ма. В каждом конкретном случае мо- |
Особенности |
описанных |
вариантов |
|||||||||||||
гут наблюдаться отклонения от этой |
заживления |
относятся |
к к о л и ч е с т - |
|||||||||||||
схемы, обусловленные характером ра- |
венным, |
а |
не |
к а ч е с т в е н н ы м |
||||||||||||
нения, состоянием иммунной защиты |
различиям: во всех случаях в процес- |
|||||||||||||||
организма, методами лечения и т. д. |
се участвуют одни и те же клеточные |
|||||||||||||||
Несмотря на разнообразие, они могут |
элементы, |
обеспечивающие |
принци- |
|||||||||||||
быть сведены к двум основным ва- |
пиально сходную общую динамику ра- |
|||||||||||||||
риантам. Первый состоит в следую- |
невого процесса (воспаление, проли- |
|||||||||||||||
щем: при небольшом объеме пораже- |
ферация соединительной ткани, руб- |
|||||||||||||||
ния, в частности при линейном раз- |
цевание и эпителизация). |
|
|
|
||||||||||||
резе ткани, края раны как бы сли- |
Подводя итог сказанному, отметим, |
|||||||||||||||
паются, тонкая фибринная пленка, об- |
что в общей динамике раневого про- |
|||||||||||||||
разующаяся между ними, быстро про- |
цесса четко прослеживаются .три ос- |
|||||||||||||||
растает фибробластами и подверга- |
новных периода: 1) расплавление нек- |
|||||||||||||||
ется организации с образованием уз- |
ротических масс и очищение от них |
|||||||||||||||
кого, |
часто |
едва |
заметного |
рубца. |
раневого |
дефекта |
через |
воспаление; |
||||||||
В таких случаях говорят, что рана |
2) пролиферация |
соединительноткан- |
||||||||||||||
зажила первичным натяжением. При |
ных элементов с формированием гра- |
|||||||||||||||
этом |
варианте |
течения |
обязательно |
нуляционной |
ткани, |
восполняющей |
||||||||||
присутствуют все основные компонен- |
рану; 3) фиброзирование грануля- |
|||||||||||||||
ты раневого процесса (сосудистая реак- |
ционной ткани с образованием рубца |
|||||||||||||||
ция, воспаление, пролиферация сосудов |
и его эпителизацией. В свете совре- |
|||||||||||||||
и соединительнотканных клеток, фор- |
менных данных о роли различных кле- |
|||||||||||||||
мирование последними |
коллагеновых |
точных элементов в течении раневого |
||||||||||||||
и эластических волокон и т. д.), однако |
процесса такая периодизация пред- |
|||||||||||||||
они бывают выражены в минималь |
ставляется |
наиболее |
целесообразной. |
|||||||||||||
ной степени. Первичным натяжением |
Современные |
методы |
исследова- |
|||||||||||||
заживают, например, стянутые шва- |
ния — электронно-микроскопический, |
|||||||||||||||
ми |
разрезы |
|
после |
хирургических |
гистохимические, |
иммуноцитохимиче- |
||||||||||
вмешательств. |
|
|
|
|
|
ские, электронно-микроскопическая ав- |
||||||||||
К второму варианту относятся те |
торадиография — позволяют |
допол- |
||||||||||||||
случаи, когда объем поражения велик |
нить изучение общей морфологии за- |
|||||||||||||||
и края раны оказываются на более |
живления раны анализом интимных |
|||||||||||||||
или |
менее значительном |
расстоянии |
процессов, развертывающихся в каж- |
|||||||||||||
друг от друга. Заживление раны осу- |
дом из многих типов клеток на разных |
|||||||||||||||
ществляется через ее воспаление (на- |
его этапах. В этом состоит новый, сов- |
|||||||||||||||
гноение), формирование хорошо выра- |
ременный |
аспект морфологического |
||||||||||||||
женной грануляционной ткани и по- |
изучения |
гистогенеза |
заживления |
|||||||||||||
следующее ее фиброзирование с обра- |
раны, которое в итоге должно привес- |
|||||||||||||||
зованием глубокого рубца. В этих слу- |
ти к существенному расширению и |
|||||||||||||||
чаях |
заживление |
раны |
происходит |
углублению |
сложившихся |
в |
течение |
|||||||||
вторичным натяжением. |
|
|
последних 100 лет классических пред- |
|||||||||||||
Некоторые |
авторы |
выделяют еще |
ставлений о динамике раневого про- |
|||||||||||||
так называемое заживление под стру- |
цесса. Становится очевидным, что на |
|||||||||||||||
пом, когда дефект ткани покрыт ко- |
протяжении раневого процесса фибро- |
|||||||||||||||
рочкой из свернувшегося и подсохше- |
бласты, макрофаги, тучные и другие |
|||||||||||||||
го секрета, |
крови |
и |
некротических |
клетки |
проходят |
сложнейшую |
внут- |
|||||||||
