
- •В.И. Вершинин, т.В. Антонова, с.В. Усова
- •По аналитической химии
- •Часть 1
- •Издание ОмГу Омск 1998
- •1. Введение для преподавателей
- •2. Правила безопасной работы в лаборатории аналитической химии
- •3. Правила взвешивания на двухчашечных демпферных аналитических весах 2
- •4. Оформление отчетов по лабораторным работам
- •5. Лабораторные работы по химическим методам анализа
- •5.1. Гравиметрическое определение железа Методические указания к лабораторной работе № 1
- •5.2. Аргентометрическое определение галогенидов Методические указания к лабораторной работе № 2
- •А. Стандартизация раствора AgNOз
- •Б. Титрование по методу Мора
- •В. Титрование по методу Фаянса
- •Г. Титрование по методу Фольгарда
- •Д. Выполнение контрольной задачи
- •5.3. Кислотно-основное титрование сильных электролитов Методические указания к лабораторной работе № 3
- •А. Приготовление раствора нCl и его стандартизация методом пипетирования
- •Б. Приготовление раствора NаOh, стандартизация его методом отдельных навесок
- •В. Проверка правильности стандартизации растворов нСl и NaOh
- •5.4. Кислотно - основное титрование слабых электролитов Методические указания к лабораторной работе № 4
- •А. Определение концентрации ледяной уксусной кислоты
- •Б. Определение концентрации водного раствора аммиака
- •В. Определение содержаний карбоната и бикарбоната натрия в их смеси
- •Г. Раздельное определение соляной и борной кислот в смеси. Метод замещения
- •Д. Определение содержания аммонийного азота в солях аммония
- •5.5. Кислотно - основное титрование в неводных средах Методические указания к лабораторной работе № 5
- •Краткие теоретические сведения
- •А. Стандартизация раствора нСlO4в сн3соон
- •Б. Определение концентрации анилина
- •В. Определение состава смеси ацетата и хлорида натрия
- •5.6. Комплексонометрическое титрование Методические указания к лабораторной работе № 6
- •А. Стандартизация рабочего раствора комплексона III по фиксаналу MgSo4
- •Б. Способы установления конечной точки титрования
- •В. Определение общей и кальциевой жесткости воды
- •Г. Способы проведения комплексонометрических титрований
- •Сравнение результатов при титровании разными способами
- •Д. Комплексонометрическое титрование многокомпонентных систем
- •5.7. Перманганатометрическое титрование Методические указания к лабораторной работе № 7
- •А. Стандартизация раствора kMnO4
- •Б. Определение содержания Fe (II) в соли Мора
- •5.8. Хроматометрическое титрование Методические указания к лабораторной работе № 8
- •А. Приготовление рабочего раствора. Прямое титрование восстановителей
- •Б. Определение неустойчивых восстановителей (SnCi2) по методу замещения
- •В. Определение окислителей по методу обратного титрования
- •5.9. Иодометрия Методические указания к лабораторной работе № 9
- •А. Стандартизация рабочего раствора иода
- •Б. Определение концентрации раствора Na2so3методом обратного титрования
- •В. Определение концентрации ионов меди (II) по способу замещения
- •Г. Иодометрическое определение кислот
- •Д. Определение концентрации перекиси водорода по методу замещения
- •6. Материалы для подготовки к практическим занятиям
- •6.1. Правила записи исходных данных и расчет результатов. Использование констант
- •Практическое занятие № 1
- •Оценка погрешности результатов расчета и правила их записи.
- •Примеры решения типовых задач
- •Контрольные вопросы
- •6.2. Расчет гетерогенного равновесия “осадок - раствор” Практическое занятие № 2 Теоретические сведения
- •Расчет возможности осаждения при добавлении реагента-осадителя.
- •Примеры решения типовых задач
- •Контрольные вопросы
- •6.3. Расчеты протолитических равновесий Практическое занятие № 3
- •Теоретические сведения
- •Примеры расчетов
- •Контрольные вопросы
- •6.4. Расчеты равновесий комплексообразования Практическое занятие № 4 Теоретические сведения
- •Расчет концентрации свободных ионов металла в отсутствие избытка лиганда
- •Расчеты закомплексованности и маскирования при введении избытка лиганда
- •Определение степени образования различных комплексов в их смеси
- •Примеры решения типовых задач
- •Контрольные вопросы
- •6.5. Расчет результатов титриметрического анализа Практическое занятие № 5 Теоретические сведения
- •Расчет результатов прямого или заместительного титрования
- •Расчет результатов обратного титрования
- •Другие способы расчета
- •Точность результатов титриметрического анализа
- •Примеры решения типовых задач
- •Контрольные вопросы
- •6.6. Статистическая обработка данных. Вычисление и использование доверительных интервалов Практическое занятие № 6 Теоретические сведения
- •Примеры типовых расчетов
- •Контрольные вопросы
- •7. Задачи для самостоятельного решения
- •7.1. Типовые задачи Запись и оценка точности исходных данных
- •Расчеты, связанные с растворимостью осадков
- •Расчеты, связанные с процессом протолиза
- •Расчеты, связанные с равновесием комплексообразования
- •Расчет результатов в титриметрическом анализе
- •Статистическая обработка результатов
- •7.2. Нетрадиционные задачи
- •8. Методические указания для самостоятельной работы на пэвм с применением расчетных программ
- •Справочные материалы (приложения)
- •Коэффициенты активности ионов [8]
- •Свойства некоторых протолитических растворителей
- •Константы кислотности некоторых кислотно-основных пар (кислотные константы)
- •Мольная доля наиболее депротонированных форм вещества HnR (например, анионов Rn-)
- •Закомплексованность металлов с некоторыми маскирующими реагентами-лигандами при разной концентрации l (без учета рН)
- •Критерии отбраковки грубых промахов а) значения q-теста для разных уровней значимости
- •Б) критические значения максимального относительного отклонения [16]
- •Коэффициенты Стьюдента для некоторых уровней значимости
- •Значения критерия Фишера а) для уровня значимости 0,05:
- •Литература
- •Содержание
- •Часть 1
- •В.И. Вершинин, т.В. Антонова, с.В. Усова
- •По аналитической химии
- •Часть 1
Определение степени образования различных комплексов в их смеси
Чтобы найти i- мольную долю любого комплекса в их равновесной смеси, следует разделить на Ф соответствующее слагаемое в формулах (21) или (21а). Доля комплекса ML составляет1[L] / Ф, доля комплекса МL2-2[L]2/ Ф и т. д. В общем случае
i = i[L]i/ Ф. (24)
Например, в 0,1 M по роданиду растворе соли железа, где мольная доля свободного железа была всего 0,0027, доля комплекса Fe(SCN)++ равна 107:368=0,291; доля комплекса Fe(SCN)2+равна 214:368= 0,580 и т.д. Самое большое слагаемое в формуле (21a) соответствует доминирующему комплексу. Естественно, при переходе к другой концентрации свободного лиганда мольные доли всех комплексов изменяются и в новых равновесных условиях, возможно, будет доминировать другой комплекс. Более детально этот вопрос рассмотрен при решении примера 5.
В литературе описаны и способы решения обратной задачи - нахождения интервала концентраций лиганда, обеспечивающих доминирование комплекса заданного состава, но эти расчеты значительно сложнее и выходят за рамки базового курса аналитической химии. В настоящем пособии такие расчеты не рассматриваются. Решение можно найти в других книгах, например [17-18]. В ходе этих расчетов используются не общие, а ступенчатые константы устойчивости (или нестойкости).
Примеры решения типовых задач
1.Рассчитать концентрацию ионов Ag+в растворе, где равновесная концентрация молекул NH3равна 0,1 моль/л, а общая концентрация серебра (I) - 0,001 моль/л.
Решение.Первый способ (см. [1]). Известно, что серебро связывается аммиаком в основном в комплекс состава 1:2. Запишем уравнение реакции:
Ag++ 2NH3Ag(NH3)2+;
2=![]() = 107,24 ;
= 107,24 ;
СAg = 0,001; [NH3] = 0,1.
В алгебраическом выражении константы устойчивости комплекса две величины неизвестны. Одну из них - [Ag] - необходимо найти по условию задачи, ее обозначим как x. Вторую же - [Ag(NH3)2] - можно рассчитать из уравнения материального баланса:
CАg = [Ag] + [Ag(NH3)] + [Ag(NH3)2],
откуда [Ag(NH3)2] = CАg - [Ag] - [Ag(NH3)].
Пренебрегая концентрацией неустойчивого промежуточного комплекса состава 1:1 (т.е. ступенчатым характером комплексообразования), получаем:
[Ag(NH3)2]CАg - [Ag] = 0,001 - х.
Найденное выражение подставляем в уравнение константы
(0,001 - х) / х · 0,12= 107,24.
Полученное уравнение содержит только одну неизвестную величину и легко решается. Решение можно еще больше упростить, если заметить, что комплекс довольно прочен, CАg >> [Ag], следовательно:
0,001 - х 0,001 0,1 / х107,24 х = 10- 8,24, [Ag]6·10-9 моль/л.
Второй способ. Рассчитаем закомплексованность серебра в аммиачные комплексы без упрощений, по формуле (21а):
Ф = 1 + 103,32·10-1 + 107,23·(10-1)2 = 1 + 102,32 + 105,23 = 1 + 209 + 169824 =
= 170234 1,7·105
[Ag] = C Ag/ Ф = 0,001 / 1,7·105 6·10-9 (моль/ литр).
Судя по соотношению слагаемых при расчете закомплексованности, в данных условиях выход комплекса 1:2 почти на 3 порядка больше, чем комплекса 1:1, следовательно, концентрацией ненасыщенного комплекса в предыдущем варианте решения действительно можно было пренебречь.
Третий способ. Очевидно, [Ag] = CАg / Ф. Следовательно, lg[Ag] = = lg CАg - lg Ф. Величина lgCAg по условию равна -3. По таблице поправок на маскирование (приложение 6) находим, что для серебра в 0,1 М аммиачном растворе lgФ = 5,2. Подставляем эти величины в выведенную формулу:
lg [Ag] = -3-5,2 = -8,2 [Ag] 6·10-9 (моль/ литр).
Oчевидно, этот способ формален. Второй способ для начинающих предпочтительнее.
2. Вычислить мольную долю комплекса FeSCN2+ в растворе, где общая концентрация роданида калия равна 0,01 М, а железа(III) - 10-4 M.
Решение. Расходом роданида на связывание железа в комплексы пренебрегаем (это справедливо, если СSCN >> CFe), тогда [SCN]=0,01 моль/л, рSCN = 2,0. Для железа (III) известно шесть роданидных комплексов: FeSCN2+; Fe(SCN)2+;..... Fe(SCN)63-. По справочнику [8] общие константы устойчивости этих комплексов имеют значения логарифмов, соответственно равные 3,03; 4,33; 4,63; 4,53; 4,23; 3,23. Для расчета общей закомплексованности нужно только подставить эти значения в формулу (21а), а для вычисления степени образования монороданидного комплекса взять из этой формулы соответствующее слагаемое и разделить его на общую закомплексованность. Такой вариант быстрее, чем подстановка данных в формулу (24).
Ф=1+10lgi - ipL =1+103,03-2+104,33-4+10 4,63-6 +10 4,53-8 +10 4,23-10 +10 3,23-12 =
= 1 + 101,03+ 100,33+ 10-1,37+ 10-3,47+ 10-5,77+ 10-8,77 13,9.
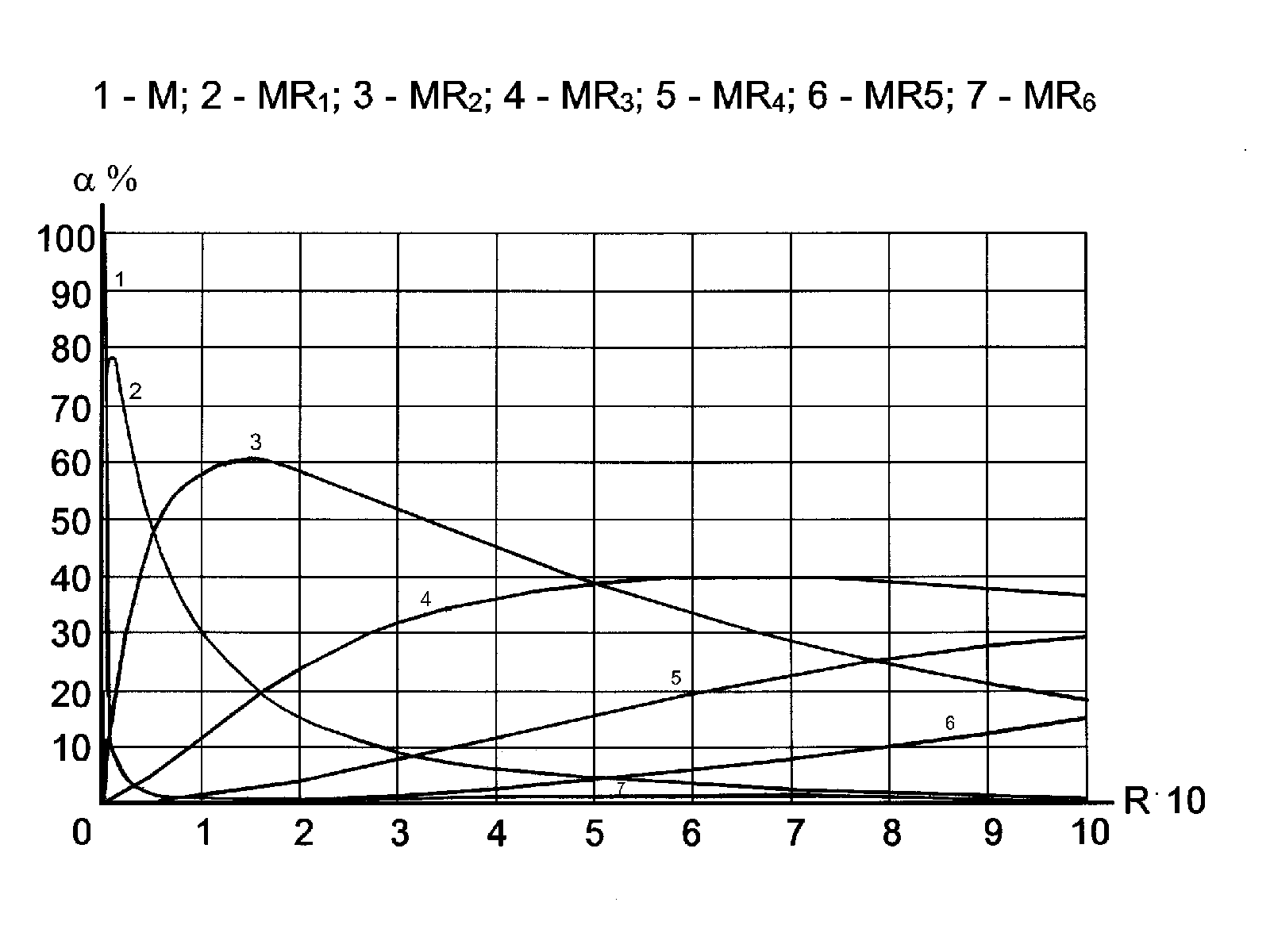
Рис.2. Диаграмма распределения железороданидных комплексов
3.Вычислить, какую концентрацию аммиака (избыточную) надо создать в растворе при САg = 10-4моль/л, чтобы снизить концентрацию катионов Ag+в 1000 раз.
Решение.Очевидно, надо добиться закомплексованности серебра Ф = 1000. При избытке аммиака в растворе доминирует насыщенный комплекс Ag(NH3)2+. Пренебрегаем существованием ненасыщенного комплекса AgNH3+и рассчитываем концентрацию свободного лиганда по приближенной формуле (23), концентрация серебра при этом не важна:
[
NH3]![]()
![]() 10-2,18·10-3(моль/л).
10-2,18·10-3(моль/л).
4. Какую концентрацию молекул аммиака надо создать в растворе, чтобы при рН 8 медь (II) оставалась в растворе в виде аммиачного комплекса и не выпадала в осадок в виде гидроксида? Начальная концентрация меди(II) равна 10-4моль/литр.
Решение. Рассчитаем, при какой концентрации свободных ионов меди при рН 6 начнется осаждение Cu(OH)2. Величина ПРСu(OH)210-32, откуда
[Cu]
=
![]() =
=![]() = 10-16.
= 10-16.
Чтобы осадок гидроксида меди не выпадал при рН 7, надо понизить концентрацию свободных ионов меди с 10-4 до 10-16, т.е. добиться закомплексованности, равной 1012 (можно и больше!). Концентрацию аммиака, создающую такую закомплексованность, рассчитаем по формуле (23), учитывая образование комплекса состава 1:4 и пренебрегая возможным образованием ненасыщенных аммиакатов меди:
[NH3]![]()
![]() 1 (моль/л).
1 (моль/л).
5.Кадмий (II) образует в растворе с иодид-ионами комплексные соединения различного состава, от 1:1 до 1:4. Какой именно комплекс доминирует при [I-]=0,1 моль/л?
Решение.Выше указывалось, что при одновременном существовании нескольких комплексов выход каждого из них пропорционален величине 10lgi -ipL. Следовательно, доминировать будет комплекс, у которого при данной концентрации лиганда этот показатель окажется наибольшим. Для системы Сd2+ - I-выпишем общие константы устойчивости всех иодидных комплексов и рассчитаем для этих комплексов разности (lgi-ipL). В данном случае [L] = 0,1 моль/л, следовательно, рL=1. Хотя рассчитанные значения разностей не слишком сильно отличаются между собой (см. таблицу): расчет степени образования каждого комплекса по формуле (24) показывает, что в данных условиях доминирует насыщенный комплекс СdI42-
|
Комплекс |
lg |
lg i - i pL |
, % |
|
СdI+ |
2,28 |
2,28 - 1 = 1,28 |
5,8 |
|
CdI2 |
3,92 |
3,92 - 2 = 1,92 |
25,3 |
|
CdI3- |
6,10 |
5,00 - 3 = 2,00 |
30,5 |
|
CdI42- |
5,00 |
6,10 - 4 = 2,10 |
38,4 |
При малом же избытке лиганда могут доминировать и ненасыщенные комплексы. Так, в той же системе при [I-]=0,010 доминирует комплекс состава 1:1, т.е. CdI+.
