
- •П.А. Киселев, с.Б. Бокуть курс лекций по физической химии
- •Введение
- •Лекция 1. Газовые законы
- •1.1. Температура и нулевой закон термодинамики
- •1.2. Законы поведения идеальных газов: уравнение состояния идеального газа
- •1.3. Кинетическое уравнение газов
- •1.4. Уравнение состояния реальных (неидеальных) газов. Уравнение Ван-дер-Ваальса
- •1.5. Закон парциальных давлений Дальтона
- •Лекция 2. Первое начало термодинамики и термохимия
- •2.1. Вводная часть
- •2.2. Некоторые понятия, используемые в термодинамике
- •2.3. Формулировка первого начала термодинамики
- •2.4. Применение первого начала термодинамики к различным процессам
- •2.5. Теплота химической реакции (общие положения)
- •2.6. Закон Гесса
- •2.7. Следствие из закона Гесса
- •Лекция 3. Второе начало термодинамики и его применение
- •3.1. Основной смысл и значение второго закона термодинамики
- •3.2. Обратимые и необратимые процессы
- •3.3. Формулировка и математическое выражение второго начала термодинамики
- •3.4. Изменение энтропии изолированной системы
- •3.5. Статистическая природа второго начала термодинамики
- •Лекция 4. Третье начало термодинамики. Расчеты изменения энтропии при различных процессах
- •4.1. Формулировка третьего начала термодинамики
- •4.2. Абсолютные и стандартные значения энтропии
- •4.3. Расчеты изменения энтропии в различных процессах
- •1. Расчеты изменения энтропии при изотермических процессах
- •2. Расчет изменения энтропии в неизотермических процессах
- •3. Расчет изменения энтропии сложного процесса
- •4.4. Расчет изменения энтропии при протекании химического процесса
- •4.5. Критерии направления протекания процессов и достижения равновесных состояний в открытых и закрытых системах. Понятие об энергии Гиббса
- •Лекция 5. Химические реакции как открытые в термодинамическом смысле системы. Направление протекания химических реакций. Равновесные химические реакции
- •5.1. Понятие о химическом потенциале
- •5.2. Экзергонические и эндергонические реакции
- •5.3. Взаимосвязь энтальпийного и энтропийного факторов в качестве критерия самопроизвольного протекания химической реакции
- •5.4. Понятие о равновесии химической реакции. Обратимые и необратимые реакции
- •5.5. Уравнение изотермы химической реакции и вывод закона действующих масс
- •5.6. Зависимость константы химического равновесия от температуры
- •Лекция 6. Химическое равновесие в гетерогенных и гомогенных системах
- •6.1. Взаимосвязь химического потенциала с другими термодинамическими функциями
- •6.2. Летучесть
- •6.3. Идеальный раствор
- •6.4. Фазовая диаграмма содержит зоны, линии и тройную точку
- •6.5. Уравнение Клаузиуса-Клапейрона
- •6.6. Коллигативные свойства растворов
- •6.7. Понижение точки замерзания и повышение точки кипения растворов
- •6.8. Осмотическое давление
- •6.9. Растворы электролитов
- •Лекция 7. Растворы электролитов
- •7.1. Общие сведения о теории электролитической диссоциации
- •7.2. Сильные и слабые электролиты
- •7.3. Закон разведения
- •7.4. Сильные электролиты
- •7.5. Ионная сила
- •7.6. Произведение растворимости
- •7.7. Электролитическая диссоциация воды
- •7.8. Концентрация водородных ионов
- •7.9. Буферные растворы
- •7.10. Механизм действия буферных растворов
- •7.11. Буферная емкость
- •Лекция 8. Основные понятия химической кинетики
- •8.1. Химическая реакция
- •8.2. Механизм химической реакции
- •8.3. Исходные, конечные и промежуточные вещества
- •8.4. Глубина превращения реакции
- •8.5. Гомогенные и гетерогенные реакции
- •8.6. Скорость химической реакции
- •8.7. Измерение скорости реакции
- •8.8. Порядок реакции и константа скорости реакции
- •8.9. Молекулярность реакции
- •8.10. Количественные соотношения между скоростью реакции и концентрацией реагента
- •8.11. Реакция второго порядка
- •8.12. Уравнение скорости реакции третьего порядка
- •8.13. Уравнение скорости реакции нулевого порядка
- •8.14. Определение порядка реакции
- •8.15. Теоретические основы химической кинетики
- •8.15.1. Теория активных соударений
- •8.15.2. Теория активированного (переходного) комплекса (переходного состояния)
- •8.15.3. Вывод основного уравнения теории переходного состояния
- •8.15.4. Термодинамическая форма основного уравнения теории переходного состояния
- •8.15.5. Сравнение термодинамической формы основного уравнения теории переходного состояния с уравнением Аррениуса
- •Лекция 9. Основы кинетики и механизма ферментативных реакций. Гомогенный и гетерогенный катализ
- •9.1. Понятие катализа
- •9.2. Основы теории гомогенного катализа
- •9.3. Основы теории гетерогенного катализа
- •9.4. Ферменты как биологические катализаторы
- •9.5. Кинетика реакций, катализируемых ферментами
- •9.6. Физический смысл величин Km и Vmax
- •9.7. Уравнение Михаэлиса-Ментен и ферментативные механизмы
- •9.8. Общее уравнение скорости
- •Лекция 10. Электрохимия
- •10.1. Введение в электрохимию
- •10.2. Термодинамика электрохимических систем
- •10.3. Электродный потенциал
- •10.4. Двойной электрический слой на границе между металлом и раствором электролита
- •10.5. Зависимость плотности заряда от концентрации электролита
- •Лекция 11.Электродные и безэлектродные электрохимические системы
- •11.1. Правила записи эдс и электродных потенциалов электрохимических систем
- •11.2. Типы электродов
- •11.3. Диффузионный и межжидкостный потенциалы
- •На электродах протекают реакции
- •11.5. Концентрационные цепи
- •Лекция 12. Поверхностные явления и адсорбция
- •12.1. Общая характеристика поверхностных явлений
- •12.2. Поверхностные явления в дисперсных системах
- •12.3. Поверхностное натяжение и природа вещества
- •12.4. Термодинамика поверхностных явлений в однокомпонентных системах
- •12.5. Равновесие фаз при искривленной поверхности раздела. Капиллярность
- •12.6. Уравнение Томсона
- •12.7. Капиллярные явления
- •Лекция 13. Адсорбция
- •13.1. Уравнение адсорбции Гиббса
- •13.2. Обзор сорбционных явлений
- •13.3. Природа адсорбционного взаимодействия
- •13.4. Термическое уравнение адсорбции. Изотерма адсорбции
- •13.5. Мономолекулярная адсорбция и изотерма Ленгмюра
- •Литература
- •Содержание
1.4. Уравнение состояния реальных (неидеальных) газов. Уравнение Ван-дер-Ваальса
Речь уже шла о том, что свойства реальных газов редко полностью могут быть описаны законами, выведенными для идеальных газов. Это особенно касается состояний при высоких давлениях и низких температурах. В этих условиях объем системы становится относительно малым и необходимо учитывать собственный объем молекул. Кроме того, начинают действовать силы межмолекулярного притяжения. Для идеального газа произведение PV является постоянным.
Рис. 1.2 показывает, что поведение О2, Н2иCO2отклоняется от поведения идеального газа. Причем вид отклонения зависит от природы газа.
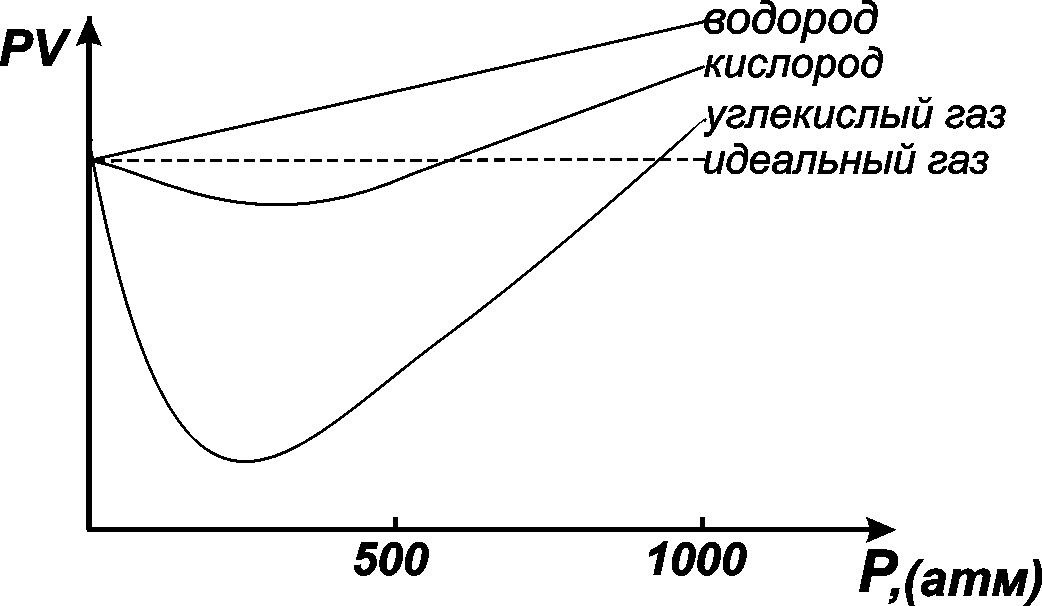
Рис. 1.2. Отклонение в поведении реальных газов от идеального в условиях высоких давлений
Чтобы как-то устранить
причины, из-за которых уравнение
идеального газа практически неприменимо
для описания поведения реальных газов,
Ван-дер-Ваальс в 1879 году предложил
включить в него два дополнительных
члена – аиb: константуадобавляют кРдля того, чтобы
учесть (скомпенсировать) уменьшение
давления из-за межмолекулярного
притяжения; константаbучитывает эффективный объем молекул
газа, и она вычитается из![]() .
Обе константы подбирались эмпирически.
В результате для одного моля газа
уравнение приобретает вид:
.
Обе константы подбирались эмпирически.
В результате для одного моля газа
уравнение приобретает вид:
![]() . (1.18)
. (1.18)
Однако в этом
уравнении появились еще некоторые
члены. Так, поправка к давлению принята
равной
![]() по
той причине, что молекулы на поверхности
газа притягиваются не только друг к
другу (к молекулам на поверхности),
но и к молекулам, находящимся внутри.
Сила притяжения зависит от плотности
газа как на поверхности, так и внутри.
Поскольку плотность – этомасса/V,
то ее влияние можно учесть умножением
константы а на1/V2.
Поправкаb в реальном
случае примерно в 4 раза превышает
собственный объем молекул моля газа.
Ее иногда называют исключенным объемом,
так как она соответствует пространству,
реально исключаемому одним молем плотно
упакованных молекул. Поправки а иbдля любого газа
приводятся в расчете на 1 моль.
Если количество газа больше или меньше
одного моля, необходимо пользоваться
следующим уравнением
по
той причине, что молекулы на поверхности
газа притягиваются не только друг к
другу (к молекулам на поверхности),
но и к молекулам, находящимся внутри.
Сила притяжения зависит от плотности
газа как на поверхности, так и внутри.
Поскольку плотность – этомасса/V,
то ее влияние можно учесть умножением
константы а на1/V2.
Поправкаb в реальном
случае примерно в 4 раза превышает
собственный объем молекул моля газа.
Ее иногда называют исключенным объемом,
так как она соответствует пространству,
реально исключаемому одним молем плотно
упакованных молекул. Поправки а иbдля любого газа
приводятся в расчете на 1 моль.
Если количество газа больше или меньше
одного моля, необходимо пользоваться
следующим уравнением
![]() . (1.19)
. (1.19)
В практике при расчетах обычно используются табличные данные по значениям а иb.
Это важно в некоторых случаях при расчетах метаболических процессов, в результате которых выделяется, например, СО2.
Однако в большинстве случаев при метаболических процессах давление выделившегося газа относительно невелико. Поэтому ошибка при использовании уравнения, применимого к идеальному газу, для расчетов поведения реальных газов находится в пределах 1-2%. Это меньше, чем стандартная ошибка большинства экспериментов, и поэтому в обычных условиях уравнение Ван-дер-Ваальса используется редко.
1.5. Закон парциальных давлений Дальтона
Зато очень часто в практике необходимо использование закона Дальтона, или закона парциальных давлений. Он основан на том, что в смеси газов каждый газ оказывает такое же давление, какое он оказывал бы, если бы в сосуде присутствовал один.
Давление компонентов газовой смеси зависит только от числа молей каждого из них, так как температура и объем для всех газов в смеси одинаковы.
Давление каждого из газов называют парциальным давлением. Согласно закону парциальных давлений Дальтона, общее давление газовой смеси равно сумме парциальных давлений:
Pобщ=P1+P2+P3+ ... +PN.(1.20)
Если V – общий объем, аn1, n2, n3и т.д. – число молей каждого компонента, то
PV=n1RT+n2RT+n3RT+...+nNRT=RT(n1+n2+n3+...+nN). (1.21)
Парциальное давление одного из газов, допустим 1, будет равно
![]() . (1.22)
. (1.22)
Понятно, что отношение парциального давления газа к его общему давлению равно отношению числа молей этого компонента к числу молей всех газов в смеси:
![]() . (1.23)
. (1.23)
Это отношение называют молярной долей и обозначают символом Х. Для газа 1 молярная доля равнаХ1и т.д. Парциальное давление учитывается во многих расчетах. Например, операции по измерению объемов, включающих сбор газов над поверхностью воды, требуют учета парциального давления паров воды в газовой смеси. По сравнению с водяными парами пары ртути имеют значительно более низкое давление, и это создает ощутимые преимущества при использовании ртути в качестве вытесняемой жидкости, так как парциальным давлением паров ртути в таких расчетах вполне можно пренебречь.
С другой стороны, хорошо известно, что вдыхаемый нами воздух является смесью газов. Выдыхаемый воздух отражает происходящий в легких процесс газового обмена. Он насыщен парами воды. Парциальное давление водяного пара достаточно заметно и равно приблизительно 48 мм.р.с. Поэтому, если общее давление выдыхаемого воздуха равно 760 мм, то давление, обусловленное смесью газов О2 + СО2 + N2, будет равно не 760, а 760 – 48 = 712 мм.р.с.
