
- •П.А. Киселев, с.Б. Бокуть курс лекций по физической химии
- •Введение
- •Лекция 1. Газовые законы
- •1.1. Температура и нулевой закон термодинамики
- •1.2. Законы поведения идеальных газов: уравнение состояния идеального газа
- •1.3. Кинетическое уравнение газов
- •1.4. Уравнение состояния реальных (неидеальных) газов. Уравнение Ван-дер-Ваальса
- •1.5. Закон парциальных давлений Дальтона
- •Лекция 2. Первое начало термодинамики и термохимия
- •2.1. Вводная часть
- •2.2. Некоторые понятия, используемые в термодинамике
- •2.3. Формулировка первого начала термодинамики
- •2.4. Применение первого начала термодинамики к различным процессам
- •2.5. Теплота химической реакции (общие положения)
- •2.6. Закон Гесса
- •2.7. Следствие из закона Гесса
- •Лекция 3. Второе начало термодинамики и его применение
- •3.1. Основной смысл и значение второго закона термодинамики
- •3.2. Обратимые и необратимые процессы
- •3.3. Формулировка и математическое выражение второго начала термодинамики
- •3.4. Изменение энтропии изолированной системы
- •3.5. Статистическая природа второго начала термодинамики
- •Лекция 4. Третье начало термодинамики. Расчеты изменения энтропии при различных процессах
- •4.1. Формулировка третьего начала термодинамики
- •4.2. Абсолютные и стандартные значения энтропии
- •4.3. Расчеты изменения энтропии в различных процессах
- •1. Расчеты изменения энтропии при изотермических процессах
- •2. Расчет изменения энтропии в неизотермических процессах
- •3. Расчет изменения энтропии сложного процесса
- •4.4. Расчет изменения энтропии при протекании химического процесса
- •4.5. Критерии направления протекания процессов и достижения равновесных состояний в открытых и закрытых системах. Понятие об энергии Гиббса
- •Лекция 5. Химические реакции как открытые в термодинамическом смысле системы. Направление протекания химических реакций. Равновесные химические реакции
- •5.1. Понятие о химическом потенциале
- •5.2. Экзергонические и эндергонические реакции
- •5.3. Взаимосвязь энтальпийного и энтропийного факторов в качестве критерия самопроизвольного протекания химической реакции
- •5.4. Понятие о равновесии химической реакции. Обратимые и необратимые реакции
- •5.5. Уравнение изотермы химической реакции и вывод закона действующих масс
- •5.6. Зависимость константы химического равновесия от температуры
- •Лекция 6. Химическое равновесие в гетерогенных и гомогенных системах
- •6.1. Взаимосвязь химического потенциала с другими термодинамическими функциями
- •6.2. Летучесть
- •6.3. Идеальный раствор
- •6.4. Фазовая диаграмма содержит зоны, линии и тройную точку
- •6.5. Уравнение Клаузиуса-Клапейрона
- •6.6. Коллигативные свойства растворов
- •6.7. Понижение точки замерзания и повышение точки кипения растворов
- •6.8. Осмотическое давление
- •6.9. Растворы электролитов
- •Лекция 7. Растворы электролитов
- •7.1. Общие сведения о теории электролитической диссоциации
- •7.2. Сильные и слабые электролиты
- •7.3. Закон разведения
- •7.4. Сильные электролиты
- •7.5. Ионная сила
- •7.6. Произведение растворимости
- •7.7. Электролитическая диссоциация воды
- •7.8. Концентрация водородных ионов
- •7.9. Буферные растворы
- •7.10. Механизм действия буферных растворов
- •7.11. Буферная емкость
- •Лекция 8. Основные понятия химической кинетики
- •8.1. Химическая реакция
- •8.2. Механизм химической реакции
- •8.3. Исходные, конечные и промежуточные вещества
- •8.4. Глубина превращения реакции
- •8.5. Гомогенные и гетерогенные реакции
- •8.6. Скорость химической реакции
- •8.7. Измерение скорости реакции
- •8.8. Порядок реакции и константа скорости реакции
- •8.9. Молекулярность реакции
- •8.10. Количественные соотношения между скоростью реакции и концентрацией реагента
- •8.11. Реакция второго порядка
- •8.12. Уравнение скорости реакции третьего порядка
- •8.13. Уравнение скорости реакции нулевого порядка
- •8.14. Определение порядка реакции
- •8.15. Теоретические основы химической кинетики
- •8.15.1. Теория активных соударений
- •8.15.2. Теория активированного (переходного) комплекса (переходного состояния)
- •8.15.3. Вывод основного уравнения теории переходного состояния
- •8.15.4. Термодинамическая форма основного уравнения теории переходного состояния
- •8.15.5. Сравнение термодинамической формы основного уравнения теории переходного состояния с уравнением Аррениуса
- •Лекция 9. Основы кинетики и механизма ферментативных реакций. Гомогенный и гетерогенный катализ
- •9.1. Понятие катализа
- •9.2. Основы теории гомогенного катализа
- •9.3. Основы теории гетерогенного катализа
- •9.4. Ферменты как биологические катализаторы
- •9.5. Кинетика реакций, катализируемых ферментами
- •9.6. Физический смысл величин Km и Vmax
- •9.7. Уравнение Михаэлиса-Ментен и ферментативные механизмы
- •9.8. Общее уравнение скорости
- •Лекция 10. Электрохимия
- •10.1. Введение в электрохимию
- •10.2. Термодинамика электрохимических систем
- •10.3. Электродный потенциал
- •10.4. Двойной электрический слой на границе между металлом и раствором электролита
- •10.5. Зависимость плотности заряда от концентрации электролита
- •Лекция 11.Электродные и безэлектродные электрохимические системы
- •11.1. Правила записи эдс и электродных потенциалов электрохимических систем
- •11.2. Типы электродов
- •11.3. Диффузионный и межжидкостный потенциалы
- •На электродах протекают реакции
- •11.5. Концентрационные цепи
- •Лекция 12. Поверхностные явления и адсорбция
- •12.1. Общая характеристика поверхностных явлений
- •12.2. Поверхностные явления в дисперсных системах
- •12.3. Поверхностное натяжение и природа вещества
- •12.4. Термодинамика поверхностных явлений в однокомпонентных системах
- •12.5. Равновесие фаз при искривленной поверхности раздела. Капиллярность
- •12.6. Уравнение Томсона
- •12.7. Капиллярные явления
- •Лекция 13. Адсорбция
- •13.1. Уравнение адсорбции Гиббса
- •13.2. Обзор сорбционных явлений
- •13.3. Природа адсорбционного взаимодействия
- •13.4. Термическое уравнение адсорбции. Изотерма адсорбции
- •13.5. Мономолекулярная адсорбция и изотерма Ленгмюра
- •Литература
- •Содержание
7.6. Произведение растворимости
Пусть насыщенный раствор какого-нибудь сильного электролита вида В2А3 находится в равновесии со своими кристаллами:
В2А3 кр.2В3++ 3А2-.
Константа равновесия будет равна
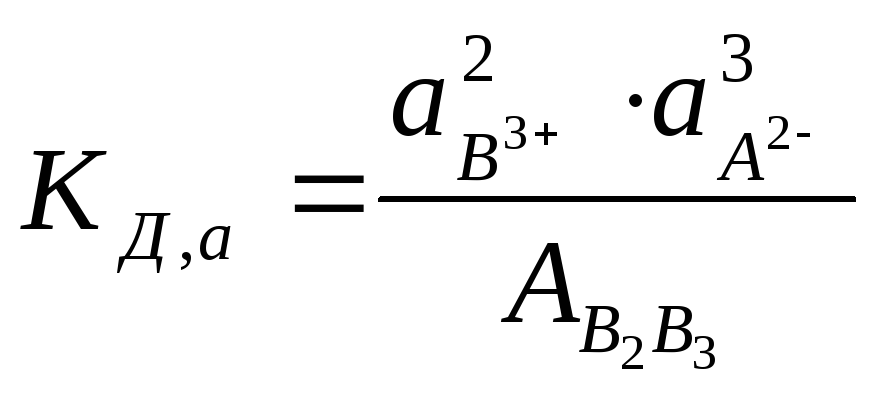 , (7.11)
, (7.11)
где аВ3+иаА2-- активности ионов в растворе;АВ2В3– активность электролита в осадке.
Так как АВ2В3при каждой данной температуре постоянна, то и числитель правой части приведенного уравнения при данной температуре тоже является величиной постоянной:
![]() . (7.12)
. (7.12)
Постоянная La носит название произведения растворимости, если в растворе отсутствуют другие электролиты, образующие ионы, например в случае раствораAgCl, то
![]() .
.
Учитывая малую растворимость хлористого серебра, можно от активностей перейти к концентрациям. Тогда
![]()
и растворимость хлористого серебра равна
![]() .
.
Если к насыщенному раствору хлористого серебра прибавить электролит, содержащий один общий с ним ион, то увеличение общей концентрации, например ионов Cl-, вызовет уменьшение концентрацииAg+.
Прибавление электролита, не содержащего общих ионов, может влиять на растворимость электролита лишь в той степени, в которой возрастание ионной силы раствора будет вызывать изменение коэффициентов активностей и, следовательно, самих активностей.
7.7. Электролитическая диссоциация воды
Хотя вода часто рассматривается как вещество, практически не диссоциирующее на ионы, однако в действительности в очень малой степени вода всегда диссоциирует по уравнению Н2О Н+ + ОН-.
Правда, необходимо помнить, что водородные ионы всегда образуют в воде ионы гидроксония Н3О+. Но для простоты обычно используют в качестве обозначения ион Н+, так как это не отражается на выводах. В растворах, содержащих кислоты, образуемые ими водородные ионы влияют на положение равновесия в реакции. В случае щелочей на равновесие влияют ионы гидроксила. Для Н2О:
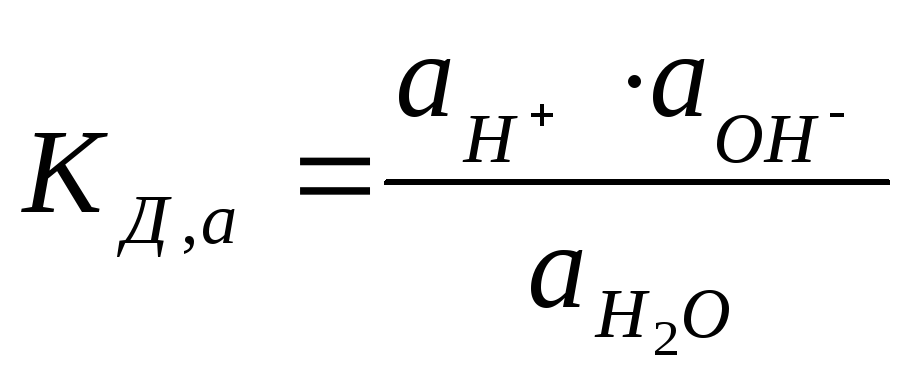 . (7.13)
. (7.13)
Для разбавленных растворов или для чистой воды вместо активности можно использовать концентрации:
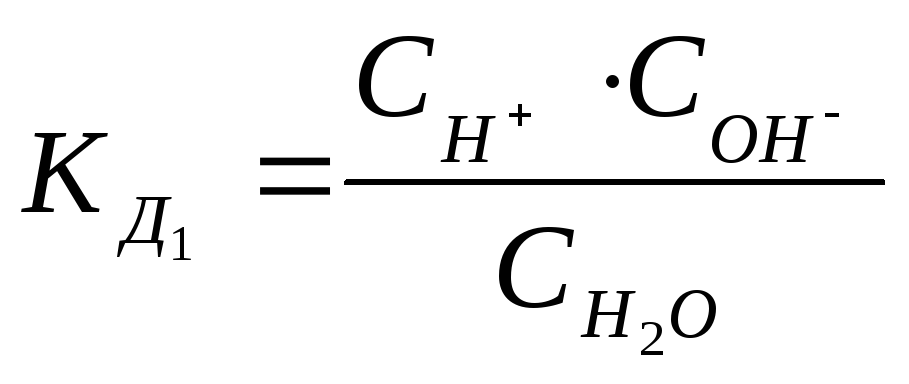 . (7.14)
. (7.14)
Степень диссоциации воды невелика, поэтому примем концентрацию ее постоянной и объединим с константой диссоциации воды в виде
Cн+ · Cон-= КВ,
где КВ– величина постоянная:
КВ= КД·CН2О . (7.15)
Эта постоянная носит название ионного произведения воды. При 25 оС ионное произведение водыКВ= 1,008 · 10-14. В чистой воде, а также в любой другой нейтральной средеCн+ = Cон-(условие нейтральности), тогда
Cн+
= Cон-=![]() =
1,004 · 10-7грамм-ионов в литре
=
1,004 · 10-7грамм-ионов в литре
и, следовательно, степень диссоциации αравна
![]() .
.
7.8. Концентрация водородных ионов
Однозначная связь между концентрациями ионов водорода и ионов гидроксила используется для характеристики кислотности и щелочности различных сред. Эти два понятия равнозначны, однако условились использовать для характеристики растворов активность водородных ионов. Практически используется не сама величина аН+, а так называемый водородный показатель рН, который определяется формулой
рН = - lgаН+, (7.16)
для разбавленных растворов
рН = - lgСН+. (7.17)
Водородным показателем называется величина, характеризующая активность (или концентрацию) водородных ионов и численно равная отрицательному десятичному логарифму этой активности (или концентрации, выраженной в грамм-ионах на литр). При 25 оС в нейтральной среде рН = 7, но с повышением температуры (поскольку реакция эндотермична) степень диссоциации повышается и наоборот:
- lgаН+ -lgаОН- = 14; -lgаН+= рН; -lgаОН- = рОН.
рН + рОН = 14 рН = 1 рОН = 13.
Тогда для сильных кислот:
HClH++Cl-C(HCl)=C(H+) (для разбавленных растворов)
pН = -lgCH+.
Для растворов сильных оснований:
NaOHNa++OH-;
C(NaOH) =COH-;pOH= -lgCOH-;
pH= 14 –pOH= 14 +lgCOH-.
Слабые кислоты и слабые основания диссоциируют не полностью. Их способность к диссоциации определяется константой диссоциации и степенью диссоциации. В этом случае взаимосвязь между рН, рКи концентрацией слабой кислоты выглядит следующим образом:
КД и С СН3СООНСН3СОО-+ Н+
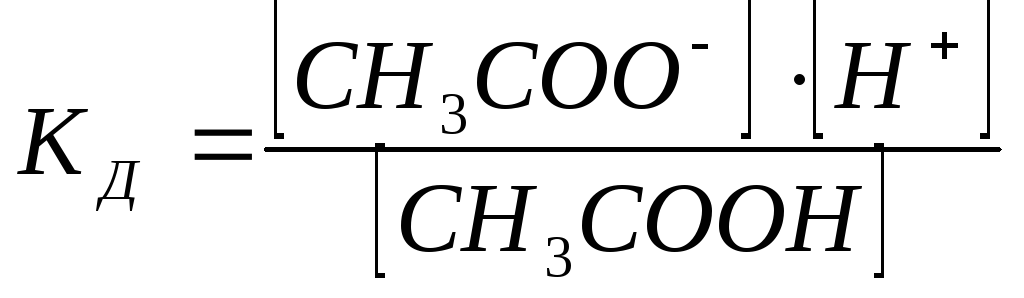 ,
,
если [CH3COOH] =CK, то:
![]() ;
;
![]()
-lg[ Н+] = ½ (-lgKД–lgCк);
рН = ½ рК – ½ lgCк.
Для слабых оснований
NH4OHNH4++OH-
![]() ;
;
![]()
рОН = ½ рKосн–½lgCосн; рН = 14 – ½ рKосн+ ½lgCосн .
Для слабых кислот существует следующая взаимосвязь между их концентрацией, степенью диссоциации и рН раствора:
рН = - lg(Ск).
В случае слабых оснований
pН = 14- рН = 14 +lgCосн .
