
- •П.А. Киселев, с.Б. Бокуть курс лекций по физической химии
- •Введение
- •Лекция 1. Газовые законы
- •1.1. Температура и нулевой закон термодинамики
- •1.2. Законы поведения идеальных газов: уравнение состояния идеального газа
- •1.3. Кинетическое уравнение газов
- •1.4. Уравнение состояния реальных (неидеальных) газов. Уравнение Ван-дер-Ваальса
- •1.5. Закон парциальных давлений Дальтона
- •Лекция 2. Первое начало термодинамики и термохимия
- •2.1. Вводная часть
- •2.2. Некоторые понятия, используемые в термодинамике
- •2.3. Формулировка первого начала термодинамики
- •2.4. Применение первого начала термодинамики к различным процессам
- •2.5. Теплота химической реакции (общие положения)
- •2.6. Закон Гесса
- •2.7. Следствие из закона Гесса
- •Лекция 3. Второе начало термодинамики и его применение
- •3.1. Основной смысл и значение второго закона термодинамики
- •3.2. Обратимые и необратимые процессы
- •3.3. Формулировка и математическое выражение второго начала термодинамики
- •3.4. Изменение энтропии изолированной системы
- •3.5. Статистическая природа второго начала термодинамики
- •Лекция 4. Третье начало термодинамики. Расчеты изменения энтропии при различных процессах
- •4.1. Формулировка третьего начала термодинамики
- •4.2. Абсолютные и стандартные значения энтропии
- •4.3. Расчеты изменения энтропии в различных процессах
- •1. Расчеты изменения энтропии при изотермических процессах
- •2. Расчет изменения энтропии в неизотермических процессах
- •3. Расчет изменения энтропии сложного процесса
- •4.4. Расчет изменения энтропии при протекании химического процесса
- •4.5. Критерии направления протекания процессов и достижения равновесных состояний в открытых и закрытых системах. Понятие об энергии Гиббса
- •Лекция 5. Химические реакции как открытые в термодинамическом смысле системы. Направление протекания химических реакций. Равновесные химические реакции
- •5.1. Понятие о химическом потенциале
- •5.2. Экзергонические и эндергонические реакции
- •5.3. Взаимосвязь энтальпийного и энтропийного факторов в качестве критерия самопроизвольного протекания химической реакции
- •5.4. Понятие о равновесии химической реакции. Обратимые и необратимые реакции
- •5.5. Уравнение изотермы химической реакции и вывод закона действующих масс
- •5.6. Зависимость константы химического равновесия от температуры
- •Лекция 6. Химическое равновесие в гетерогенных и гомогенных системах
- •6.1. Взаимосвязь химического потенциала с другими термодинамическими функциями
- •6.2. Летучесть
- •6.3. Идеальный раствор
- •6.4. Фазовая диаграмма содержит зоны, линии и тройную точку
- •6.5. Уравнение Клаузиуса-Клапейрона
- •6.6. Коллигативные свойства растворов
- •6.7. Понижение точки замерзания и повышение точки кипения растворов
- •6.8. Осмотическое давление
- •6.9. Растворы электролитов
- •Лекция 7. Растворы электролитов
- •7.1. Общие сведения о теории электролитической диссоциации
- •7.2. Сильные и слабые электролиты
- •7.3. Закон разведения
- •7.4. Сильные электролиты
- •7.5. Ионная сила
- •7.6. Произведение растворимости
- •7.7. Электролитическая диссоциация воды
- •7.8. Концентрация водородных ионов
- •7.9. Буферные растворы
- •7.10. Механизм действия буферных растворов
- •7.11. Буферная емкость
- •Лекция 8. Основные понятия химической кинетики
- •8.1. Химическая реакция
- •8.2. Механизм химической реакции
- •8.3. Исходные, конечные и промежуточные вещества
- •8.4. Глубина превращения реакции
- •8.5. Гомогенные и гетерогенные реакции
- •8.6. Скорость химической реакции
- •8.7. Измерение скорости реакции
- •8.8. Порядок реакции и константа скорости реакции
- •8.9. Молекулярность реакции
- •8.10. Количественные соотношения между скоростью реакции и концентрацией реагента
- •8.11. Реакция второго порядка
- •8.12. Уравнение скорости реакции третьего порядка
- •8.13. Уравнение скорости реакции нулевого порядка
- •8.14. Определение порядка реакции
- •8.15. Теоретические основы химической кинетики
- •8.15.1. Теория активных соударений
- •8.15.2. Теория активированного (переходного) комплекса (переходного состояния)
- •8.15.3. Вывод основного уравнения теории переходного состояния
- •8.15.4. Термодинамическая форма основного уравнения теории переходного состояния
- •8.15.5. Сравнение термодинамической формы основного уравнения теории переходного состояния с уравнением Аррениуса
- •Лекция 9. Основы кинетики и механизма ферментативных реакций. Гомогенный и гетерогенный катализ
- •9.1. Понятие катализа
- •9.2. Основы теории гомогенного катализа
- •9.3. Основы теории гетерогенного катализа
- •9.4. Ферменты как биологические катализаторы
- •9.5. Кинетика реакций, катализируемых ферментами
- •9.6. Физический смысл величин Km и Vmax
- •9.7. Уравнение Михаэлиса-Ментен и ферментативные механизмы
- •9.8. Общее уравнение скорости
- •Лекция 10. Электрохимия
- •10.1. Введение в электрохимию
- •10.2. Термодинамика электрохимических систем
- •10.3. Электродный потенциал
- •10.4. Двойной электрический слой на границе между металлом и раствором электролита
- •10.5. Зависимость плотности заряда от концентрации электролита
- •Лекция 11.Электродные и безэлектродные электрохимические системы
- •11.1. Правила записи эдс и электродных потенциалов электрохимических систем
- •11.2. Типы электродов
- •11.3. Диффузионный и межжидкостный потенциалы
- •На электродах протекают реакции
- •11.5. Концентрационные цепи
- •Лекция 12. Поверхностные явления и адсорбция
- •12.1. Общая характеристика поверхностных явлений
- •12.2. Поверхностные явления в дисперсных системах
- •12.3. Поверхностное натяжение и природа вещества
- •12.4. Термодинамика поверхностных явлений в однокомпонентных системах
- •12.5. Равновесие фаз при искривленной поверхности раздела. Капиллярность
- •12.6. Уравнение Томсона
- •12.7. Капиллярные явления
- •Лекция 13. Адсорбция
- •13.1. Уравнение адсорбции Гиббса
- •13.2. Обзор сорбционных явлений
- •13.3. Природа адсорбционного взаимодействия
- •13.4. Термическое уравнение адсорбции. Изотерма адсорбции
- •13.5. Мономолекулярная адсорбция и изотерма Ленгмюра
- •Литература
- •Содержание
13.2. Обзор сорбционных явлений
Адсорбция на границе раздела твердое тело/газ. В общем случае явления, связанные с перераспределением веществ между различными частями гетерогенной системы, называютсясорбцией. Сорбция (от лат.sorbeo– сгущать) – это изменение концентрации (часто увеличение) либо у поверхности раздела фаз (адсорбция), либо в объеме одной из фаз (абсорбция). Например, образование раствора за счет поглощения НСl(газа) и поглощение газа металлом (абсорбция). Поверхностная сорбция – адсорбция.
Твердое тело, у поверхности которого происходит адсорбция, называется адсорбентом, адсорбирующийся газ или адсорбирующийся компонент жидкого раствора –адсорбтивом, а адсорбированое вещество –адсорбат.
В строгом определении адсорбции она рассматривается как избыток вещества вблизи поверхности по сравнению с равным объемом вдали от нее. В ряде случаев удобнее рассматривать не избыток, а все количество адсорбата вблизи поверхности. Это количество обозначают символом аи называют полным содержанием, или просто адсорбцией (без указания гиббсова). Так как для пористых твердых тел бывает затруднительно знать величину поверхности, то часто адсорбцию относят не к единице поверхности, а к единице массы (моль/кг или моль/г).
Адсорбция самопроизвольна и протекает при Р=constсо снижением энергии Гиббса, а приV=const– со снижением энергии Гельмгольца. Однако при этом происходит не выравнивание концентраций по всему объему системы, а увеличение разности концентраций между газовой фазой (раствором) и поверхностью. Одновременно уменьшается подвижность сорбирующихся молекул. Оба фактора ведут к уменьшению энтропии (S0).
По основному уравнению термодинамики находим
H=TS+G(13.16)
Если величины SиG– отрицательны, то значениеН– отрицательно и процесс является экзотермическим.
Важной характеристикой адсорбции является теплота адсорбции. Она является мерой интенсивности адсорбционных сил – сил взаимодействия молекул адсорбата с поверхностью адсорбента и между собой.
Интенсивность взаимодействия адсорбент-адсорбат зависит от состояния адсорбента и от того, какое количество адсорбата уже адсорбировано (от заполнения поверхности). Поэтому различают два основных понятия – интегральная и дифференциальная теплота адсорбции.
Интегральной теплотой адсорбции Q называется полное количество теплоты, выделяющейся при адсорбции n молей адсорбата.Ее относят к единице массы адсорбента (Дж/кг). Дифференциальной теплотой адсорбции q называют отнесенное к 1 молю адсорбата дополнительное количество теплоты, выделяющейся при адсорбции бесконечно малого количества адсорбата:
![]() или
или
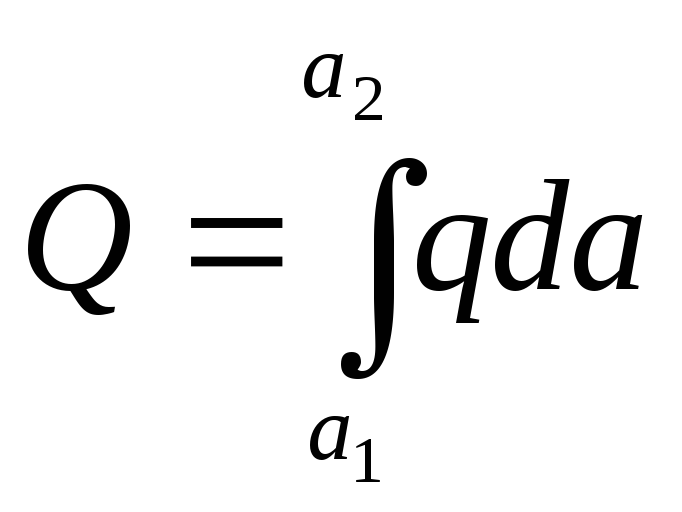 . (13.17)
. (13.17)
Типичные зависимости интегральной и дифференциальной теплоты адсорбции от количества адсорбированного вещества представлены на рисунке 13.2. Прямые 1 для Qи 2 дляqсоответствуют зависимостиQ=ka. Как правило, такая прямая зависимость не наблюдается (она возможна лишь приq=const). Фактически вследствие неоднородности поверхности адсорбента адсорбция происходит сначала на наиболее активных участках поверхности с наибольшим значением дифференциальной теплоты; при больших заполненияхqуменьшается. Это приводит к некоторому замедлению ростаQ. Возможен и третий случай. Вследствие взаимного притяжения адсорбированных молекул уменьшается расстояние между ними и дифференциальная теплота адсорбции повышается (кривая 3).

Рис. 13.2. Зависимость интегральной и дифференциальной теплоты адсорбции от количества адсорбированного вещества
